电解质知识复习导航
雷范军 吴惠华


电解质溶液是化学基本概念和基本理论的重要组成部分,也是每年高考必考的核心内容之一。下面根据高考理综化学考纲的要求对该部分知识的复习进行分析,以帮助同学们掌握该部分高考考查情况。
一、考情解密
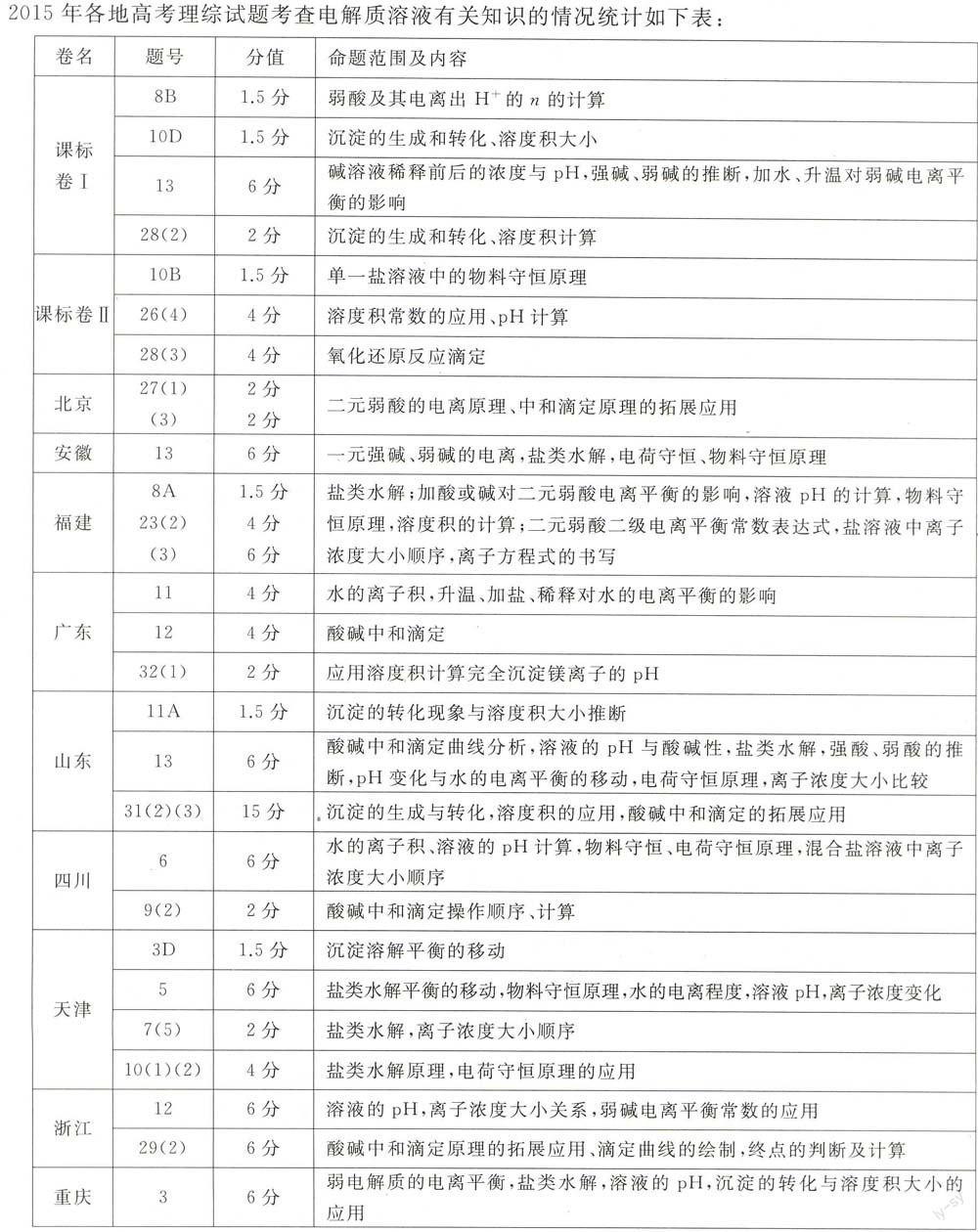
2015年各地高考理综试题考查电解质溶液有关知识的情况统计如下表:
二、考情分析
今年各省市高考理综化学试题有关电解质溶液的考查方式灵活,主要表现在以下几方面:(1)判断或解释强、弱电解质及其在水溶液中的电离原理;(2)弱电解质在水溶液中的电离平衡及其温度、浓度等对其影响规律的应用,电离常数的应用;(3)判断强电解质和弱电解质溶液的导电性,粒子(或离子)浓度大小或关系比较,电荷守恒、物料守恒等定律的应用;(4)水的电离及其主要影响因素,水的离子积的应用;(5)盐类水解原理及温度、浓度等对其影响规律的应用;(6)难溶电解质的溶解平衡应用,沉淀生成和转化与溶度积大小的关系;(7)能进行电离平衡常数、水的离子积、溶液pH、溶度积的简单计算。
三、知识整合
1.盐类水解、粒子浓度的大小及三大守恒定律
该考点主要考查盐类水解反应的原理、影响盐类水解程度的主要因素(稀释、加酸或碱或盐、温度等)、盐类水解原理的应用等,以考查上述内容或图像的分析、推理、论证、解释以及粒子浓度大小关系的推断、电荷守恒原理和物料守恒原理的应用等为主。
例1 下列关于溶液的说法正确的是()。
A.溶质的电离方程式为
B.25℃时,加水稀释后,的乘积变大
C.离子浓度关系:
D.温度升高,增大
解析:A项错误,NaHC03在水中电离方程式为少部分能电离为、。B项正确,温度不变,不变,但加水稀释后,溶液体积增大,与的乘积变大。C项错误,违反电荷守恒原理,由阳离子所带正电荷总数等于阴离子所带负电荷总数可知,。D项错误,HC03的水解和电离均为吸热反应,由化学平衡移动原理可知,升温促进HC03的水解和电离,减小。
答案:B
技巧点拨:不能孤立理解盐类水解,要与水的电离及溶液的pH相联系,水电离是弱电解质电离的一种,盐类水解是弱离子对水电离平衡的影响;理解电离常数在水解中的应用,电离常数越大,表明弱酸或弱碱的电离能力越强,其对应的阴、阳离子水解能力越弱;盐类水解是吸热反应,升温能促进盐水解。
2.酸碱中和滴定过程或曲线及其拓展
该考点主要考点酸碱中和滴定过程中溶液的酸碱性的变化、弱酸或弱碱的电离平衡、盐类水解、溶液的pH、电荷守恒原理等,以及酸碱中和滴定方法的拓展迁移(沉淀滴定、氧化还原反应滴定等),以考查上述内容或图像的分析、推理为主。
例2准确移取20.00 ml某待测HCI溶液于锥形瓶中,用溶液滴定,下列说法正确的是()。
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
解析:A项错误,装入标准溶液之前,滴定管必须用溶液润洗,防止洗涤后残留的蒸馏水稀释标准液,导致所用标准液的体积偏大,使待测液的测定结果偏大。B项正确,待测盐酸滴入标准烧碱溶液后,混合溶液的酸性减弱,碱性增强,因此pH由小到大。C项错误,由于无色的酚酞遇酸不变色,遇碱变红色,随着酸性减弱、碱性增强,锥形瓶中溶液由无色变红色,且半分钟内不褪色时,就达到了滴定终点。D项错误,其他变量不变时,滴定达终点时滴定管尖嘴部分有悬滴,使标准烧碱溶液的体积偏大,由计算式可知,测定结果偏大。
答案:B
技巧点拨:酸式滴定管不能盛放碱液、水解呈碱性的盐溶液、氢氟酸,因为它们能腐蚀磨口玻璃塞等。碱式滴定管不能盛放酸液、强氧化性溶液,因为它们会腐蚀橡胶管。无色滴定管不能盛放见光易分解的溶液,棕色滴定管才能盛放见光易分解的溶液。强酸滴定强碱时,可以用酚酞或甲基橙作指示剂;强碱滴定弱酸,最终生成的是强碱弱酸盐,滴定终点时溶液呈碱性,选择酚酞作指示剂;强酸滴定弱碱时,最终生成的是强酸弱碱盐,滴定终点时溶液呈酸性,则选甲基橙作指示剂。
3.难溶电解质的溶解平衡及溶度积的计算
该考点主要考查难溶电解质的溶解平衡、影响溶解平衡的因素、溶度积的含义及其表达式、沉淀生成或溶解或转化等,要求能进行相关溶度积的计算,以考查上述内容的计算或推理为主。
例3七铝十二钙()是新型的超导材料和发光材料,用白云石(主要含和MgC03)和废Al片制备七铝十二钙的工艺如下:
用适量的溶液浸取煅粉后,镁化合物几乎不溶,若滤液I中小于5X则溶液pH大于的。
解析:滤液I中存在的沉淀溶解平衡,则
答案:11
技巧点拨:溶液中离子浓度的变化只能使溶解平衡发生移动,但不会改变溶度积。相同类型的难溶电解质的 越小,溶解度越小,越难溶。两溶液混合是否会产生沉淀或同一溶液中可能会产生多种沉淀时,判断产生沉淀先后顺序问题,均可利用溶度积的计算公式或离子积与溶度积的关系加以判断。复分解反应总是向着某些离子浓度减小的方向进行,若生成难溶电解质,则向着生成溶度积较小的难溶电解质的方向进行。
——以“NaOH标准溶液的标定”微课教学为例

