把脉溶液离子平衡明晰电离平衡考向
刘树载

电解质溶液是高中化学重要的基础理论之一,从近几年的高考试题可以看出,涉及电解质的考点多、重现率高。解决此类题目,要求我们熟练掌握元素化合物的基本知识和平衡、守恒等化学基本原理,并善于发现和总结规律,构建出一套“有自身特色”的化学解题体系。
一、弱电解质的电离
弱电解质在水溶液中是少部分发生电离的。例如25℃(0.1mol?偶bL-1的CH3COOH溶液中,只有1.32%CH3COOH发生电离,即溶液中存在较大量的H2O和CH3COOH分子。弱电解质存在电离平衡,条件改变时,需要利用平衡移动原理对电离平衡的变化加以分析;多元弱酸(如H2C03)还要考虑分步电离。
例1下表是几种弱电解质的电离平衡常数(25℃)。
回答下列问题:
(l)写出C6H5OH与Na3PO4反应的离子方程式:____________ 。
(2)25℃时,向10 ml 0.01 mol.I-1C6H5OH溶液中滴加V ml O.Ol mol*L-1氨水,混合溶液中粒子浓度关系正确的是_____(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H20)+2c (NH4)=c(C6H5O)+(C6H5OH)
c.V=10时,混合液中水的电离程度小于O.Ol mol.LC-1C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH) >c(C6H5O)>c(H+c>(OH-)
解析:(1)根据表中电离常数可知C6H5OH的酸性比HP02-的酸性强,但比H2P4的酸性弱,故C6H5OH与Na3PO4反应生成Na2HPO4和C6H5ONa。
(2)由表中数据可知,NH3.H2o的电离常数大于C6H5OH的电离常数,故V<10时,混合液也可能呈碱性,a项错误。当V=5时,由物料守恒可知2[c(NH3.H20)-_-c( NH+)]=C(C6H5OH)+c(C6H5O-),b项正确。当V =10时,相当于生成了C6H5OH4,该物质水解,促进水的电离,而C6H5OH电离出H+,抑制水的电离,故V=10时,混合液中水的电离程度大于0. 01 mol.l-1C6H5OH溶液中水的电离程度,c项错误。由溶液中的电荷守恒可知c(NH4)+c(H+)=c(OH-)+c (C6H5O-),因混合液pH<7,(c(H+)>c(OH-),故c(NH4-)
答案:B
点拔:盐的水解包括的内容很多,如盐溶液中离子浓度的变化、水的离子积的变化、电离平衡常数、水解平衡常数、溶液pH的判断、水解离子方程式的书写、加入其他试剂对水解平衡的影响、稀释规律等。解这类题目要抓住水解也是可逆反应,可应用勒夏特列原理来解答。
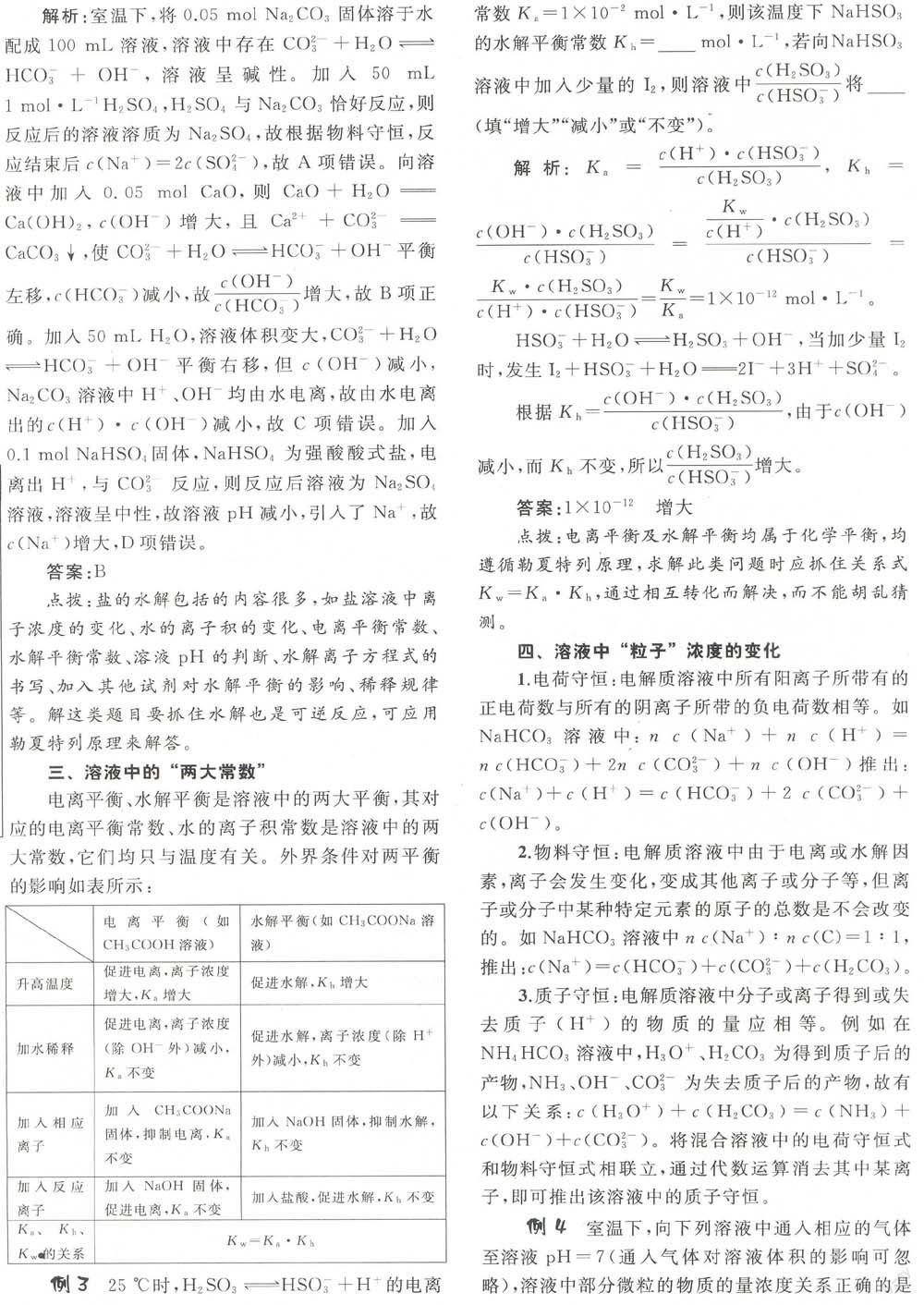
三、溶液中的“两大常数”
电离平衡、水解平衡是溶液中的两大平衡,其对应的电离平衡常数、水的离子积常数是溶液中的两大常数,它们均只与温度有关。外界条件对两平衡的影响如表所示:
例3 25℃时,H2SO3=HSO-3+H+的电离常数Ka=1×10-2mol.L-1,则该温度下NaHSO3的水解平衡常数K。一
mol.I。_1,若向NaHS03溶液中加入少量的I2则溶液中将_______(填“增大”“减小”或“不变”)。
解析:,当加少量I2时,发生。
根据,由于c(OH-)减小,而Kb不变,所以 增大。
答案:1×10-12增大
点拔:电离平衡及水解平衡均属于化学平衡,均遵循勒夏特列原理,求解此类问题时应抓住关系式Kw=Ka.Kh,通过相互转化而解决,而不能胡乱猜测。
四、溶液中“粒子”浓度的变化
1.电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:nc(Na+)+nc(H+)=nc(HC03 )+2n c(CO2-3)+nc(OH-)推出:c(Na+)+c(H+)=c(HCO-3)+2c(CO2-3)+c(OH-)。
2.物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化,变成其他离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHC03溶液中nc(Na+):nc(C)=l:l,推出:c(Na+)=c(HCO-3)+c(CO2-3)+f(H2CO3)。
3.质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HC03溶液中,H30+、H2C03为得到质子后的产物,NH3、OH-、CO2-3为失去质子后的产物,故有以下关系:c (H30+) +c (H2C03)=c(NH3)+c(OH-)+c( CO2-3)。将混合溶液中的电荷守恒式和物料守恒式相联立,通过代数运算消去其中某离子,即可推出该溶液中的质子守恒。
例4室温下,向下列溶液中通入相应的气体至溶液pH =7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是()。
A.向0.10 mol.L-1NH4HCO3。溶液中通入CO2:c(NH+)=c(Hco3)+c(CO2-3)
B.向溶液中通入
C.溶液通入
D.溶液中通入
解析:A项,两者不反应,根据溶液呈现电中性,,故错误。B项,和反应,生成亚硫酸钠和业硫酸铵,水解的程度是微弱的,,故错误。C项反应后溶液的溶质为,根据物料守恒,故错误。D溶液pH=7.反应后的溶质为,电离和水解相等,即:,故正确。
答案:D
点拨:本题涉及离子浓度大小比较,用到的规律有电荷守恒、质子守恒、物料守恒、水解程度和弱电解质电离程度微弱,还要分析反应后溶液中溶质有哪些物质,分析是电离为主还是水解为主,根据题目所给信息进行综合判断。
五、化学反应过程中“粒子”浓度关系判断
1.综合分析电离、水解等因素。如在溶液和的氨水混合溶液中,各离子浓度大小的顺序为
2.抓住反应“量”的对应点。①抓反应“一半”点,判断是什么溶质的等量混合。②抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。③抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。④抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。如对于酸碱中和型离子浓度的大小比较可采用如下处理:
例5 40℃时,在氨一水体系中不断通入,各种离子的变化趋势如下图所示。下列说法不正确的是()。
A.在pH=9.0时,
B.不同pH的溶液中存在关系
c.随着 的通人,不断增大
D.在溶液pH不断降低的过程中,有含的中间产物生成
解析:在pH=9.0时,作直线垂直于横坐标,从图中可直接看出:,A项正确。根据电荷守恒可得B项正确。不变,不断增大,则比值小断减小,C项不正确。从图像上看,pH降低过程中,有含NH2COO的中间产物生成,D项正确。
答案:C
点拔:对于条件的改变而引起的溶液中离子浓度的变化,需在平衡移动的基础上进行判断,有时需结合平衡常数、守恒规律等。等式关系一般采用守恒规律来解答,若等式中只存在离子,一般要考虑电荷守恒;等式中若离子、分子均存在,一般考虑物料守恒或质子守恒;离子浓度的比较要考虑溶液的酸碱性、水解、电离程度的相对强弱的关系。
六、难溶电解质的溶解平衡
物质在水中的溶解作用是一个较复杂的物理化学过程,各种不同的物质在水中的溶解度不同,有些表面上看来不溶的物质实际上也不是绝对不溶,绝对不溶的物质是没有的。难溶电解质在水中会建立沉淀溶解平衡,是一种动态平衡,如。用溶度积知识来计算溶液中相关离子的浓度,分析沉淀的溶解、生成,以及沉淀的转化。
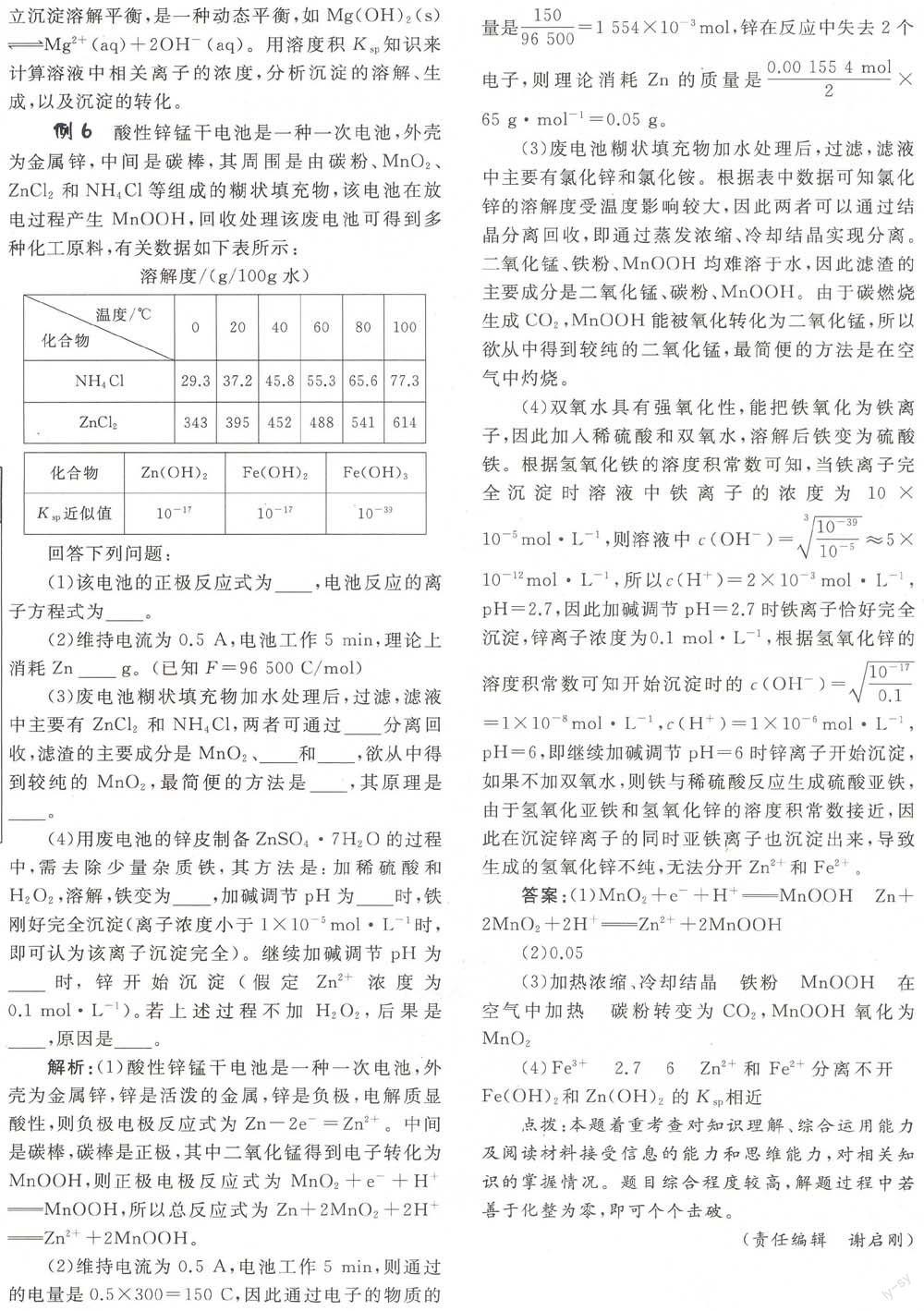
例6酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、和等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据如下表所示:
回答下列问题:
(1)该电池的正极反应式为_________,电池反应的离子方程式为________。
(2)维持电流为0.5 A,电池工作5 min,理论上消耗Zn________g。(已知F=96 500 C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4 Cl,两者可通过________分离回收,滤渣的主要成分是Mri02、________和________,欲从中得到较纯的Mn102,最简便的方法是________,其原理是________。
(4)用废电池的锌皮制备ZnS04.7H20的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2 02,溶解,铁变为________,加碱调节pH为________时,铁刚好完全沉淀(离子浓度小于1×10-smol.I.1时,即可认为该离子沉淀完全)。继续加碱调节pH为________时,锌开始沉淀(假定2n2+浓度为)。若上述过程不加H202,后果是________,原因是________。
解析:(1)酸性锌锰干电池是一种一次电池,外壳为金属锌,锌是活泼的金属,锌是负极,电解质显酸性,则负极电极反应式为。中间是碳棒,碳棒是正极,其中二氧化锰得到电子转化为MnOOH,则正极电极反应式为,所以总反应式为。
(2)维持电流为0.5 A,电池工作5 min,则通过的电量是0.5×300=150 C,因此通过电子的物质的量是,锌在反应中失去2个电子,则理论消耗Zn的质量是。
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵。根据表中数据可知氯化锌的溶解度受温度影响较大,因此两者可以通过结晶分离回收,即通过蒸发浓缩、冷却结晶实现分离。二氧化锰、铁粉、MnOOH均难溶于水,因此滤渣的主要成分是二氧化锰、碳粉、MnOOH。由于碳燃烧生成C02,MnOOH能被氧化转化为二氧化锰,所以欲从中得到较纯的二氧化锰,最简便的方法是在空气中灼烧。
(4)双氧水具有强氧化性,能把铁氧化为铁离子,因此加入稀硫酸和双氧水,溶解后铁变为硫酸铁。根据氢氧化铁的溶度积常数可知,当铁离子完全沉淀时溶液中铁离子的浓度为,则溶液中,所以,因此加碱调节pH=2.7时铁离子恰好完全沉淀,锌离子浓度为,根据氢氧化锌的溶度积常数可知开始沉淀时的,即继续加碱调节pH=6时锌离子开始沉淀,如果不加双氧水,则铁与稀硫酸反应生成硫酸亚铁,由于氢氧化亚铁和氢氧化锌的溶度积常数接近,因此在沉淀锌离子的同时亚铁离子也沉淀出来,导致生成的氢氧化锌不纯,无法分开和。
答案:(1)
(2)0.05
(3)加热浓缩、冷却结晶 铁粉 MnOOH 在空气中加热 碳粉转变为C02,MnOOH氧化为Mn02
(4) Fe3+ 2.7 6 Zn2+和Fe2+分离不开Fe(OH)2和Zn(OH)2的Km相近
点拨:本题着重考查对知识理解、综合运用能力及阅读材料接受信息的能力和思维能力,对相关知识的掌握情况。题目综合程度较高,解题过程中若善于化整为零,即可个个击破。

