O2在Ta-Fe共掺杂的Pd基核壳结构纳米线催化剂上的吸附和解离
万正阳,杨向宇
(河南师范大学物理与电子工程学院,河南 新乡 453007)
引言
低温燃料电池是能够直接通过电化学反应将氢气和氧气转化成水,从而产生电能的一种装置。这种装置因其独特的优势(能直接将化学能转化为电能)引起了人们极大的研究热情。这种燃料电池的阳极和阴极催化剂主要是贵金属铂,这使得低温燃料电池的成本非常高。此外,即使是最好的商业铂基阴极,因为高过电位和缓慢的氧还原动力学(阴极的氧气还原反应速率要比阳极的氢气氧化反应速率低几个数量级[1]),也会导致大约30%的能量损失[2]。因此对于燃料电池的普及应用,急需研发更便宜、更高效的电极催化剂。然而寻找贵金属铂的替代品是非常富于挑战性的,铂基双合金纳米催化剂可能成为很好的候选者。
一方面,纳米粒子拥有很大的比表面积[3-5],使催化剂能得到更充分的利用,从而减少贵金属的使用量。最近也有不少文章报道显示纳米颗粒优越的催化活性。Kaden[6]等人报道了 TiO2负载的由20个Pd原子组成的纳米颗粒拥有最大的氧化CO的活性;Vajda[7]等人发现由8~10个Pt原子组成的纳米颗粒对于丙烷的脱氢氧化拥有非常高的活性;Yoo[8]等人发现相比传统的Pt/C催化剂,由10~15个Pt原子组成的纳米团簇负载在石墨烯衬底上对于甲醇的氧化拥有更高的活性。这些发现清晰地表明使用小的纳米粒子作为新的催化剂对于各种化学反应的重要性和可行性。然而在反应条件下,纳米颗粒的稳定性随着尺寸的变化非常明显[9],当直径小于5nm时,其结构非常容易被破坏而失活。因此,反应导致的催化剂结构变形和失活需要得到系统而深入的研究。另一方面,双金属合金纳米颗粒由于两种组分的原子半径和表面能的不同,这些双金属合金纳米粒子[10-13]在实验室中能够形成非常好的核壳结构[14],并且核原子还可以作为“铆钉”去阻止反应中纳米粒子可能的形变。进一步来说,其电子结构也可以通过改变尺寸、形状、核以及壳原子的混合方式进行调制,从而实现与之紧密相关的催化活性的调控。但是,在实验上很难获得这些微观尺度上的信息,比如纳米粒子在反应中形貌的变化以及与吸附物之间的相互作用。然而大量相关的信息可以通过计算机模拟去获得。比如Wang[15]等人研究了132种合金的纳米颗粒,期望得到关于核壳结构排布信息的全面的理解;Kim[16]等人研究了CO分别在13Ag-Ih和X@Ag12(X=Pd,Pt,Au,Ni或Cu)核壳纳米粒子上的氧化,并发现了Pd@Ag12对CO氧化是很好的纳米催化剂。此外,综合理论和实验研究发现,相比纯Pt催化剂而言,以Ni,Cu,Au,V,Co,Fe 等为核,以 Pt为壳的纳米催化剂对氧气还原反应催化活性更高[14,17]。例如,Wang等[18]报道了其合成的Ni@Pt核壳纳米粒子催化剂相对于商业Pt催化剂对氧气还原反应具有更高的催化活性。为了进一步降低成本,人们也在开发无Pt催化剂,比如与Pt同一主族的Pd以及Pd基合金纳米催化剂。在金属表面或者团簇表面氧分子吸附和解离是很多反应过程的关键步骤,无论是水煤气反应、一氧化碳氧化,还是复杂的氧还原反应[19-23]。
结合上述实验和理论研究,在这个工作中,我们将研究氧分子在贱金属Ta-Fe共掺杂的Pd基核壳结构纳米线催化剂上的吸附和解离。
1 理论模型与计算方法
计算使用的是 VASP[24]软件包,3d金属 Fe的3d4s电子,4d金属 Pd的4d5s电子,5d金属 Ta的5d6s电子和O的2s2p被作为价电子来处理,而离子实通过投影缀加波(PAW)赝势[25]来表示。用平面波基矢展开Kohn-Sham轨道,选取400eV作为截断能的最大值。所采用的纳米线被放在18×18×9.66Å3的超原胞中,保证相邻的镜像纳米线之间至少有9Å的距离。采用1×1×2的Monkhorst-Pack网格[26]来进行布里渊区中的积分采样,积分采用Gaussian抹平方法[27],抹平参数 σ 设为0.2eV。采用广义梯度近似(GGA)下的PBE泛函[28]形式来描述电子间的交换关联相互作用,且所有的计算考虑自旋极化效应。关于电子的自洽迭代和离子弛豫的收敛性判别标准,从能量角度来看要小于10-5eV,从受力的标准来看不大于0.01eV/A。所计算的体系任何一个原子都不受限制,允许其自由弛豫。自由氧分子的计算被放置于10×10×10Å3的超原胞中进行,其理论计算键长为1.23Å,与实验值1.21Å[29]接近。采用 Bader电荷分析方法[30]计算反应中原子所带电荷以及电荷转移量。O2解离以及O2和O原子扩散的过渡态和最小能量路径(MEP)用CI-NEB方法[31]来计算完成。计算中,近邻镜像结构之间的弹性常数选为5.0eV/Å。此外,通过频率分析确定所得结构是稳定结构(没有虚频)还是过渡态(有且只有一个虚频)。在后面完整能量路径中所示的图像是通过spline函数插值法[32]拟合得到的。一旦确定了最小能量路径,过渡态活化能(即能量势垒)便可用公式(1)来计算:式中,EbIS和EbTS分别表示初态(Initial State)和过渡态(Transition State)的能量。
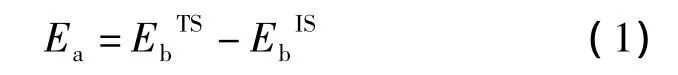
2 计算结果与讨论
首先构建了核壳结构Ta3Fe1@Pd20纳米线,如图1所示三个Ta以及1个Fe原子作为核心原子,20个Pd原子作为壳层原子。该核壳结构的内聚能Ecoh由公式(2)计算:
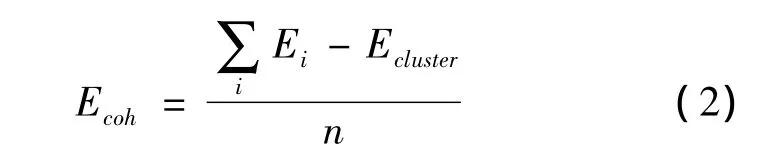
式中,Ecluster代表团簇的能量,Ei代表各个组成原子的能量,n代表总原子数。
通过计算发现,相比纯Pd24纳米线,Ta3Fe1@Pd20更加稳定,其 Ecoh比 Pd24的 Ecoh大 1.11eV。经过Bader电荷分析,发现Fe和Ta原子失去电子,而表面Pd原子得到电子。平均一个Fe原子失去0.44e,一个Ta原子失去2.22e,而一个Pd原子得到0.38e。因此表面Pd原子和核心Fe以及Ta原子存在强烈的静电吸引,从而增强其稳定性。
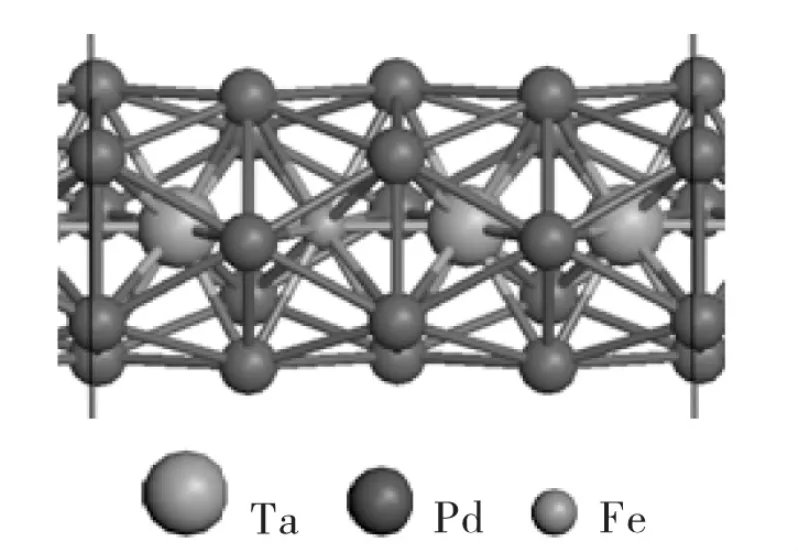
图1 核壳结构Ta3Fe1@Pd20纳米线
进一步计算O2在Ta3Fe1@Pd20核壳结构纳米线上的吸附与解离,测试了所有可能的氧分子的吸附位,最终优化的最稳定的O2的吸附结构如图2所示。O2的吸附能由公式(3)计算:
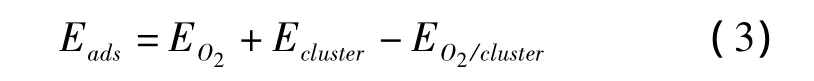
式中,EO2是气相氧分子的能量,EO2/cluster和Ecluster分别是团簇在有氧和没氧吸附的情况下的总能量。

图2 O2在核壳结构Ta3Fe1@Pd20纳米线最稳定的吸附位
计算所得O2的吸附能为0.96eV,说明O2的吸附是一个放热过程,在热力学上是稳定的。O2吸附在四个表面Pd原子组成的hollow位,每个O原子与两个Pd原子成键,O-Pd键长为2.21Å,从而使O2分子得到很强的活化,键长由最初的1.24Å拉伸为1.42Å。通过Bader电荷分析可知,O2分子得到了0.83e。O2分子的活化有助于O2分子的解离反应的发生。计算所得到的O2分子解离的过程如图3所示。
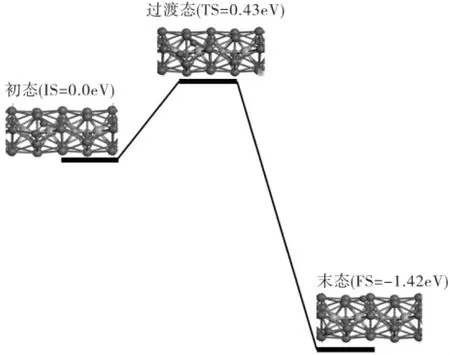
图3 O2在Ta3Fe1@Pd20纳米线的解离过程
由图3可知,在过渡态时O2的键长为1.93Å,经历一个0.43eV过渡态势垒就可以解离成两个O原子,这个反应过程放热1.42eV。这说明O2在核壳结构Ta3Fe1@Pd20纳米线上的解离在动力学和热力学上都很容易进行。
3 结论
采用基于密度泛函理论的第一性原理方法,研究了O2在碱金属Ta-Fe共掺杂的Pd基核壳结构纳米线(简写为Ta3Fe1@Pd20)上的吸附和解离。研究结果表明,O2的解离势垒只有0.43eV,很容易在Ta3Fe1@Pd20解离,这使得核壳结构纳米线有望在燃料电池电极催化剂的改良方面得到应用。
[1]Bockris J,Reddy A.Modern Electrochemistry[M].New York:Plenum Press,1973.
[2]Ralph T,Hogarth M.Catalysis for low temperature fuel cells[J].Platinum Metals Review,2002,46:117-135.
[3]Aprà E,Fortunelli A.Density-functional calculations on platinum nanoclusters:Pt13,Pt38 and Pt55[J].J Phys Chem A,2003,107:2934-2942.
[4]Roldán A,González S,Ricart J M,et al.Critical size for O2dissociation by Au nanoparticles[J].Chemphyschem,2009,10:348-351.
[5]Longo R,Gallego L.Structures of 13-atom clusters of fcc transition metals by ab initio and semiempirical calculations[J].Phys Rev B,2006,74:193409.
[6]Kaden W E,Wu T,Kunkel W A,et al.Electronic structure controls reactivity of size-selected Pd clusters adsorbed on TiO2surfaces[J].Science,2009,326:826-829.
[7]Vajda S,Pellin M J,Greeley J P,et al.Subnanometre platinum clusters as highly active and selective catalysts for the oxidative dehydrogenation of propane[J].Nature Mat,2009,8:213-216.
[8]Yoo E J,Okata T,Akita T,et al.Enhanced electrocatalytic activity of Pt subnanoclusters on graphene nanosheet surface[J].Nano Lett,2009,9:2255-2259.
[9]Sasaki K N,Cai Y,Choi Y M,et al.Core-protected platinum monolayer shell high-stability electrocatalysts for fuel-cell cathodes[J].Angew Chem Int Ed,2010,49.
[10]Calvo F,Cottancin E,Broyer M.Segregation,core alloying and shape transitions in bimetallic nanoclusters:Monte carlo simulations[J].Phys Rev B,2008,77:121406.
[11]Lu Q,Zhu L,Ma L,et al.Magnetic properties of Co/Cu and Co/Pt bimetallic clusters[J].Chem Phys Lett,2005,407:176-179.
[12]Paz-Borbón L O,Johnston R L,Barcaro G,et al.Structural motifs,mixing and segregation effects in 38-atom binary clusters[J].J Chem Phys,2008,128:134517.
[13]Paola C,Baletto F.Oxygen adsorption on small PtNi nanoalloys[J].Phys Chem Chem Phys,2011,13:7701.
[14]Li X,Liu J,He W,et al.Influence of the composition of core-shell Au-Pt nanoparticle electrocatalysts for the oxygen reduction reaction[J].J Colloid Interf Sci,2010,344:132-136.
[15]Wang L L,Johnson D D.Predicted trends of core-shell preferences for 132 late transition-metal binary-alloy nanoparticles[J].J Am Chem Soc,2009,131:14023-14029.
[16]Kim H Y,Kim D H,Ryu J H,et al.Design of robust and reactive nanoparticles with atomic precision:13Ag-Ih and 12Ag-1X(X=Pd,Pt,Au,Ni,or Cu)core-shell nanoparticles[J].J Phys Chem C,2009,113:15559-15564.
[17]Nilekar A U,Mavrikakis M.Improved oxygen reduction reactivity of platinum monolayers on transition metal surfaces[J].Surf Sci,2008,602:89-94.
[18]Wang G,Wu H,Wexler D,et al.Ni@Pt core-shell nanoparticles with enhanced catalytic activity for oxygen reduction reaction[J].J Alloy Compd,2010,503:1-4.
[19]Hinojosa J,Kan H H,Weaver J F.Molecular chemisorption of O2on a PdO(101)thin film on Pd(111)[J].J Phys Chem C,2008,112:8324-8331.
[20]Eichler A.CO oxidation on transition metal surfaces:reaction rates from first principles[J].Surf Sci,2002,498:314-320.
[21]Zhang C,Hu P.CO oxidation on Pd(100)and Pd(111):A comparative study of reaction pathways and reactivity at low and medium coverages[J].J Am Chem Soc,2001,123:1166-1172.
[22]Yu T,Odell J H,Jin M,et al.Structural dependence of oxygen reduction reaction on palladium nanocrystals[J].Chem Commun,2011,47:6566-6568.
[23]Yudanov I V,Neyman K M,Rösch N.C – O bond scission of methoxide on Pd nanoparticles:A density functional study[J].Phys Chem Chem Phys,2006,8:2396-2401.
[24]Kresse G.,Furthmüller J.Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set[J].Comp Mater Sci,1996(6):15-50.
[25]Kresse G,Joubert D.From ultrasoft pseudopotentials to the projector augmented-wave method[J].Phys Rev B,1999,59:1758.
[26]Monkhorst H J,Pack J D.Special points for Brillouinzone integrations[J].Phys Rev B,1976,13:5188-5192.
[27]Methfessel M,Paxton A.High-precision sampling for Brillouin-zone integration in metals[J].Phys Rev B,1989,40:3616.
[28]Perdew J P,Burke K,Ernzerhof M.Generalized gradient approximation made simple[J].Phys Rev Lett,1996,77:3865-3868.
[29]Huber K,Herzberg G.Molecular structure and molecular spectra IV:constants of diatomic molecules[M].New York:Van Rostrand-Reinhold,1979.
[30]Henkelman G,Arnaldsson A,Jónsson H.A fast and robust algorithm for Bader decomposition of charge density[J].Comput Mate Sci,2006,36:354-360.
[31]Henkelman G,Uberuaga B P,Jónsson H.A climbing image nudged elastic band method for finding saddle points and minimum energy paths[J].J Chem Phys,2000,113:9901.
[32]Henkelman G,Jónsson H.Improved tangent estimate in the nudged elastic band method for finding minimum energy paths and saddle points[J].J Chem Phys,2000,113:9978.

