支气管哮喘患者外周血Th17细胞及相关趋化因子表达水平检测①
徐文鑫,梅序桥
(1.漳州卫生职业学院基础医学部,福建 漳州 363000 E-mail:adanlover@163.com;2.福建医科大学附属漳州市医院检验科,福建 漳州 363000)
哮喘是由嗜酸粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、气道上皮细胞等多种细胞及其分泌细胞因子参与的气道炎症疾病[1]。众多学者研究表明在哮喘患者体内Th17细胞比率异常升高,以Th17细胞异常表达为标志的免疫激活和炎症反应在哮喘的发生、发展中起着重要作用[2],但Th17细胞及其分泌的炎症因子IL-17、IL-23以及相关趋化因子CCR4、CCR6以及趋化因子受体CCL20在哮喘过程中发挥的作用尚未见报道。
本研究拟通过检测支气管哮喘患者外周血Th17细胞上表达的相关趋化因子CCR4、CCR6表达水平以及炎症因子IL-17、IL-23的表达变化,进一步阐明Th17细胞及其作用因子在支气管哮喘发病机制中发挥的作用。
1 资料与方法
1.1 一般资料 选取2012年3月~2014年3月我院呼吸科门诊及住院部中处于急性发作的支气管哮喘患者30例为急性发作组,处于缓解期支气管哮喘患者30例为缓解组。入选标准:①明确诊断为支气管哮喘,诊断及严重和缓解症状判断标准严格按照我国2008年中华医学会呼吸病学分会哮喘学组制定的《支气管哮喘预防指南》进行;②所有患者除哮喘外的既往病史、体检及常规实验室检查均提示患者健康无其它合并症。排除标准:①发病前4周内因上呼吸道感染服用抗组胺类药物、免疫调节剂及解热镇痛药;②妊娠期或哺乳期妇女以及依从性差、流动人口等。两组患者的年龄、性别、基础疾病构成等方面比较差异均无统计学意义(P>0.05),具有可比性。另选年龄和性别相匹配的30例健康献血员为健康对照组。本研究方案经过医院伦理学委员会审查批准,所有受试对象均知情同意。
1.2 主要试剂与仪器 RPMI 1640和胎牛血清(美国Thermo公司);人淋巴细胞分离液 (天津市灏洋生物制品科技有限责任公司);破膜剂、CD3-FITC、CD4-PE、CD196(CCR6)-APC、CD194(CCR4)-APC鼠抗人单克隆流式抗体、离子霉素(Ion)、阻断剂莫能菌素(Mon)、刺激剂佛波酯(PMA)购自美国eBioscience公司、用于检测血清中总IgE、IL-17、IL-23、CCL20水平的ELISA试剂盒(美国eBioscience公司;酶标仪,美国Thermo labsystem公司;流式检测仪BD FACSVerseTMSystem,美国BD Biosciences公司。
1.3 方法
1.3.1 T淋巴细胞检测 采集两组支气管哮喘患者及健康对照者前臂外周抗凝血3ml,外周血单核细胞(PBMC,1×106/ml)由Ficoll淋巴细胞分离液提取,置于含10%胎牛血清的RPMI 1640培养基中,加入PMA、莫能霉素及离子霉素等工作液并混匀,37℃、5%CO2培养箱中培养4~6h。而后按T淋巴细胞流式抗体 CD3-FITC、CD4-PE、CD196(CCR6)-APC、CD194(CCR4)-APC流式抗体检测试剂盒说明书操作,加人各流式抗体4℃避光孵育30min,而后加入流式染色缓冲液洗涤3次,采用流式细胞仪上机检测Th17细胞(CD4+IL-17+)以及CCR4、CCR6的表达情况。
1.3.2 IgE、IL-17、IL-23、CCL20检测 取支气管哮喘患者及健康对照者前臂外周抗凝血3ml,以3 000r/min高速离心后,取血清使用酶联免疫吸附试验(ELISA)检测患者及健康对照者血清中总IgE、IL-17、IL-23、CCL20的表达水平,实验过程均按试剂说明书步骤进行,检测结果由Thermo labsystem酶标仪进行检测分析。
1.4 统计学方法 数据采用SPSS 19.0和GraphPad Prism 5软件进行统计分析,所有数据用(±s)表示。数据间先进行Shapiro-Wilk test正态性检验和Levene test方差齐性检验,若两者均符合,采用单因素方差分析(one-way ANOVA),并用LSD-t检验进行多样本均数间的两两比较。若有一项以上不符,则采用Kruskal-Wallis H检验和Dunn’s多重检验进行统计分析。以P<0.05为差异有统计学意义。
2 结果
2.1 CD4+IL-17+细胞表面趋化因子受体CCR4、CCR6的表达水平检测 对各组外周血进行流式细胞术检测结果显示:急性发作组外周血CD4+IL-17+Th17细胞、CD4+IL-17+CCR4+T细胞以及CD4+IL-17+CCR6+T细胞的百分率均显著高于缓解组(t=8.270,P=0.001;t=8.140,P=0.001;t=6.070,P=0.002,P均<0.01)。而缓解组外周血CD4+IL-17+Th17细胞、CD4+IL-17+CCR4+T细胞以及CD4+IL-17+CCR6+T细胞的百分率又明显高于健康对照组(t=7.379,P=0.001;t=8.435,P=0.001;t=8.070,P=0.001,P均<0.01),见表1。
表1 各组外周血Th17细胞上CCR4、CCR6的表达变化比较 (±s,pg/ml)

表1 各组外周血Th17细胞上CCR4、CCR6的表达变化比较 (±s,pg/ml)
注:与缓解组相比,a:P<0.001;与健康对照组相比,b:P<0.001
?
2.2 支气管哮喘患者血清中总IgE、IL-17、IL-23、CCL20的蛋白表达水平检测 对各组外周血进行流式细胞术检测结果显示:急性发作组血清中总IgE、IL-17、IL-23、CCL20的蛋白表达水平均显著高于健康对照组(t=6.598,P=0.001;t=7.226,P=0.001;t=6.986,P=0.001,P均<0.01)和缓解组(t=6.973,P=0.001;t=8.042,P=0.001;t=7.107,P=0.001,P均<0.01)。而缓解组血清中总IgE、IL-17、IL-23、CCL20的蛋白表达水平又明显高于健康对照组(t=9.468,P=0.001;t=6.997,P=0.001;t=7.645,P=0.001,P均<0.01),见表2。
表2 各组外周血血清中总IgE、IL-17、IL-23、CCL20的表达变化比较 (±s,pg/ml)
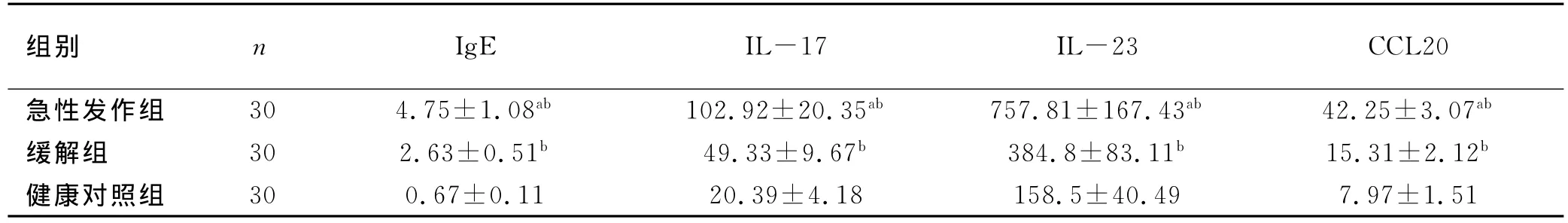
表2 各组外周血血清中总IgE、IL-17、IL-23、CCL20的表达变化比较 (±s,pg/ml)
注:与缓解组相比,a:P<0.05;与常规治疗组相比,b:P<0.05
组别 n IgE IL-17 IL-23 CCL20急性发作组 30 4.75±1.08ab 102.92±20.35ab 757.81±167.43ab 42.25±3.07ab缓解组 30 2.63±0.51b 49.33±9.67b 384.8±83.11b 15.31±2.12b健康对照组 30 0.67±0.11 20.39±4.18 158.5±40.49 7.97±1.51
3 讨论
哮喘是一种炎症性疾病,炎症细胞和炎症介质参与其过程[3]。主要表现为IgE介导的Ⅰ型变态反应,当机体再次接触过敏原时,IgE交联导致肥大细胞和嗜酸性粒细胞脱颗粒释放炎性介质引起气道的高反应性,导致支气管哮喘的发作[4]。研究发现IgE的增高与哮喘升高正相关[5]。Th17细胞是CD4+T淋巴细胞的新亚群,以分泌IL-17为特征,能广泛调节多种细胞的功能,在机体炎症反应过程中发挥促进作用[6],它分泌的IL-17、IL-23作用于多种细胞,诱导CCR4、CCR6、CCL20(CCR6的配体)等多种趋化因子产生,募集促炎因子到达炎症组织,通过与相应受体结合,引起局部炎症反应。
趋化因子是由不同类型的细胞分泌的低分子量(8-10KD)的细胞因子,CCR6和CCR4属于CC类趋化因子受体家族成员中的炎症性趋化因子[7]。炎症性趋化因子是在前炎症性细胞因子或病原因子的刺激下,由炎症部位的固有细胞和渗出的细胞所产生的,它们的主要任务是效应细胞(包括单核细胞、粒细胞和效应细胞)的募集。CCR4主要表达于多种淋巴细胞,其高亲和力配体为胸腺和活化调节的趋化因子(TARC/CCL17)及巨噬细胞衍生的趋化因子(CCL22/STCP-1),CCR4主要通过CCR4+TTh17细胞发挥免疫效应[8]。CCR6主要表达在B细胞、记忆性T细胞、树突状细胞、中性粒细胞上,优先表达于Th17上。已有研究发现CCR4、CCR6的表达与IL-17的产生呈现强相关,CCR4+CCR6+的记忆性CD4+T细胞亚群分泌炎症因子IL-17,并且该群细胞表达促进Th17细胞分化的特异性核转录因子RORγt[9]。有研究也发现产生IL-17的T细胞也表达CCR6和CCR4,因此CCR4、CCR6可以视为Th17细胞表面特异性标志物[10]。
本组研究结果发现,急性发作组外周血CD4+IL-17+Th17细胞、CD4+IL-17+CCR4+T细胞以及CD4+IL-17+CCR6+T细胞的百分率均显著高于健康对照组和缓解组。而缓解组外周血CD4+IL-17+Th17细胞、CD4+IL-17+CCR4+T细胞以及CD4+IL-17+CCR6+T细胞的百分率又明显高于健康对照组。提示外周血CD4+IL-17+Th17细胞、CD4+IL-17+CCR4+T细胞以及CD4+IL-17+CCR6+T细胞的比率可能与支气管哮喘疾病的活动性有关。我们的实验结果与研究报道产生IL-17的CD4+T细胞几乎都表达CCR6和CCR4相一致。
同时支气管哮喘患者血清总IgE、IL-17、IL-23、CCL20检测结果表明哮喘患者IgE水平升高可能是Th17细胞分泌的IL-17、IL-23以及CCR6、CCR4、CCL20等趋化因子共同作用的结果。因为近年来的研究表明,体内有十分复杂的调节网络,多种细胞及其产生的细胞因子都参与了IgE水平调控,细胞因子微环境失衡则可能是导致哮喘患者体内IgE增高的关键。Th17通过分泌IL-17作用于多种细胞,诱导相关趋化因子的产生,募集促炎因子到达炎症组织,通过与相应受体结合,引起局部炎症反应可能是哮喘发病的重要免疫学机制。
综上所述,支气管哮喘的发病机制与Th17细胞以及其分泌的细胞因子、趋化因子功能失调有密切关系。考虑可能此次入选样本量较小有关,故有待于增加样本量,进一步扩大研究予以证实Th17细胞以及其分泌的细胞因子、趋化因子是改善支气管哮喘患者预后的一个新的方向,我们推测针对趋化因子受体的靶向治疗可以作为治疗支气管哮喘的一个靶点。
[1] Bajoriuniene I,Malakauskas K,Lavinskiene S,et al.Th17response to Dermatophagoides pteronyssinus is related to late-phase airway and systemic inflammation in allergic asthma[J].International Immunopharmacology,2013,17(4):1020-1027.
[2] Manni ML,Robinson KM,Alcorn JF,et al.A tale of two cytokines:IL-17and IL-22in asthma and infection[J].Expert Review of Respiratory Medicine,2014,8(1):25-42.
[3] Viney JM,Andrew DP,Phillips RM,et al.Distinct conformations of the chemokine receptor CCR4with implications for its targeting in allergy[J].The Journal of Immunology:Official Journal of the American Association of Immunologists,2014,192(7):3419-3427.
[4] Kim HY,Lee HJ,ChangYJ,et al.Interleukin-17-producing innate lymphoid cells and the NLRP3inflammasome facilitate obesity-associated airway hyperreactivity[J].Nature Medicine,2014,20(1):54-61.
[5] Robinson KM,Manni ML,Biswas PS,et al.Clinical consequences of targeting IL-17and TH17in autoimmune and allergic disorders[J].Current Allergy and Asthma Reports,2013,13(6):587-595.
[6] Li G,Li GY,Wang ZZ,et al.The chemokine-like factor 1induces asthmatic pathological change by activating nuclear factor-κB signaling pathway[J].International Immunopharmacology,2014,20(1):81-88.
[7] Bonner K,Pease JE,Corrigan CJ,et al.CCL17/thymus and activation-regulated chemokine induces calcitonin gene-related peptide in human airway epithelial cells through CCR4[J].The Journal of Allergy and Clinical Immunology,2013,132(4):942-950.
[8] Afshar R,Strassner JP,Seung E,et al.Compartmentalized chemokine-dependent regulatory T-cell inhibition of allergic pulmonary inflammation[J].The Journal of Allergy and Clinical Immunology,2013,131(6):1644-1652.
[9] Herbert C,Shadie AM,Kumar RK,et al.Interleukin-17 signalling in a murine model of mild chronic asthma[J].International Archives of Allergy and immunology,2013,162(3):253-262.
[10] Newcomb DC,Peebles RS.Th17-mediated inflammation in asthma[J].Current Opinion in Immunology,2013,25(6):755-760.

