黄根醇提取物体外抗白色念珠菌生物膜作用的实验研究
谈潘莉徐 雯曹 毅
·论 著·
黄根醇提取物体外抗白色念珠菌生物膜作用的实验研究
谈潘莉1徐 雯2曹 毅1
目的 观察黄根醇提取物体外对白色念珠菌生物膜及相关基因的影响。方法 M27-A2测定黄根醇提取物对白色念珠菌的最小抑菌浓度(MIC);XTT法评价黄根醇提取物对白色念珠菌生物膜形成的影响;实时荧光定量RT-PCR(qRT-PCR)检测黄根醇提取物作用后,ALS基因的表达情况。结果 黄根醇提取物对白色念珠菌的MIC为8μg/mL;随着浓度的增加,黄根醇提取物对白色念珠菌生物膜的抑制作用增强,呈正相关性;16μg/mL黄根醇提取物对不同生长阶段的白色念珠菌生物膜均有抑制作用,抑制率随生物膜成熟逐渐降低;qRT-PCR结果显示,药物作用后ALS2、ALS3基因表达降低(7.87±0.27比5.15±0.34;6.24±0.51比2.13±0.23,P<0.05),ALS1基因表达无明显变化(6.11±0.14比5.95±0.31,P>0.05)。结论 黄根醇提取物对体外白色念珠菌生物膜有较明显的抑制作用,可能通过抑制ALS2、ALS3基因的表达而实现。
白色念珠菌;黄根醇提取物;RT-PCR
随着广谱抗生素、糖皮质激素和免疫抑制剂等的广泛应用,免疫受损人群不断增加,条件致病真菌中念珠菌的感染率日渐升高[1-2],其中白色念珠菌(candida albicans)是临床最常见的致病真菌,在机体免疫功能低下时,可引起黏膜和全身性的感染[3]。白色念珠菌对传统抗菌药物产生耐药性是治疗此类感染的难点。研究显示,真菌的耐药性与生物膜有着密切关联[4]。寻找抗真菌生物膜的药物是防治真菌病的关键。黄根为茜草科植物三角瓣花(prismatomeriste-trandra)的根,性微苦,味凉,具有软坚散结、凉血止血、祛瘀生新、强壮筋骨和利湿退黄等功效[5]。广西民间多用以治疗慢性肝炎,有文献报道用乙醇回流提取的黄根制剂还具有抗菌作用[6]。本研究就黄根醇提取物对白色念珠菌生物膜形成及相关基因表达的影响进行初步研究,以期为白色念珠菌生物膜的预防和治疗提供新的思路。
1 实验材料
1.1 菌 株 ATCC10231购自中国科学院微生物研究所。
1.2 药物及试剂 黄根醇提取物的制备:将黄根粉碎成粗粉,用乙醇加热回流提取两次,合并提取液,滤过,浓缩至无醇味,于4°C冰箱保存备用;XTT粉末:Sigma公司;维生素K3:Alexis公司;丙酮:蚌埠化学试剂厂;RPMI-1640培养基、YPD培养基依据文献配制[7]。
2 实验方法
2.1 最小抑菌浓度 黄根醇提取物对白色念珠菌最小抑菌浓度(minimal inhibitory concentrations,MIC)值测定采用国际上通用的微量稀释法,即美国临床实验室标准化研究所(CLSI)M27-A2[8]。
2.2 白色念珠菌生物膜制备 将白色念珠菌接种于YPD培养基中,35°C摇床过夜培养,收集菌体,用RPMI-1640培养基稀释,调整菌液浓度为1×106菌落形成单位/毫升(CFU/mL)。将100μL该浓度菌液接种于96孔细胞培养板中,37°C培养2h后弃去培养基,用pH7.4、0.01mol/L磷酸缓冲盐水(PBS)洗3次,加入100μL RPMI-1640培养基,作为培养的0点,37°C继续培养,每24h更换1次培养基。
2.3 不同浓度黄根醇提取物对白色念珠菌生物膜影响 在生物膜培养的0点,加入倍比稀释的黄根醇提取物溶液(终浓度分别为2~64μg/mL),空白对照孔加入培养基,37°C继续培养48h后,弃去培养基,PBS洗涤3次,用XTT减低法测定不同浓度黄根醇提取物对白色念珠菌生物膜的抑制作用:XTT用0.5g/L林格液稀释及0.22μm孔径的滤器过滤除菌,分装后存放于-70°C冰箱备用。临用前,加入维生素K3(menadione,用丙酮稀释至终浓度10mmol/L)。取XTT-menadione溶液100μL加到已形成生物膜的培养孔中(menadione在XTT中的终浓度为1μmol/L)。37°C避光孵育2h后,在酶标仪波长490nm处检测各孔光密度(optical density,OD)值,每组设3个复孔,实验重复3次。
2.4 黄根醇提取物对不同生长阶段白色念珠菌生物膜的影响 将100μL菌液接种于96孔细胞培养板中,分别在生物膜培养的0、4、8、12、24和48h时弃去培养基,加入黄根醇提取物,使其终浓度为16μg/ mL,空白对照组仅加入培养基,37°C继续培养24h。XTT法测量各孔在490nm处的OD值。每组设3个复孔,实验重复3次。
2.5 黄根醇提取物对白色念珠菌生物膜相关基因影响
2.5.1 样品制备 将白色念珠菌接种于YPD培养基中,35°C摇床过夜培养,收集菌体,用RPMI-1640培养基稀释,调整菌液浓度为1×106CFU/mL,将80mL菌液加入细胞培养皿中,37°C静置黏附90min,弃上清液,用灭菌PBS缓冲液洗3次,向细胞培养皿中加入黄根醇提取物,使得其终浓度为16μg/ mL,37°C继续静置培养1h,弃上清液,用灭菌PBS缓冲液洗3次,用生物被膜刮刀刮取细胞培养皿底部细胞,收集离心,用DEPC水洗1次,离心并弃上清备用。
2.5.2 RNA提取 取沉淀用Novelase消化液悬浮,室温消化10min后,参照Trizol试剂(Invitrogen)说明书介绍的步骤提取总RNA,紫外分光光度法测定其RNA浓度[9]。
2.5.3 实时荧光定量RT-PCR(qRT-PCR)引物 根据文献报道[10]的ALS1、ALS2、ALS3基因序列,采用Primer Premier 5.0软件设计检测白色念珠菌ALS1-mRNA、ALS2-mRNA、ALS3-mRNA和18S-RNA的qRT-PCR引物(表1),各引物由上海Invitrogen公司合成。

表1 qRT-PCR扩增引物序列
2.5.4 qRT-PCR定量分析 以1μg总RNA为模板,采用逆转录试剂盒(TaKaRa)、SYBR Premix Ex. TaqTM荧光定量PCR试剂盒(TaKaRa)、上述引物及ABI-7500型实时荧光定量PCR仪检测ALS1-mR-NA、ALS2-mRNA、ALS3-mRNA,反应参数:95℃30s;95℃5s、60℃30s,40个循环。每个基因测3个复管,每次实验重复3次。实验中以18S-RNA为内参照,采用ΔΔCt模型及REST2005软件对qRT-PCR数据进行定量分析[11]。
2.6 统计学方法 应用SPSS19.0软件进行统计分析,计量资料均用(±s)表示,采用t检验,方差分析,以P<0.05为差异有统计学意义。
3 实验结果
3.1 黄根醇提取物最小抑菌浓度 黄根醇提取物对白色念珠菌最小抑菌浓度(MIC)为8μg/mL。
3.2 不同浓度黄根醇提取物对白色念珠菌生物膜形成的影响 黄根醇提取物对白色念珠菌生物膜的形成具有抑制作用,呈浓度相关性,抑制率随着黄根醇提取物浓度增高而增高,各浓度组间差异有统计学意义(P<0.05),见表2。
表2 不同浓度黄根醇提取物对白色念珠菌生物膜形成的相对抑制率(±s,n=9)
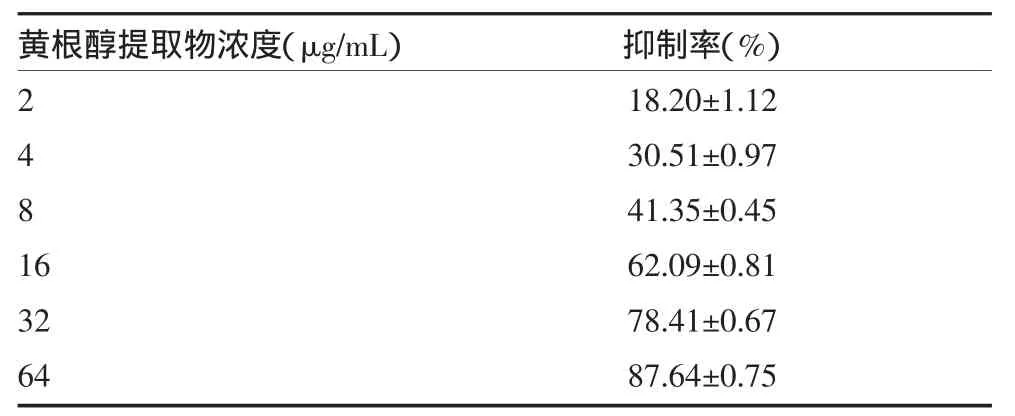
表2 不同浓度黄根醇提取物对白色念珠菌生物膜形成的相对抑制率(±s,n=9)
黄根醇提取物浓度(μg/mL)2481 6 32 64抑制率(%)18.20±1.12 30.51±0.97 41.35±0.45 62.09±0.81 78.41±0.67 87.64±0.75
3.3 黄根醇提取物对不同生长阶段白色念珠菌生物膜的影响 16μg/mL黄根醇提取物对不同生长阶段的白色念珠菌生物膜均有抑制作用,且呈时间相关性,抑制率随生物膜成熟逐渐降低,各生长阶段组间有显著性差异(P<0.05),见表3。
表3 黄根醇提取物对不同生长阶段白色念珠菌生物膜的影响(±s)
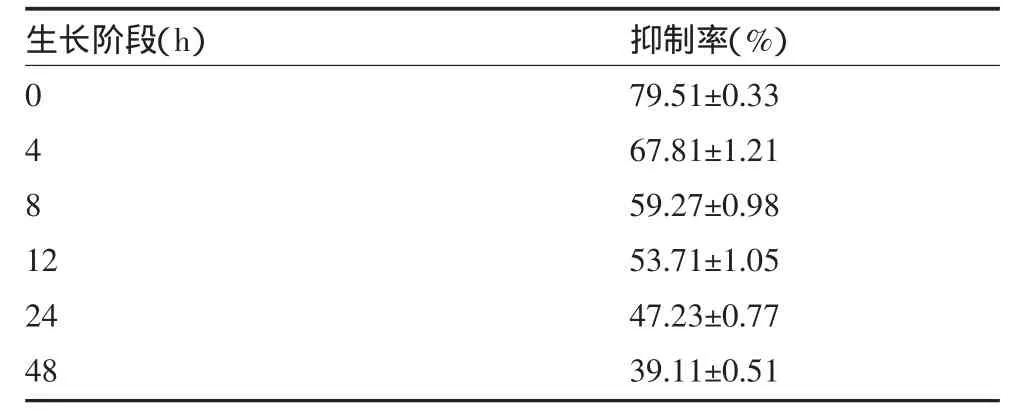
表3 黄根醇提取物对不同生长阶段白色念珠菌生物膜的影响(±s)
生长阶段(h)0481 2 24 48抑制率(%)79.51±0.33 67.81±1.21 59.27±0.98 53.71±1.05 47.23±0.77 39.11±0.51
3.4 黄根醇提取物对白色念珠菌生物膜相关基因影响 16μg/mL黄根醇提取物作用后,ALS2、ALS3基因表达水平明显低于药物作用前,差异有统计学意义(P<0.05)。ALS1基因表达水平无明显变化(P>0.05),见表4。
表4 16μg/mL黄根醇提取物作用前后ALS基因表达水平的变化(±s,n=9)

表4 16μg/mL黄根醇提取物作用前后ALS基因表达水平的变化(±s,n=9)
观察时间黄根醇提取物作用前黄根醇提取物作用后P mRNA水平ALS1 6.11±0.14 5.95±0.31>0.05 ALS2 7.87±0.27 5.15±0.34<0.05 ALS3 6.24±0.51 2.13±0.23<0.05
4 讨论
白色念珠菌(candida albicans)是人类最常见的条件致病菌,可导致深部感染危及生命。该菌容易在各种生物材料表面形成生物被膜。有文献报道,白色念珠菌形成生物被膜后对临床常用抗白色念珠菌药物如氟康唑、两性霉素B等的敏感性下降几十倍、几百倍[12-13]。生物膜内的念珠菌比浮游菌更加耐药、难治、所致感染易复发[14]。寻求抗生物膜的药物显得至关重要。
Chandra等[15]发现白色念珠菌生物膜的形成分为3个阶段:早期(0-11h),中期(12-30h)和成熟期(38-72h)。早期的黏附尤为重要,随着培养时间的延长,生物膜逐渐发育成熟,故抑制黏附是抗白色念珠菌生物膜感染的关键措施。本研究选取具有较强生物膜形成功能的白色念珠菌标准株ATCC10231为标准菌株[16],发现黄根醇提取物对白色念珠菌的早期黏附有明显的抑制作用,抑制率与浓度呈正相关,当黄根醇提取物浓度达到16μg/mL时,抑制率明显提高,故选取16μg/mL黄根醇提取物作用于不同时期(0~48h)白色念珠菌生物膜,发现其对不同生长阶段的白色念珠菌生物膜均有抑制作用,提示黄根醇提取物对白色念珠菌生物膜的发育有明显的干预作用。由此推测其抑制白色念珠菌生物膜的作用可能与其抑制细胞黏附过程相关。
为从分子机制角度进一步阐述黄根醇提取物对白色念珠菌黏附抑制作用,我们检测了ALS基因家族中具有代表性的黏附相关基因 ALS1、ALS2、ALS3。ALS基因是编码白色念珠菌细胞壁表明大分子糖蛋白的一组基因,ALS基因家族至少包含8个基因(ALS1-7,ALS9),其表达产物Alsp属锚定蛋白,在生物膜形成的初期即黏附阶段发挥重要作用[17],与白色念珠菌细胞和宿主之间的黏附有密切关系。有研究表明,ALS基因家族的表达产物大多参与了生物膜形成。O’Connor等[18]在医用硅胶上构建白色念珠菌生物膜,用实时定量RT-PCR方法检测到ALS1表达上调;Zhao等[19]研究认为,ALS2在白色念珠菌从酵母相向菌丝相转换中可能发挥一定作用。在体外条件下,ALS3缺失菌株对人类重组细胞的黏附能力几乎完全丧失,不能形成结构完整的被膜[20]。本研究qRT-PCR实验结果显示,黄根醇提取物作用后,ALS2、ALS3表达下调,ALS1则未见明显变化。Nailis等[21]利用CDC生物膜反应器构建了连续流动条件下的生物膜,经RT-PCR检测发现,ALS1在生物膜形成早期(0.5、1、6h)的表达无明显变化,后期(72、96h)则表达下调。本实验中黄根醇提取物与白色念珠菌生物膜的作用时间为1h,即属于早期黏附阶段,故ALS1表达无明显变化,与文献报道相符。结合本实验结果,我们推测ALS2、ALS3是黄根醇提取物的主要作用基因,从而导致对黏附作用的抑制。
[1]Perlroth J,Choi B,Spellberg B.Nosocomial fungal infections:epidemiology,diagnosis,and treatment[J].Med Mycol,2007,45(4):321-346.
[2]Wilson D,Thewes S,Zakikhany K,et al.Identifying infection-associated genes of Candida albicans in the postgenomic era[J].FEMS Yeast Res,2009,9(5):688-700.
[3]Seneviratne CJ,Wang Y,Jin L,et al.Candida albicans biofilm formation is associated with increased anti-oxidative capacities[J].Proteomics,2008,8(14):2936-2947.
[4]Donlan RM,Costerton JW.Biofilms:survival mechanisms of clinically relevant microorganisms[J].ClinMicrobiol Rev,2002,15(2):167-193.
[5]广西壮族自治区卫生局.广西本草选编(下册)[M].南宁:广西人民出版社,1974:1790-1791.
[6]Rukayadi Y,Han S,Yong D,et al.In vitro activity of xanthorrhizol against Candida glabrata,C.guilliermondii,and C. parapsilosis biofilms[J].Med Mycol,2011,49(1):1-9.
[7]Ramage G,Walle KV,Wickes BL,et al.Standardized Method for In Vitro Antifungal Susceptibility Testing of Candida albicans Biofilms[J].Antimicrob Agents Chemother,2001,45(9):2475-2479.
[8]Mayer I,Layani JD,Givan A,et al.Laions in precipitated hydroxyapatites[J].J InorgBiochem,1999,73(4):221-226.
[9]Sambrook J,Fritsch EF,Maniatis T.Molecular cloning,a latoratory manual[M].2ed,New York:Cold Spring Harbor Laboratory Press,1989:1.21-1.52,2.60-2.80,7.30-7.35,9.14-9.22.
[1 0]Green CB,Chenq G,Chandra J,et al.RT-PCR detection of Candida albicans ALS gene expression in the reconstituted human epithelium(RHE)model of oral candidiasis and in model biofilms[J].Microbiology,2004,150(2):267-275.
[1 1]Pfaffl MW,Horgan GW,Dempfle L.Relative expression software tool(REST)for group-wise comparison and statistical analysis of relative expression results in real-time PCR[J].Nucleic Acids Res,2002,30(9):e36-45.
[1 2]Tobudic S,Lassnigg A,Kratzer C,et al.Antifungal activity of amphotericin B,caspofungin and posaconazole on Candida albicans biofilms in intermediate and mature development phases[J].Mycoses,2010,53(3):208-214.
[1 3]Ramage G,Jose A,Coco B,et al.Commercial mouthwashes are more effective than azole antifungals against Candidaalbicans biofilms in vitro[J].Oral Surg Oral Med Oral Pathol Oral RadiolEndod,2011,111(4):456-460.
[1 4]Ramage G,Vandewalle K,Wickes BL,et al.Characteristicsof biofilm formation by Candida albicans[J].Rev Iberoam-Micol,2001,18(4):163-170.
[1 5]Chandra J,Kuhn DM,Mukherjee PK,et al.Biofilm formation by the fungal pathogen Candida albicans:development,architecture,and drug resistance[J].J Bacteriol,2001,183(18):5385-5394.
[1 6]He M,Du M,Fan M,et al.In vitro activity of eugenol against Candida albicansbiofilms[J].Mycopathologia,2007,163(3):137-143.
[1 7]Hoyer LL,Green CB,Oh SH,et al.Discovering the secrets of the Candida albicans agglutinin-like sequence(ALS)gene family-a sticky pursuit[J].Med Mycol,2008,46(1):1-15.
[1 8]O’Connor L,Lahiff S,Casey F,et al.Quantification of ALS1 gene expression in Candida albicans biofilms by RT-PCR using hybridisation probes on the LightCycler[J].Mol Cell Probes,2005,19(3):153-162.
[1 9]Zhao X,Oh SH,Yeater KM,et al.Analysis of the CandidaalbicansAls2p and Als4padhesionssuggests the potential for compensatoryfunctionwithintheAlsfamily[J].Microbiology,2005,151(5):1619-1630.
[2 0]Zhao X,Daniels KJ,Oh SH,et al.Candida albicans Als3p is required for wild-type biofilm formation on silicone elastomer surfaces[J].Microbiology,2006,152(8):2287-2299.
[2 1]Nailis H,Vandenbroucke R,Tilleman K,et al.Monitoring ALS1 and ALS3 gene expression during in vitro Candida albicans biofilm formation under continuous flow conditions[J].Mycopathologia,2009,167(1):9-17.
(收稿:2014-10-30 修回:2014-11-05)
Alcohol Extract from Prismatomeris Tetrandra against Candida Albicans Biofilms in Vitro
TAN Panli1,XUWen2,CAO Yi1. 1 The First Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou(310006),China;2 Xiaohe Hushu Community Health Service Center of Gongshu District,Hangzhou(310011),China
Objective To study the effect of alcohol extract from Prismatomeris tetrandra on candida albicans(C. albicans)biofilms and the expression of related genes in vitro.Methods M27-A2 was used to determine the minimum inhibitory concentration(MIC)of alcohol extract from Prismatomeris tetrandra against C.albicans.XTT assay was performed to determine the effects of alcohol extract from Prismatomeris tetrandraon C.albicans biofilm formation.The real-time fluorescent quantitative RT-PCR(qRT-PCR)was used to determine the difference of ALS gene expression between before and after alcohol extract from Prismatomeris tetrandra induction group.Results MIC of alcohol extract from Prismatomeris tetrandra against C.albicans was 8μg/mL.With increasing concentration,the inhibitory effect of alcohol extract from Prismatomeris tetrandra on C.albicans biofilms enhanced.Alcohol extract from Prismatomeris tetrandra at concentration of 16μg/mL showed distinct inhibitive effect on adhesion to C.albicans cultured for 4h,8h,12h,24h and 48h,and the effect weakened as the time of culture increased.qRT-PCR results showed that alcohol extract from Prismatomeris tetrandra resulted in a striking down-regulation of ALS2 and ALS3(ALS2:7.87±0.27 vs 5.15±0.34;ALS:6.24±0.51 vs 2.13±0.23;all P<0.05),while the expression of ALS1 showed no changes(6.11±0.14 vs 5.95±0.31,P>0.05).Conclusion Alcohol extract from Prismatomeris tetrandra has potent activity against C.albicans biofilms in vitro.The inhibition of alcohol extract from Prismatomeris tetrandra on biofilms formation may depend on suppressing the expression of ALS2 and ALS3.
Candida albicans;alcohol extract from Prismatomeris tetrandra;RT-PCR
国家自然科学基金(No.81173271)
1浙江中医药大学附属第一医院检验科(谈潘莉)、皮肤科(曹毅)(杭州 310006);2杭州市拱墅区小河湖墅街道社区卫生服务中心(杭州 310011)
曹毅,Tel:13588887388;E-mail:caoyi1965@163.com

