慢性神经根型颈椎病动物模型的建立
金哲峰,徐凡平,朱立国,于 杰,王 平,毕方杉
(1.天津中医药大学第一附属医院,天津 300193;2.北京中医医院,北京 100010;3.中国中医科学院望京医院,北京 100102;4.北京市丰盛中医骨伤专科医院,北京 100033)
慢性神经根型颈椎病动物模型的建立
金哲峰1,徐凡平2,朱立国3,于 杰3,王 平1,毕方杉4
(1.天津中医药大学第一附属医院,天津 300193;2.北京中医医院,北京 100010;3.中国中医科学院望京医院,北京 100102;4.北京市丰盛中医骨伤专科医院,北京 100033)
[目的]通过模拟慢性颈椎间盘退变及关节突关节双重退变,建立慢性神经根型颈椎病的动物模型。[方法]将48只SD大鼠分层随机分为两组:模型组、假手术组。观察大鼠行为学变化,并分别于术前1 d、术后29 d拍颈椎X线片侧位片,观察椎间盘退变的情况;术前1 h、术后29 d后分别测定右侧臂丛神经的感觉神经传导速度和运动神经传导速度;记录神经电生理变化。[结果]该模型可以出现明显椎间盘变化及神经功能传导损伤的变化。[结论]模拟慢性颈椎间盘退变及关节突关节双重退变的动物模型可以对神经根型颈椎病(慢性期)加以反映。
神经根型颈椎病;慢性期;动物模型
神经根型颈椎病(CSR)是一种临床常见的疾病,是由于颈椎间盘和周围结构逐渐发生退行性变、骨质增生、或颈椎生理曲线改变后刺激或压迫颈神经引起的一组综合症状[1]。
1 实验材料
1.1 实验动物 8月龄健康SPF级雌雄(SD)大鼠共48只,雌鼠体质量220~255 g,雄鼠体质量450~600 g,由成都达硕实验动物中心提供,(合格证号:SCXK(川)2008-24),在成都中医药大学动物中心SPF级动物实验室内饲养。
1.2 实验药物 Ⅱ型胶原蛋白酶(285 U/mg),Worthington BiochemicalCorporation,Lakewood,NJ,USA,批号48M10791;青霉素钠注射液,批号100408,80万U/支,福建汇天生物药业有限公司提供;复合脱钙液;中国中医科学院望京医院骨研所药理实验室提供。
1.3 主要试剂 兔抗鼠MMP-3(一抗),批号BA1531;兔抗鼠 TIMP-1(一抗),批号 BA0575;兔抗鼠 IL-17(一抗),批号 BA2416;兔抗鼠 IL-1β(一抗),批号BA2782;以上均由武汉博士德公司提供;兔抗鼠IL-20(一抗),批号bs-1834R由北京博奥森生物技术有限公司提供;戊巴比妥钠,批号F20100312由上海国药集团化学试剂有限公司提供;甲醛溶液,批号100511由淮南市伟企豪业化工有限公司提供;SP9001生物素标记山羊抗兔IgG免疫组化染色试剂盒,天津灏洋生物提供;试剂A:封闭用正常山羊血清工作液;试剂B:生物素化二抗工作液;试剂C:辣根酶标记链霉卵白素工作液(S-A/HRP);试剂D:3%H2O2去离子水;PBS磷酸盐缓冲液(0.01mol/LPBS,pH 7.4)。
1.4 主要仪器设备 BL-420E生物机能实验系统,成都泰盟科技科技有限公司;34号钝圆针头,World Precision Instruments;数字化X射线摄影系统GE Definium 6000型DR美国GE公司;微量注射泵TJ-1A/L0107-1A,保定兰格恒流泵有限公司;眼镜架式手术放大镜4X-370mm,北京中西远大科技有限公司;石蜡切片机:QPJ-1C生物光学及摄影显微镜:OLYMPUSDP71、BX51;高温烘烤箱:D-63450型,德国Heraens;电热恒温鼓风干燥箱,黄石市恒丰医疗器械有限公司;隔水式恒温培养箱:GHP-9080;上海一恒科技有限公司;生物组织包埋机:BMJ-1,天津航空机电公司。
2 实验方法
2.1 实验动物分组 将48只8月龄健康SPF级雌雄(SD)大鼠采用分层随机法分为假手术组(对照组),24只,手术组(实验组),24只,雌雄各半。5只大鼠同养于一个大鼠盒中,雌雄分养,饲养室温度为20~26℃,为了保持大鼠的生物节律,实验室每日早晨 8∶00 至 20∶00 开灯,20∶00 至次日 8∶00 熄灯,实验前5 d每日将大鼠置于实验观察箱中30min,使之适应环境的改变。
2.2 大鼠神经根型颈椎病模型的建立 在无菌手术室,大鼠腹腔麻醉(戊巴比妥钠35mg/kg),麻醉生效后,俯卧位固定于大鼠板上,电动剃毛器剃毛,备皮范围5 cm×4 cm。常规络合碘消毒术区,铺无菌手术巾,取颈部正中切口约4 cm,依次切开皮肤、皮下组织、脊柱旁肌肉,显露两侧的关节突关节,造模组将配制好的胶原蛋白酶(10U/μL)缓慢注入C5/6,C6/7关节突关节(每个关节注入5μL,用34号钝圆针头),用输液泵以4μL/min的速度注入。然后再切断颈背部深肌群颈夹肌和头、颈、寰最长肌,完全切除颈骼肋肌与头半棘肌,然后再依次切断C2~C7棘上和棘间韧带,生理盐水冲洗,止血,缝合筋膜及皮肤。
2.3 假手术对照组 在无菌手术室,大鼠腹腔注射戊巴比妥钠(35mg/kg)麻醉成功后,术区剃毛、大鼠板固定、常规碘伏消毒,取颈部正中切口约4 cm,依次切开皮肤、皮下组织,直达棘突,冲洗,止血,逐层缝合。术后常规青霉素抗菌治疗3 d。
3 观察指标
3.1 行为学观察 动物有无烦躁、食欲降低、用嘴反复添前爪、倦怠、易激惹、活动频繁等。
3.2 颈椎X线拍片 颈椎X线摄侧位片,观察椎间盘退变的情况(生理弧度改变,椎间隙变窄,椎体前后缘骨质增生)。大鼠腹腔注射戊巴比妥钠(35mg/kg)麻醉成功后,分别于术前1 d、术后29 d拍颈椎X线侧位片。麻醉生效后,将大鼠置于自制的侧位固定鼠板上,保证大鼠体位在前后拍片过程中位置固定不变。前后两次拍片拍摄条件一样。
4 电生理的测定
大鼠腹腔注射戊巴比妥钠(35mg/kg)麻醉成功后,术前1 h、术后29 d后分别测定右侧臂丛神经的感觉神经传导速度和运动神经传导速度,每次测试重复2遍。
4.1 感觉神经传导速度(SCV)测定 刺激电极置于大鼠右侧腕部正中神经走行处,以针状电极刺于皮下进行刺激,2个刺激点(A点、B点)距离为1 cm,针状记录电极置于锁骨上窝Erb’s点,参考电极置于记录电极(C点)右侧2 cm处,右下肢接地。刺激参数为方波脉冲电流,波宽0.1ms,频率1.9Hz,强度3mA,刺激延时100ms。信号记录系统的前置放大器灵敏度20ms/div,滤波带10~10 kHz,记录时间200ms。潜伏期由计算机自动测量(T1、T2),两个刺激点之间的距离输入计算机,根据公式算出SCV(m/s)。

4.2 运动神经传导速度(MCV)测定 经皮电刺激,第一点刺激(A点)(阳极)在C6棘突处,第二点刺激(B点)(阴极)在锁骨上窝Erb’s点,右下肢接地,记录电极鬁放置于桡侧腕屈肌,记录复合肌肉动作电位(CMAP)。刺激参数为方波脉冲电流,波宽0.1ms,频率1.9Hz,强度3mA,刺激延时100ms。信号记录系统的前置放大器灵敏度20ms/div,滤波带10Hz~10 kHz,记录时间200ms。潜伏期由计算机自动测量(T1、T2),两个刺激点之间的距离输入计算机,根据公式算出 MCV(m/s)。

5 统计方法
所得数据用SPSS 19.0统计软件处理。计量资料用均数±标准差(±s)表示,组内比较采用配对t检验,组间比较采用两独立样本t检验,P<0.05为差异具有统计学意义。
6 结果
6.1大鼠行为学变化 术后1 d各组大鼠都恢复了正常的运动功能,体质量增加正常,未出现烦躁、用嘴反复添前爪、食欲降低等情况。术后2个月,模型组大鼠表现为倦怠、易激惹、活动频繁、烦躁(撕咬肢体等)、用嘴反复添前爪等行为。对照组大鼠无异常行为,见表1。大鼠烦躁行为表现在撕抓颈部皮肤,模型组中有6只大鼠曾25次撕抓颈部皮肤,皮肤出现破损出血,对照中没有出现此类情况。
6.2 影像学表现 对照组颈椎术后2个月变化不大,未出现颈椎生理曲度异常、椎间隙变窄、椎体前缘骨赘形成。见图1-2。
模型组椎间隙变窄、椎体前缘骨赘形成、椎间孔变小及椎体排列异常等椎间盘退变的表现。见图3-6。
6.3 造模前后大鼠正中神经传导速度
6.3.1 感觉神经传导速度(SCV) 模型组与对照组术前正中神经SCV比较,t=0.91,P=0.395,差异没有统计学意义,术后比较,t=28.15,P<0.001,差异有统计学。模型组术前与术后SCV比较,t=22.55,P<0.001,差异有统计学意义,对照组术前与术后SCV比较,t=1.63,P=0.146,差异没有统计学意义,见表2。
6.3.2 运动神经传导速度(MCV) 模型组与对照组术前正中神经MCV比较,t=2.14,P=0.422,差异没有统计学意义,术后比较,t=11.08,P<0.001,差异有统计学意义。模型组术前与术后MCV比较,t=17.91,P<0.001,差异有统计学,对照组术前与术后MCV比较,t=1.61,P=0.151,差异没有统计学意,见表3。
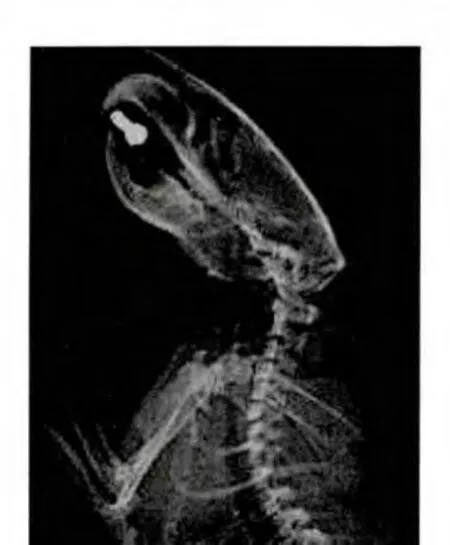
图1对照组大鼠造模前颈椎关节间隙清晰Fig.1 The cervicalvertebra jointspace of ratswas clear in in the controlgroup before building

图2 对照组大鼠造模后颈椎生理曲度变化不大,C5/6、C6/7椎间隙没有明显变化Fig.2 The cervicalphysiologicalcurvature changed little,and C5/6,C6/7 intervertebraldisc had no apparent change of rats in the controlgroup after building
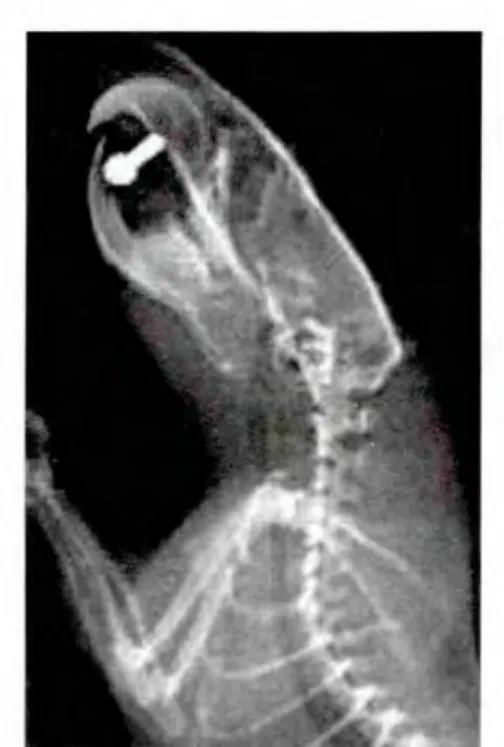
图3模型组大鼠造模前颈椎生理曲度正常Fig.3 The cervicalphysiologicalcurvature of ratswas normal in themodelgroup beforebuilding

图4 模型组大鼠造模后颈椎生理曲度反弓Fig.4 The cervicalphysiologicalcurvature of ratswasarch in themodelgroup after building

图5 模型组大鼠造模前颈椎关节间隙清晰Fig.5 The cervicalvertebra joint clearance of ratswas clear in themodelgroup before building
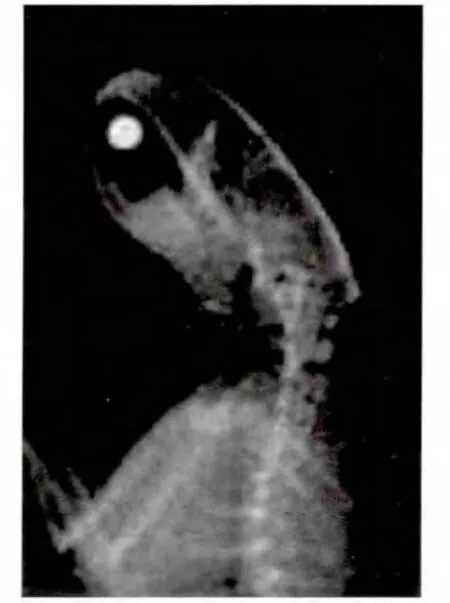
图6 模型组大鼠造模后颈椎关节间隙模糊,变窄Fig.6 The cervicalvertebra joint clearance became fuzzy and narrow ing of rats in themodelgroup after building
表2 两组大鼠正中神经SCV变化±s)Tab.2 Themedian nerve SCV changesof rats in two groups(±s)m/s

表2 两组大鼠正中神经SCV变化±s)Tab.2 Themedian nerve SCV changesof rats in two groups(±s)m/s
组别 例数 感觉神经传导速度 t P治术前 治术后模型组 8 16.39±0.25 13.53±0.22 22.55 0.000对照组 8 16.44±0.11 16.40±0.16 01.63 0.146
表3 两组大鼠正中神经MCV变化(±s)Tab.3 Themedian nerveMCV changesof rats in two groups(±s)m/s
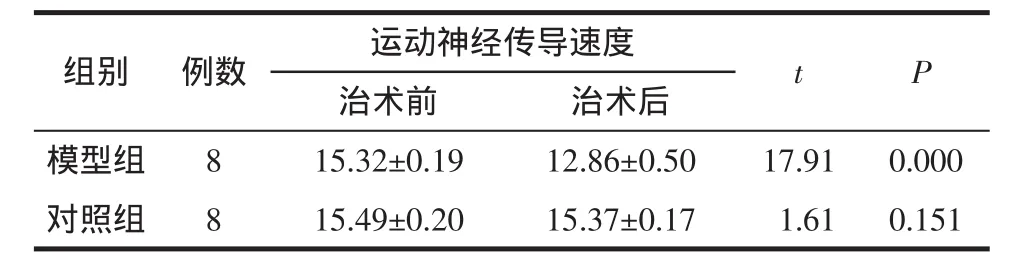
表3 两组大鼠正中神经MCV变化(±s)Tab.3 Themedian nerveMCV changesof rats in two groups(±s)m/s
组别 例数 运动神经传导速度 t P治术前 治术后模型组 8 15.32±0.19 12.86±0.50 17.91 0.000对照组 8 15.49±0.20 15.37±0.17 01.61 0.151
7 讨论
7.1 神经根型颈椎病的造模方法的优缺点 神经根型颈椎病的造模方法很多,梅荣军等[2]选用Wistar大鼠,颈前锁骨下入路,暴露臂丛神经根,用眼科显微止血钳整体钳夹臂丛神经根1次,扣紧1扣,持续约30 s后消毒,缝合。造模方式,观察术后21 d,造模侧上肢已恢复部分功能。Rothman等[3]直接将分离出来的C7神经根用10gf横断面方向钳夹15min,术后即刻出现异常疼痛。赵定麟等[4]通过增加椎间隙内压的办法来造成颈椎病模型。1个月后镜下开始出现病理改变,3个月后出现明显病理改变。张军等[5]用浸有福尔马林的定量滤纸片放在Wistar大白鼠颈6、7神经根下,模拟颈神经根炎实验方法造成了大白鼠颈神经根炎症反应。造模后7 d,模型组大鼠致炎物周围的神经根出现严重的炎症细胞浸润,伴有神经纤维水肿、变性。谢炜等[6]用大鼠改良椎管插线方法建立神经根型颈椎病大鼠神经根性疼痛模型。杨大志等[7]建立了一种由自身骨性增生造成神经根慢性嵌压损伤的动物模型。手术显露家猫右侧C7、C8和L5、L 6神经根及其椎间孔内口,用牙髓钻破坏椎间孔周围骨皮质后,将“V”形松质骨块沿骨壁嵌于神经根通道的骨性管道内及侧隐窝后方。此方法操作复杂,移植的骨块容易松动,而且在神经根周围操作容易造成神经手术损伤,不太适用小型动物,从而增加实验经费。
综上所述,神经根型颈椎病造模目前主要有两种方法:一种直接造成神经挤压型损伤;另一种在神经根旁放置刺激物直接的化学刺激引起神经根的炎性变。直接钳夹或压迫神经根引起神经根的急性炎症反应,造成神经的敏感、变性,是根据神经根机械压迫学说设计的一种造模方法。而神经根旁放置化学刺激物引起神经根的炎性变,是根据神经根化学刺激学说设计的一种造模方法,但是这两种方法都不是很符合神经根型颈椎病的发病特点,神经根型颈椎病是机械性压迫与炎性刺激协同作用造成神经根的损伤,而且退变椎间盘组织分泌炎性因子,引起免疫反应,加重疼痛症状。
7.2 建立新的神经根型颈椎病的理论基础 目前公认椎间盘退变及关节突关节退变是导致脊柱的退变的主要原因[8]。有的学者认为关节突关节的变化继发于椎间盘的退变[9-10],在关节突关节和椎间盘退变的先后关系上现在仍存在争议。一些研究者认为关节突关节的破坏和椎间盘退变没有相关性[11]。而Swanepoel等[12]认为关节突关节的破坏和椎间盘退变之间有相关性。针对颈椎间盘的退变与关节突关节退变的相关研究较少。
关节突关节退变的方法采用Ⅱ型胶原蛋白酶关节突关节注射。Ⅱ型胶原蛋白酶介导的骨关节炎模型变化明显,邓宇等[13]比较不同蛋白酶诱导骨关节炎,低剂量的胶原蛋白酶可较稍高剂量的木瓜蛋白酶诱导出更为严重的软骨退变。镜下显示软骨细胞减少,排列紊乱,裂隙形成。胶原蛋白酶可直接对软骨基质中的胶原纤维进行消化、分解,是构成关节软骨的网状支架遭到破坏,加速了骨关节炎的病程[14]。目前没有Ⅱ型胶原蛋白酶介导的颈椎关节突关节炎的研究,笔者假设Ⅱ型胶原蛋白酶注射入颈椎关节突关节出现类骨关节炎变化,包括软骨的降解,滑液的炎症,软骨下骨的改变,及骨赘的生成。本实验采用显微注射法,将34号注射针头插入关节间隙,用输液泵来控制药物注入关节的药量和速度,这样既可以做到药量的精准,还能保证药液尽量的充满整个关节间隙。
椎间盘退变模型采用的是动静力失衡模型[15],切断大鼠的颈背部深群颈夹肌和头、颈、寰最长肌,完全切除颈骼肋肌与头半棘肌,然后再依次切断C2~C7棘上和棘间韧带。王拥军等[16]用此法造模,5个月后模型成功。动物肌肉分群设计与人体颈部解剖特点相近,颈背部伸肌群破坏后肌力减弱、屈肌群力相应增强,动物始终呈屈颈状态这与已证实的颈椎病最明显的好发因素长期低头工作相似[15]。
两种方法联合运用,Ⅱ型胶原蛋白酶关节突关节注射,造成关节退变,边缘骨赘的生成,椎间盘的退变出现椎间隙的变窄,导致椎间孔的变小,神经根受到卡压。术后2个月病理切片镜下观察:模型组大部分椎间盘的脊索性髓核皱缩,髓核组织中大多数为软骨样细胞,脊索细胞数量较少且大部分出现变性,软骨终板变薄、前部纤维环层状结构消失,个别椎间隙可见脊索性髓核消失及纤维环的裂隙。模型组大鼠神经根中可见大量炎性细胞浸润,神经纤维变粗,大小不一,神经轴突及膜细胞结构不清,肿胀或消失,雪旺细胞自溶、软化、核堆积。造模前后比较椎间隙变窄。甚至骨赘生成。X线表现模型组颈椎生理曲度变直甚至反弓、椎间隙变窄、椎体前缘骨赘形成、椎间孔变小及椎体排列异常等椎间盘退变的表现。模型组大鼠正中神经传导速度与对照组比较明显变慢。
从上述结果可以得出:颈椎后柱的不稳定,尤其是关节突关节的退变对颈椎病的发生发展起到关键的作用,加速了椎间盘退变的进程。此模型药物介导配合动静力失衡,成功的复制了神经根型颈椎病,造模时间短,2个月,手术操作不直接刺激神经根,安全,动物成活率高,经济。注射药物定量,规范,适合推广。
本研究建立的神经根型颈椎病的模型是将椎间盘退变因素与关节突关节退变因素复加,与其他模型比较更符合神经根型颈椎病的发病机制。
[1]刘 鹏,李远栋,张君涛,等.旋提手法对神经根型颈椎病曲度改变的分析[J].天津中医药,2011,28(4)298-300.
[2]梅荣军,高 新,武 亮,等.推拿治疗神经根型颈椎病的动物模型研究[J].中医药信息,2007,24(5):58-59.
[3]Rothman Sarah M,KreiderRob A,Winkelstein Beth A.Spinal Neuropeptide Responses in Persistentand Transient Pain Following CervicalNerve Root Injury.Spine,2005,30(22):2491-2496.
[4]赵定麟,陈德玉,沈 强,等.实验性颈椎病模型的设定[J].中华外科杂志,1993,31(8):453-455.
[5]张 军,孙树椿.神经根型颈椎病(急性期)动物模型的建立[J].中国中医骨伤科杂志,2000,8(1):13-16.
[6]谢 炜,赵伟宏,于 林,等.川芎提取物对神经根型颈椎病模型大鼠根性疼痛的保护作用研究[J].广东药学院学报,2008,24(5):496-499.
[7]杨大志,王坤正,陈君长,等.神经根慢性嵌压损伤的动物模型建立[J].中国脊柱脊髓杂志,2004,14(5):290-294.
[8]KirkaldyWillis,Farfan HF.Instability of the lumbar spine[J].Clin Orthop,1982,165:110-123.
[9]ButlerD,Trafimow JH,Andersson GB,etal.Discsdegeneratebefore facets[J].Spine,1990,15:111-113.
[10]Fujiwara A,Tamai K,Yamato M,et al.The relationship between facet joint osteoarthritis and disc degeneration of the lumbar spine:an MRIstudy[J].Eur Spine,1999,8:396-401.
[11]GriesNC,Berlemann U,Moore RJ,etal.Early histologic changes in lower lumbar discs and facet joints and their correlation[J].Eur Spine,2011,17(9):23-29.
[12]Swanepoel MW,Adams LM,Smeathers JE.Human lumbar apophyseal joint damage and intervertebral disc degeneration[J].Ann Rheum Dis,1995,54:182-188.
[13]邓宇伍筱梅任医民,等.关节腔内注射不同蛋白酶建立兔膝骨关节炎模型的对比研究[J].中华关节外科杂志,2009,3(3):38-41.
[14]Kikuchi T,Sakuta T,Yamaguchi T.Intra-articular injection of collagenase inducesexperimentalosteoarthritis inmature rabbits[J].OsteoarthritisCartilage,1998,6(3):177-186.
[15]王拥军,施 祀,李家顺,等.大鼠退变颈椎间盘组织基因表达谱的研究[J].第二军医大学学报,2002,23(12):1335-1338.
[16]王以进,王介麟.骨科生物力学[M].北京:人民军医出版社,1989:232-233.
Establishmentof chronic animalmodelof the nerve root cervicalspondylosis
JINZhe-feng1,XU Fan-ping2,ZHU Li-guo3,YU Jie3,WANGPing1,BIFang-shan4
(1.The FirstAffiliated Hospitalof Tianjin University of TraditionalChineseMedicine,Tianjin 300193,China;2.Beijing Hospitalof TraditionalChineseMedicine,Beijing100010,China;3.Wangjing Hospital,Chinese Academy ofChineseMedical Sciences,Beijing 100102,China;4.Beijing Fengsheng SpecialHospitalof TraditionalMedical Traumatology and Orthopaedics,Beijing100033,China)
[Objective]Toestablish chronic stagemodelof thenerve rootcervicalspondylosis in the rat through simulation of chronic cervical intervertebral disc and zygapophyseal joints degeneration.[Methods]The48 SD ratswere randomly divided into two groups,model group and false operation group,and observation of intervertebral disc degeneration by cervical spine lateral X-ray respectively 1 d of preoperative and 29 d of postoperative,and detecting the rightbrachial plexusnerve sensory nerve andmotor nerve conduction velocity,recording electrophysiological changes.[Results]Themodel could obviously change of intervertebral disc and nerve conduction function damage changes.[Conclusion]Themethod of simulation of chronic cervical intervertebral disc and zygapophyseal joints degeneration could reflecta chronic stagemodelof thenerve rootcervicalspondylosis.
nerve rootcervicalspondylosis;chronic stage;animalmodel
R681.55
A
1672-1519(2015)09-0558-05
10.11656/j.issn.1672-1519.2015.09.13
金哲峰(1979-),男,主治医师,主要从事中医骨伤研究工作。
2015-04-20)
p

