茶树P5CS基因克隆及其在渗透和高盐胁迫下的表达分析
王丽珊 林清凡 陈兰平 池福铃 郭春芳 张积森
摘 要 △1-吡咯琳-5-羧酸合成酶是植物脯氨酸合成过程中的关键酶。应用同源克隆方法获得茶树P5CS,序列长为1 316 bp,编码323个氨基酸;其编码蛋白分子量为34.7 ku,pI为7.62;N端有1个氨基酸激酶超家族[Amino Acid Kinases(AAK) superfamily]功能区,C端有1个醛脱氢酶超家族[Aldehyde Dehydrogenas(ALDH)superfamily]功能区,预测为亲水性跨膜蛋白;对18个物种的P5CS进行聚类分析,结果生物学分类及进化关系吻合。并与美味猕猴桃高度同源,相似度达89%。应用实时荧光定量PCR分析表明,该基因转录本在水分胁迫24 h内升至对照组水平的2.6倍,而高盐胁迫48 h后才升至9.9倍的最高值;水分胁迫应答速度快,但相对表达量较高盐胁迫低。由此推测该基因被诱导参与了渗透胁迫应答响应,并且对渗透胁迫中的旱害脱水更为敏感。
关键词 茶树;P5CS;实时荧光定量PCR;水分胁迫;高盐胁迫
中图分类号 S571.1 文献标识码 A
Cloning and Expression Analysis of P5CS Gene
under Drought and Salinity Stress
in Camellia sinensis
WANG Lishan1,2,3, LIN Qingfan1,2,3, CHEN Lanping1,2,3, CHI Fuling1,2,3
GUO Chunfang4 *, ZHANG Jisen1,2,3
1 College of Life Sciences, Fujian Normal University, Fuzhou, Fujian 350108, China
2 Key Lab for Sugarcane Genetic Improvement, Ministry of Agriculture, Fuzhou, Fujian 350108, China
3 Genomics and Biotechnology Research Center, Fujian Agriculture and Forestry University,Fuzhou, Fujian 350002, China
4 Fujian Institute of Education, Fuzhou, Fujian 350025, China
Abstract △1-pyrroline-5-carboxylate synthetase(P5CS)is considered to be the key enzyme for proline biosynthesis in plant. In the study,a 1 316 bp-length cDNA fragment of P5CS was cloned from Camellia sinensis cv. Tieguanyin through homology-based cloning strategy. The cDNA encodes a polypeptide with 323 amino acids containing an amino acid kinases domain in N terminal and an aldehyde dehydrogenase motif in C-terminus. Based on the conserved domain search analysis in NCBI,the deducted polypeptide was predicted to be a hydrophilic transmembrane protein. The BLAST results showed that the fragment shared 89% similarity with Actinidia deliciosa(ADU92286). Phylogenetic analysis of P5CS from different species showed an evolutional consistency between the gene and higher plant. Moreover,the expression patterns of CsP5CS under the drought and salt stress were detected by real-time quantitative PCR. The CsP5CS gene expression level of the plant with 24 h PEG stress and 48 h high-salt stress was 2.6 and 9.9 times,respectively,as the control. The significant up-regulation expression under both PEG and salt stress treatments suggested that CsP5CS involved in the response to osmotic stress and might function to dehydration resistance by relegating the accumulation of proline. Meanwhile,CsP5CS is more sensitive to drought stress than salinity stress in the response to osmotic stress.
Key words Camellia sinensis; P5CS; Real-time quantitative PCR; Drought stress; Salinity stress
doi 10.3969/j.issn.1000-2561.2015.01.012
土壤水分是茶树生理与生态需水的主要来源,旱害给茶树生长、茶叶产量和品质带来较大影响。脯氨酸是植物面对水分和高盐胁迫积累的最为重要的渗透调节物质,以增强自身对渗透胁迫的抵抗能力[1-3]。一般认为脯氨酸的生物合成途径有2种,即谷氨酸途径和鸟氨酸途径[4-5]。其中谷氨酸途径中的关键酶是△1-吡咯琳-5-羧酸合成酶(△1-pyrroline-5-carboxylate synthetase,P5CS:EC2.7.2.11/1.2.2.41)[6-13]。近年有关茶树抗旱性与叶片组织中脯氨酸含量变化的动态关系其研究结果不尽相同。王守生[14]、吴伯千[15]、Handique等[16]认为脯氨酸的积累与茶树渗透调节呈正相关;伍炳华[17]、李华均[18]、李金昌[19]认为脯氨酸的积累与茶树渗透调节无明确关系;潘根生等[20-21]认为茶树的脯氨酸积累与茶树渗透调节无明确关系,但与茶树的品种有关。
目前,对茶树抗旱的分子机制研究尚处于初期阶段。为了探讨茶树水分、高盐胁迫下脯氨酸代谢关键基因P5CS的分子调控机制,本研究选用茶树铁观音为研究材料,运用同源克隆技术克隆茶树铁观音中谷氨酸途径中的关键酶基因P5CS;利用生物信息学方法对基因的功能进行预测分析;采用实时荧光定量PCR技术对水分胁迫和高盐胁迫下该基因的表达特征进行分析,以期为提高茶树抗旱基因工程奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 供试材料为福建安溪1年生的铁观音(Camellia sinensis cv. Tie-guanyin)茶树扦插苗。
1.1.2 试剂 Prime ScriptTM 1st strand cDNA Synthesis Kit、Taq DNA聚合酶、pMD19-T Vector Kit、SYBR染料、Dnase I购自TaKaRa公司,E.coli DH5α由本实验室保存,引物合成及测序由上海生工生物工程公司完成,其他试剂均为国产分析纯。
1.2 方法
1.2.1 材料处理 选择生长情况、大小基本一致的1年生的铁观音(Camellia sinensis cv. Tie-guanyin)茶树扦插苗,移栽至1/2剂量的Hoagland营养液修复培养,置于玻璃温室自然光照,每天定时通气,3 d后用分别用25%聚乙二醇(PEG-6000)溶液和200 mmol/L NaCl溶液,模拟水分胁迫和高盐胁迫进行培养,对照为1/2剂量的Hoagland营养液水培,重复5次,分别为对照0(K0)、24(K1)、48(K2)、72 h(K3);25% PEG 处理0(P0)、24(P1)、48(P2)、72 h(P3);200 mmol/L NaCl处理0(N0)、24(N1)、48(N2)、72 h(N3);取每组的茶树幼苗芽下第2、3叶片,液氮速冻后于-80 ℃冰箱保存备用(表1)。
1.2.2 茶树铁观音叶片组织总RNA的提取与cDNA第一链的合成 采集经过水分、高盐胁迫处理的茶树铁观音幼苗芽下第2、3叶片组织为实验材料提取总RNA,提取方法参照宛晓春[22]改良CTAB法,运用购自TaKaRa公司的Dnase I 对茶树基因组DNA消化处理。取适量茶树叶片组织总RNA用1%琼脂糖凝胶电泳检测分析质量。以消化处理后的茶树叶片组织总RNA为模板,参照TaKaRa公司的Prime ScriptTM 1st strand cDNA Synthesis Kit操作说明,以oligo(dT)和Random 6 mers为逆转录引物合成cDNA第一链。
1.2.3 茶树铁观音P5CS的克隆与测序 利用同源克隆的方法,在NCBI核酸数据库中检索近缘植物的△1-吡咯琳-5-羧酸合成酶基因序列,主要参照葡萄(Vitis vinifera)(XM_002282319.2)、美味猕猴桃(Actinidia deliciosa)(ADU92286)、拟南芥(Arabidopsis thaliana)(NM_115419.4)、欧洲大叶杨(Populus trichocarpa)(XM_002315166.1)、大豆(Glycine max)(NM_00125122-4.1)、二穗短柄草(Brachypodium distachyon)(XM_003568279.1)、番茄(Solanum lycopersicum)(NM_001246978.1)、蓖麻(Ricinus communis)(XM_002524184.1)的P5CS序列,选择高度保守的区段,设计如下2对同源引物(PS1-F、PS1-R、PS2-F、PS2-R)分别进行PCR扩增(表2)。反应体系为25 μL:10×PCR buffer 2.5 μL,dNTPs 0.5 μL,上下游引物各1.0 μL,模板1.0 μL,ExTaq酶0.5 μL。反应条件为:94 ℃ 5 min预变性;94 ℃ 30 s变性,57 ℃ 30 s退火,72 ℃ 1 min延伸,进行35个循环;72 ℃ 10 min。回收扩增产物,利用pMD19-T载体,转化到E.coli DH5α,挑取阳性克隆,由上海生工生物工程技术服务有限公司测序。
1.2.4 茶树铁观音P5CS核苷酸序列,氨基酸序列分析和系统进化树构建 运用BioEdit软件将得到的序列进行电子拼接,同源比对验证;运用ORF Finder在线软件(http://www.n-cbi.nlm.nih.gov/gorf/gorf.html)预测序列的开放阅读框;运用ExPASy在线工具对编码蛋白的等电点、分子量等理化性质进行分析;运用NCBI数据库的CDD程序(http://www.ncbi.nlm.nih.gov/Structure/c dd/wrpsb.c-gi)分析编码蛋白的保守结构域;运用TMHMM在线软件(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构;运用HNN在线软件(http://npsapbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html)分析编码蛋白的二级结构;利用SignalP在线软件(http://www.cbs.dtu.dk/services/SignalP/)分析编码蛋白的信号肽;通过MEGA 5.0软件对克隆获得的茶树铁观音P5CS与其他近缘物种P5CS进行同源性比对并构建系统进化树发育分析。
1.2.5 实时荧光定量PCR分析 根据所克隆的茶树铁观音P5CS,运用Primer 5.0软件设计实时荧光定量PCR引物(RP-F、 RP-R),所选用内参基因为β-Actin(A-F、A-R)(表2)。将水分、高盐胁迫处理下的茶树铁观音叶片组织的cDNA,参照Bio-Rad SsoAdvanced SYBR Green Supermix Kit操作说明,在Bio-Rad CFX Manager 3.0上对目的基因进行实时荧光定量PCR检测。反应体系为20 μL:SsoAdvanced SYBR Green Supermix 10 μL,cDNA 1 μL,上下游引物各0.5 μL,ddH2O 8 μL。反应程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,65 ℃ 1 min,循环40次。运用2-△△CT法[23]分析计算茶树铁观音P5CS的相对表达量。
2 结果与分析
2.1 茶树铁观音叶片组织总RNA提取和cDNA第一链的合成
电泳结果显示28 S rRNA和18 S rRNA条带清晰明亮,两者的比例大约为2 ∶ 1,并且5 S条带清晰可见,说明RNA较完整,质量良好。将茶树铁观音叶片组织总RNA逆转录合成cDNA第一链,经检测,质量达到后续实验的要求。
2.2 茶树铁观音P5CS片段的克隆
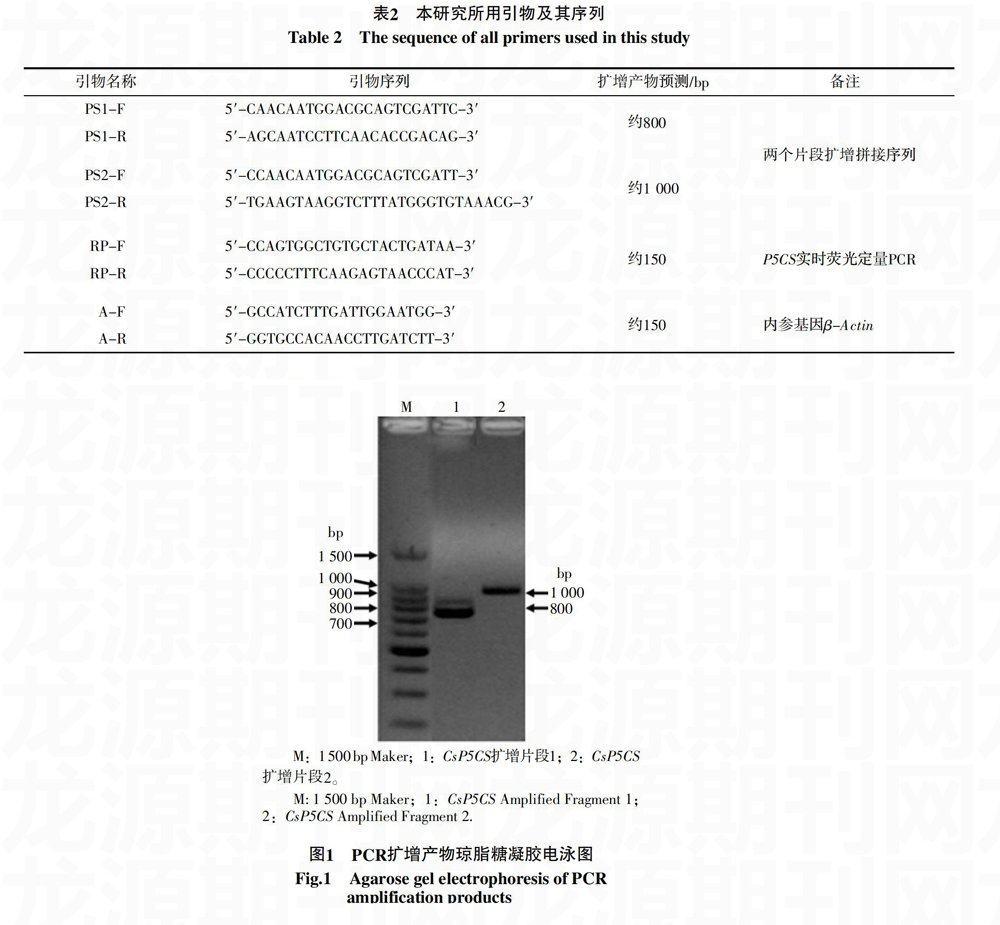
根据NCBI数据库中茶树铁观音近缘植物的P5CS序列,设计2对引物,经多轮PCR扩增得到两条片段,电泳结果显示约为800 bp和1 000 bp的片段,扩增特异性良好,与预计的目的片段长度相似(图1)。测序后通过Blast分析比对,证实为P5CS片段序列。
2.3 茶树铁观音CsP5CS片段的生物信息学分析
2.3.1 CsP5CS核苷酸序列分析 将测序后的片段进行拼接,获得P5CS基因片段长为1 316 bp,预测其编码一个长为323个氨基酸的多肽片段。该基因编码的蛋白质分子质量为34.7 ku,pI为7.62。将所克隆的茶树铁观音P5CS命名为CsP5CS。将茶树铁观音CsP5CS的核苷酸序列在NCBI数据库中进行Blast比对,发现其与以下物种的P5CS有较高的同源性:美味猕猴桃(O04015.1)、蜡烛果(Aegiceras corniculatum,AAW50846.1)、欧洲大叶杨(XP_002315202.1)、麻疯树(Jatropha curcas,GU358610.1)、湖北海棠(Malus hupehensis,JF742986.1)、 胡杨(Populuse uphratica,EF412967.1)、蓖麻(XM_
002524184.1)、葡萄(NM_001281205.1),同源性分别为89%、84%、83%、83%、83%、83%、83%、83%。测序结果和核苷酸序列的同源性比对验证了该基因的准确性。
2.3.2 CsP5CS氨基酸序列分析 根据网站预测参数,其不稳定系数为38.25,不稳定系数大于40时为不稳定蛋白,由此预测该蛋白是一个不稳定蛋白。CsP5CS的GRAVY值为0.11,结合ProtScale亲/疏水性分析结果,预测该蛋白为亲水性蛋白。蛋白质疏水性分析对于研究其跨膜特征和二级结构有着重要的指导意义,通常认为,氨基酸分值越低亲水性越强,分值越高疏水性越强。CsP5CS氨基酸序列的第170位氨基酸分值最高,为2.822,疏水性最强;第202位氨基酸分值最低,为-2.167,亲水性最强。就整体分析而言,亲水性氨基酸均匀分布在整个多肽链中,没有明显的疏水性区域,因此,推测CsP5CS是一个亲水性蛋白(图2)。利用TMHMM在线软件,预测CsP5CS氨基酸序列跨膜区段结果显示,1~6位氨基酸在膜内,7~29位氨基酸为跨膜螺旋,30~323位氨基酸在膜外。因此,推测该基因编码的蛋白为跨膜蛋白(图3)。利用HNN在线软件,预测CsP5CS蛋白质二级结构结果显示,CsP5CS的肽链有129个氨基酸参与α-螺旋结构,占39.94%;有71个氨基酸参与延伸链结构,占21.98%;有123个氨基酸参与无规则卷曲结构,占38.08%;整体分析,α-螺旋和无规则卷曲结构占大多数(图4)。利用SignalP在线软件,预测CsP5CS的信号肽结果显示,原始剪切位点分值(C值)、信号肽分值(S值)和综合剪切位点分值(Y值)均比较低,无氨基酸残基位点,因此,可能不存在信号肽,是一个非分泌蛋白(图5)。利用NCBI数据库对CsP5CS蛋白的结构域进行分析,结果显示该基因编码蛋白在N端有1个氨基酸激酶超家族[Amino Acid Kinases(AAK)superfamily]功能区,在C端有1个醛脱氢酶超家族[Aldehyde Dehydrogenase(ALDH)superfamily]功能区。该超家族成员在生物体内执行着多种功能,其表达与膨压和渗透胁迫相关(图6)。
2.3.3 系统进化树分析 将本研究获得CsP5CS的氨基酸序列与其他17个物种的P5CS氨基酸序列构建邻接(Neighbor joining)系统进化树(图7)。图中可分为3组,CsP5CS与中华猕猴桃、美味猕猴桃、蜡烛果、拟南芥、葡萄等双子叶植物聚为一类,双子叶植物中亲缘关系最近及远依次为美味猕猴桃(A. deliciosa)、中华猕猴桃(A. chinensis)、蜡烛果(A. corniculatum)、烟草(N. tabacum)、多裂水茄(Solanumtorvum)、马铃薯(S. tuberosum)、蕃茄(S. lycopersicum)、葡萄(V. vinifera)、黄瓜(C. sativus)、拟南芥(A. thaliana)、玉米(Z. mays)、水稻(O. sativa)、二穗短柄草(B. distachyon)等单子叶植物聚为一类。动物界的亲缘关系由近及远为秀丽隐杆线虫(C. elegans)、热带爪蟾(X. tropicalis)、人类(H. sapiens)、小鼠(M. musculus)。由P5CS的无根进化树可以看出,植物中单子叶植物与双子叶植物的P5CS能聚为一簇,这与单双子叶植物进化过程一致。动物的P5CS也可以聚成一簇。结果与形态学上分类的进化关系基本一致,基本上可反映该基因的进化规律和物种进化的协同关系。其中,CsP5CS与双子叶植物中的中华猕猴桃和美味猕猴桃亲缘关系最近,可推测由同一祖先经不同的途径进化而来。
2.4 水分、高盐胁迫处理下CsP5CS在叶片组织中的表达分析
实时荧光定量PCR中融解曲线(图8)分析表明,CsP5CS与内参基因(β-Actin)的融解曲线均为锐利的单峰型,且Tm值在80~85 ℃之间,表明扩增产物特异性好,无非特异扩增,且无引物二聚体。扩增曲线分析表明,CsP5CS与内参基因(β-Actin)的扩增曲线均呈S形,有明显的指数扩增区,符合数据要求。
运用2-△△CT法计算CsP5CS的相对表达量(图9)。结果显示,茶树铁观音幼苗在水分胁迫(25% PEG)处理下,叶片组织中CsP5CS表达水平呈“先上升后下降”的趋势。水分胁迫处理0~24 h之间,CsP5CS表达量呈上升趋势;水分胁迫处理24 h,CsP5CS相对表达量最高,为对照组的2.6倍;水分胁迫处理24~72 h,CsP5CS表达量呈下降趋势;水分胁迫处理48 h,CsP5CS表达量比对照组高,为对照组的1.9倍;水分胁迫处理72 h,CsP5CS表达量比对照组低,为对照组的0.6倍。茶树铁观音幼苗在高盐胁迫(200 mmol/L NaCl)处理下,叶片组织中CsP5CS表达水平呈“持续上升”趋势。高盐胁迫处理0~72 h之间,CsP5CS表达量都呈上升趋势;高盐胁迫处理72 h,CsP5CS表达量最高,为对照组的9.9倍;高盐胁迫处理0~24 h时,CsP5CS表达量差异不显著,高盐胁迫处理24 h,CsP5CS表达量比对照组高,为对照组的1.1倍;高盐胁迫处理24~72 h之间,CsP5CS表达量差异显著,明显高于对照组,高盐胁迫处理48 h,CsP5CS表达量比对照组高,为对照组的2.8倍。以上数据可以推测CsP5CS基因是茶树铁观音响应渗透胁迫应答基因之一,茶树铁观音CsP5CS基因对2种胁迫的应答速度不同,干旱胁迫处理下的应答速度较高盐胁迫下的应答速度快,且干旱胁迫处理下CsP5CS基因相对表达量较高盐胁迫处理下低。
2.5 水分、高盐胁迫处理下茶树铁观音幼苗表型变化
水分胁迫处理下,茶树叶片于24 h开始萎蔫,随着时间延长叶片萎蔫程度逐渐加重,叶片和叶柄的夹角随时间的延长逐渐变小。水分胁迫处理72 h,叶片萎蔫程度最严重,叶片卷曲程度大,叶片颜色由绿色变褐色,已接近枯萎,叶片和叶柄的夹角为3个处理组中最小。高盐胁迫处理下,茶树叶片于48 h开始萎蔫,随着时间延长叶片萎蔫程度略微加重,叶片和叶柄的夹角随时间的延长略微变小。高盐胁迫处理72 h,叶片萎蔫程度较轻,叶片卷曲程度小,颜色仍为绿色,与对照组相比,叶片和叶柄的夹角略微变小。
3 讨论与结论
脯氨酸是植物面对干旱和高盐胁迫,积累的最为重要的渗透调节物质[1-3]。P5CS作为脯氨酸生物合成中的限速酶,在脯氨酸的合成过程中起着至关重要的作用[6-12]。本研究中,首次以茶树铁观音作为实验村料,利用同源克隆的方法,克隆得到茶树铁观音P5CS,并命名为CsP5CS。通过生物信息学分析,该基因推导的氨基酸序列与已知的其它物种该基因的氨基酸序列比对发现同源性均在83%以上,说明该基因在生物进化上具有高度保守性。该基因推导的蛋白预测为亲水性跨膜蛋白。蛋白质N端有1个氨基酸激酶超家族功能区,在C端有1个醛脱氢酶超家族功能区。该超家族成员在生物体内执行着多种功能,其表达主要与膨压和渗透胁迫相关。依据CsP5CS氨基酸序列构建系统进化树分析表明,单子叶植物与双子叶植物各聚为一大类,CsP5CS与美味猕猴桃、中华猕猴桃、蜡烛果、烟草、多裂水茄、马铃薯、蕃茄、黄瓜聚为一小类,与中华猕猴桃和美味猕猴桃亲缘关系最近,推测由同一祖先经不同的途径进化而来。分子系统树的分析结果与传统形态学的分类结果基本吻合,基本上可反映这一组物种的亲缘关系规律。以上结果表明,CsP5CS为△1-吡咯琳-5-羧酸合成酶基因,在茶树铁观音脯氨酸生物合成的谷氨酸途径中起到重要作用。
通过实时荧光定量PCR,对干旱、高盐胁迫处理下的茶树铁观音的CsP5CS表达情况分析表明:(1)CsP5CS在胁迫诱导下都呈现上调表达。与报道的大豆[24]、菜豆[25]、罗布麻[26]、甘蔗[27]中P5CS表达特性相同,进一步说明茶树铁观音体内存在着渗透胁迫后脯氨酸积累的适应机制,脯氨酸代谢受CsP5CS基因转录和翻译水平的调控。这为进一步研究茶树铁观音体内该基因在渗透胁迫下的生理功能及作用机理奠定了基础。(2)在干旱胁迫处理期间,叶片组织中CsP5CS基因在0~24 h之内出现较明显的上调表达,24 h达最高峰,相对表达量为对照组的2.6倍,24 h后出现下调表达,直到72 h降为最低。说明在干旱胁迫处理下,茶树铁观音通过CsP5CS基因的上调表达适应干旱,当处理时间超过72 h,可能已超过植物耐受范围。在高盐胁迫处理期间,叶片组织中CsP5CS基因于24~48 h才出现较明显的上调表达,72 h达最高峰,相对表达量为对照组的9.9倍。Igarashi等[27]研究显示,水稻OsP5CS基因在干旱胁迫、高盐胁迫、ABA处理下都出现上调表达。干旱胁迫处理期间,水稻OsP5CS基因于0~5 h内出现上调表达,10 h达最大,之后出现下调表达。高盐胁迫处理期间,水稻OsP5CS基因于0~24 h内出现上调表达,24 h达最大。Yoshiba等[28]研究显示,拟南芥AtP5CS基因在干旱、高盐胁迫处理下也出现类似的表达特性。与本研究的结果一致,可以推测CsP5CS基因是茶树铁观音响应渗透胁迫应答基因之一,茶树铁观音CsP5CS基因对两种胁迫的应答速度不同,干旱胁迫处理下的应答速度较高盐胁迫下的应答速度快,且干旱胁迫处理下CsP5CS基因相对表达量较高盐胁迫处理下低。茶树铁观音对干旱胁迫比高盐胁迫敏感,对高盐胁迫处理下的适应能力较干旱胁迫处理下的适应能力强。该结果可能与茶树的品种或者特有的生理特性有关,对提高茶树抗逆性具有重大意义。
本研究利用同源克隆首次从茶树铁观音中克隆得到了CsP5CS,为茶树铁观音脯氨酸合成酶系基因的系统研究以及通过分子生物学技术提高茶树铁观音的抗逆性提供了线索。实时荧光定量PCR分析,CsP5CS在干旱、高盐胁迫条件均上调表达,干旱胁迫下应答速度快,高盐胁迫下相对表达量高。这些结果可能与茶树品种或者特有的生理特性有关,具有进一步的研究价值。后期将结合RNA-seq相关数据,在全转录本水平对茶树铁观音在不同胁迫下的表达特性进行探讨。
参考文献
[1] Jime'nez-Bremont J F, Becerra-flora A, Herna'ndez-Lucero E, et al. Proline accumulation in two bean cultivars under salt stress and the effect of polyamines and ornithine[J]. J Biol Plant, 2006, 50(4): 763.
[2] Tripathi S B, Gurumurthi K, Panigrahi A K, et al. Salinity induced changes in proline and betaine contents and synthesis in two aquatic macrophytes differing in salt tolerance[J]. J Biol Plant, 2007, 51(1): 110.
[3] 焦 蓉, 刘好宝, 刘贯山, 等. 论脯氨酸累积和植物抗渗透胁迫[J]. 中国农学通报, 2011, 27(7): 216-221.
[4] Zhang C S, Lu Q, Verma D P S. Removal of feedback inhibition of △1-pyrroline-5-carboxylate synthetase, a bifunctional enzyme the first two steps of praline biosynthesis in plants[J]. J Biol Chem, 1995, 270: 20 491-204 966.
[5] 许详明, 叶和春, 李国凤. 脯氨酸代谢与植物搞渗透胁迫的研究进展[J]. 植物学通报, 2000, 17(6): 536-542.
[6] Hong Z L, Lakkineni K, Zhang Z H, et al. Removal of feedback inhibition of △1-pyrroline-5-carboxylate synthetase results in increased proline accumulation and protection of plants from osmotic stress[J]. Plant Physiol, 2000, 122: 1 129-1 136.
[7] Zhu B, Su J, Chang M, et al. Overexpression of △1-pyrroline-5-carboxylate synthetase gene and analysis of tolerance to water and salt stress in transgenicrice[J]. Plant Sci, 1998, 139: 41-48.
[8] Zhang C S, Lu Q, Verma D D S. Removal of feedback inhibition of DELTA-1-Pyrroline-5-carbosylatesynthetase, a bifunctional enzyme catalyzing the first two steps of proline biosynthesis in plants[J]. J of Biol Chem, 1995, 270(35): 20 491-20 496.
[9] Anoop N, Gupta A K. Transgenic indica rice cv IR-50 over-expressing vigna aconitifolia△1-pyrroline-5-carboxylate synthetase cDNA shows toleranceto highsalt[J]. Plant Biochem. Biotechnol, 2003, 12: 109-116.
[10] Su J, Wu R. Stress-inducible synthesis of praline in transgenic rice confers faster growth under stress conditions than that with constitutive synthesis[J]. Plant Sci, 2004, 166: 941-948.
[11] Molinari, H B C. Osmotic adjustmen in transgenic citrus rootstock Carrizocitrange(Citrus sinensis Osb. Poncirustrifoliate L. Raf.)overproducing proline[J]. Plant Sci, 2004, 167: 1 375-1 381.
[12] Larosa P C, Rhodes D, Rhodes J C, et al. Elevated accumulation of proline in NaCl-adppted tobacco cells is not due to altered 1-pyrroline-5-carboxylate reductase[J]. Plant Physiol, 1991, 96: 245-250.
[13] De Ronde, J A Cress, W A Kruger, et al. Phytosynthetic response of transgenic soybean plants, containing an Arabidopsis P5VR gene, during heat and drought stress[J]. J PlantPhysiol, 2004, 161: 1 211-1 224.
[14] 王守生. 茶树游离脯氨酸含量及水分胁迫对其影响[J]. 茶叶, 1995, 1: 22-25.
[15] 吴伯千, 潘根生. 茶树对水分胁迫的生理生化反应[J]. 浙江农业大学学报, 1995, 21(5): 451-456.
[16] Handique A C. 抗旱茶树选种指标(许宁译)[J]. 茶叶科学简报, 1991, 3: 34 -36.
[17] 伍炳华, 韩文炎, 姚国坤. 茶树对土壤干旱的生理反应[J]. 中国茶叶, 1991, 6: 2-3.
[18] 李华钧. 渗透胁迫对茶树幼苗叶片脯氨酸累积和水分含量的影响[J]. 西南农业大学学报, 1993, 8: 119-122.
[19] 李金昌. 旱热季节不同唢水培对秋茶产量和品质的影响[J]. 中国茶叶, 1987, 5: 2-4.
[20] 潘根生. 茶树新梢生育的内源激素水平及其调控机理(第三报)[J]. 茶叶2001, 27(1): 35-38.
[21] 潘根生, 吴伯千, 沈生荣, 等. 水分胁迫过程中茶树新梢内源激素水平的增长及其耐旱性的关系[J]. 中国农业科学, 1996, 29(5): 9-15.
[22] 史成颖, 宛晓春, 江昌俊, 等. 提取高质量茶树总RNA的方法研究[J]. 安徽农业大学学报, 2007, 34(3): 360-363.
[23] Livak K J, Schmittgen T D. Analysis of relative gene expression date using Real-Time quantitative PCR and the 2-△△CT Method[J]. Methods, 2001, 25(4): 401-408.
[24] 张春宝, 赵洪锟, 丁福章, 等. 野生大豆△1-吡咯琳-5-羧酸合成酶基因(P5CS)基因的克隆与序列分析[J]. 大豆科学, 2008, 27(6): 915-919.
[25] 陈吉宝, 赵丽英, 毛新国, 等. 转PvP5CS1基因拟南芥植株对干旱和盐胁迫的反应[J]. 作物学报, 2010, 36(1): 147-153.
[26] 郭 旭. 罗布麻、胡杨P5CS基因的克隆及其功能初步分析[D]. 中国优秀硕士学位论文全文数据库, 2007, (05).
[27] 张积森, 陈由强, 张木清, 等. 甘蔗△1-吡咯琳-5-羧酸合成酶基因(P5CS)基因的克隆及其表达分析[J]. 热带作物学报, 2009, 30(9): 1 337-1 344.
[28] Igarashi Y, Yoshika Y, Sanada Y, et al. Characterization of the gene for delta1-pyrroline-5-carboxylate synthetase and correlation between the expression of the gene and salt tolerance in Oryza sativa L[J]. Plant Mol Biol, 1997, 33: 857-865.
[29] Yoshiba Y, Kiyosue T, Katagiri T, et al. Correlation between the induction of gene for △1-pyrroline-5-carboxylate synthetase and the accumulation of praline in Arabidopsis thaliana under osmotic stress[J]. Plant, 1995, 7: 751-760.