撒施石灰石粉对橡胶树细根空间分布及季节动态的影响
王真辉 刘季 胡义钰 孙亮 陈秋波 袁坤
摘 要 土壤酸化对橡胶树细根生长具有严重影响。为了解橡胶树细根生长对土壤酸度改变的响应,本研究在热研7-33-97未开割(7 a)、开割5 a、开割10 a共3个胶园选取样树,采用撒施石灰石粉的方式进行土壤酸度改良,并用土钻法观测橡胶树根系对土壤酸度改变的响应。结果显示:同一割龄胶园中土壤酸化改良植株(改良组)与对照植株(对照组)相比,其细根生物总量显著增加,且均符合开割5 a胶园的最高,开割10 a胶园的最低这一规律。酸性土壤改良后橡胶树细根在垂直与水平方向生物量均有所增加,分布规律无明显改变。不同割龄胶园改良组与对照组中橡胶树细根年内变化趋势均为单峰型,峰值出现在当年7~9月,年变化规律无明显改变。本研究结果表明,胶园酸性土壤经施用石灰石粉后橡胶树的细根生长量提高,有利于橡胶树从土壤中吸收更多的水分和养分,从而改善橡胶树的生长和提高其产量。
关键词 橡胶树;细根;生物量;石灰石粉
中图分类号 S794.1 文献标识码 A
Influence of Limestone Powder Doses on the Fine Root Spatial Distribution and Seasonal Dynamics of Hevea brasiliensis
WANG Zhenhui1,LIU Ji1,2,HU Yiyu1,SUN Liang1,CHEN Qiubo1,YUAN Kun1*
1 Rubber Research Institute, Key Laboratory of Biology and Genetic Resources of Rubber Tree,
Ministry of Agriculture, Danzhou, Hainan 571737, China
2 College of Agriculture, Hainan University, Haikou, Hainan 570100, China
Abstract Soil acidification has great implications on the fine root growth of rubber tree. To understand the response of fine root growth to the change of soil acidity, the growth performance of the fine roots were evaluated in limestone application treatments and no limestone-addition controls in the period from March 2012 to January 2013 by using sequential root coring methods. The hevea clone used was Reyan 7-33-97 at the ages of 7 a (not tapping yet), 12 a (being tapped for 5 years)and 17 a(being tapped for 10 years). The results indicated that there was significant difference in root biomass between the treatments and the controls in all the tree ages. The most remarkable effects in increment of fine root biomass was recorded in the trees of 12 years old that had been tapped for 5 years, while the least increment effects in the trees of 17 years old which had been apped for 10 years. The vertical distribution of the fine roots varied with tree ages, but shared the same pattern as the soil depth increased the fine roots dencity decreased to give lower percentage in the total fine root biomass. Horizontally, the fine root distribution varied between the treatments and the controls among different age groups. In any case the fine root biomass of rubber trees was found to increase somewhat either vertically or horizontally with the application of limestone on the surface of acid soil under rubber tree at different ages. The annual variation of the total fine root biomass of rubber trees including both the treatments and the controls showed a one-peak type. However, the occurrence of the peak was not all in the same months. For those trees of 7 years old and 12 years old the peak appeared in July while for those trees of 17 years old in September. No uniform patterns were observed on the fine root biomass of different soil layers under rubber trees of varied ages, but the emergernce of the peak of varied soil layers coincided with that of the total fine root biomass without any exception. It is therefore concluded that amendment of soil pH through the application of limestone is encouraged for the sake of higher fine root growth and turnover to enable rubber trees to uptake more nutrients and water from the soils for better growth and yield of the trees.
Key words Hevea brasiliensis;Fine root;Biomass;Limestone
doi 10.3969/j.issn.1000-2561.2015.01.001
在森林生态系统中,细根的生长和周转是森林生态系统物质循环和能量流动的一个重要组成部分[1],细根周转对树木体内碳和养分循环具有重要的影响[2],通过生物量的定期变化体现出来。
中国在20世纪50~60年代已经开始橡胶树根系生长和分布的研究[3],而土壤环境条件对橡胶树细根生长动态及周转影响的研究尚未充分展开。林希昊等[4-6]研究了不同树龄橡胶树细根生物量变化、垂直分布及动态,水分与养分对细根生物量的影响,发现橡胶树细根生物量与不同生长或生产期有密切关系,土壤含水量和土层深度是橡胶树细根生物量的主要影响因子,细根生长对环境变化的响应产生一定的滞后性。云南西双版纳橡胶树细根生物量变化具有明显的季节动态,呈“单峰型”生长[7]。
Guo等[8]通过对中国主要农田土壤pH值20 a的变化研究发现,过去20 a中,中国南方农田土壤pH值平均下降了约0.5个单位,相当于土壤酸量(H+)在原有基础上增加了2.2倍。氮肥过量施用是中国农田土壤酸化加速的首要原因。Jentschke等[9]发现,土壤酸化可以影响挪威云杉细根分布,Godbold等[10]进一步证实上述观点,并指出细根碳输入率会随着土壤酸化进程发生变化。
近年来,热带地区的橡胶种植面积不断扩大,而土壤酸化对橡胶树细根生长带来不利影响。因此,研究橡胶树细根生长对土壤酸度改变的响应,可以为橡胶人工林合理经营以及提高其生产力提供重要的理论依据。
1 材料与方法
1.1 试验区环境及状况
试验区位于海南省儋州市,中国热带农业科学院试验场六队(19°32′ N,109°28′ E),平均海拔约为134 m,该区属热带海岛季风气候类型,历年平均气温23.2~-23.9 ℃,日平均气温≥15 ℃的活动积温7 500~8 500 ℃,最冷月平均气温16.9~18.0 ℃,年降水量1 500~2 000 mm(数据来自中国热带农业科学院气象站)。地势较为平缓,土壤类型为砖红壤,有机质为11.2 mg/kg、全氮为0.45 mg/kg、速效磷13.61 mg/kg、有效钾6.53 mg/kg,土壤pH值为4.19~4.95,垂直深度在60 cm之下土层中有零星碎石分布。胶园样地为第2代胶园,品系为热研7-33-97,单一人工群落,群落结构简单,采用宽行密株模式,株行距为3 m ×7 m。选用未开割(树龄7 a)、开割5 a(树龄12 a)与开割10 a(树龄17年)3个胶园。未开割、开割5 a及10 a胶园的橡胶树平均胸围分别为45.13、69.98和76.62 cm。
1.2 研究方法
1.2.1 样树的选取 在试验区内分别选取未开割、开割5 a和开割10 a 3个胶园,每木检尺,选出平均样树。排除边缘效应后,将选出的样树分为2组,一组作为石灰石粉改良组,另一组不做任何处理,作为对照组。每组中选择6株样树,采用土钻法定期钻取不同土层土样。
1.2.2 细根调查方法与指标测定 2012年3月至2013年1月,用土钻法采集胶园中橡胶树样树株根系,采样间隔为2个月,每次采样时间为当月的中旬,采样时天气以晴天为宜,最好在采样前连续3个晴天。以橡胶树树干为中心,在两边行间距树干1.0 m,半径为0.5 m的圆环上,用直径为4.0 cm土钻沿“S”形随机钻取5土芯,每10 cm一层,共取10层,同一土层装在一个袋子,写上标签带回实验室。用同样的方法在两边行间距树干2.5 m正60°圆环(圆环半径为0.5 m)上钻取土芯。土样采集回来后,先用自来水将土样泡软,然后倒入直径为1.5 mm的筛网中,用清水反复冲洗至无泥沙,洗净后挑选出直径≤2 mm的细根,并依据细根的颜色、外形和弹性等区分出活细根与死细根分别存放。之后将细根样品烘干称重得到细根重量。
1.2.3 细根指标的计算 生物量定义为单位面积上所有生物有机体的干重,所以细根生物量是指单位面积上所有细根的干重。计算生物量的公式为:
B= (1)
式中,B为细根的生物量(kg/hm2);m为每次土钻所采样品中细根的干重(g);R为采样时使用土钻的半径(cm)。
1.2.4 土壤改良 选用石灰石粉为土壤改良剂,石灰石粉直径小于100目,其中CaCO3含量大于99%。改良方式为表面撒施,改良目标为使耕作层pH值达到6.5,使用量根据土壤农化标准计算,石灰石粉使用量计算公式为:
CaCO3/(kg/hm2)=×0.05×2 250 000×1.3
式中: c、V为滴定时消耗Ca(OH)2标准溶液的浓度(mol/L)和体积(mL);m为风干土样重(g);0.05为1/2 CaCO3的摩尔质量(kg/mol);2 250 000为每公顷耕层土壤的质量(kg/hm2);1.3为实验室测定值与田间实际情况的差异系数。
通过计算,未开割、开割5 a和开割10 a 3个胶园的石灰石粉撒施量为3 180.32、3 583.12 和3 217.50 kg/hm2。石灰石粉撒施时间选择在2011年11月中下旬,撒施方式为土壤表面撒施。将将石灰石粉按公式所计算出的量,均匀撒施在改良组样树周围,撒施范围是以样树为中心,半径为5 m的圆形区域。
1.3 数据分析及统计方法
试验数据使用Microsoft Office Excel 2003 (美国微软公司)进行初步整理与分析并制图,使用SAS9.0(美国SAS软件研究所)进行方差分析和成对法t测验。
2 结果与分析
2.1 酸性土壤改良对不同割龄橡胶树细根生物量的影响
图1为不同割龄的胶园石灰石粉改良组和对照组在0~60 cm土壤深度中细根总生物量的测定结果比较。其中,在未开割、开割5 a及开割10 a胶园中,经石灰石粉改良后的橡胶树在0~60 cm土层中的细根总生物量分别为7 120.83、7 507.92和5 033.73 kg/hm2,而对照组细根总生物量分别为4 576.57、5 154.85和3 596.80 kg/hm2。开割5 a胶园的细根总生物量最高,其次是未开割胶园,而开割10 a胶园细根总生物量最低。未开割胶园与开割5 a胶园的总生物量较为接近,且改良组与对照组细根变化规律一致。结果表明,经酸性土壤改良的胶园中橡胶树细根总生物量与对照相比显著增加。
由表1看出,未开割胶园中,经土壤改良橡胶树活细根和死细根生物量为4 809.68和1 574.19 kg/hm2,对照组分别为2 928.89和1 223.72 kg/hm2,死细根生物量占细根总生物量的比例分别为24.66%和29.47%;开割5 a胶园中,经土壤改良橡胶树活细根和死细根生物量为5 443.46和2 108.10 kg/hm2,对照组中为3 918.97和1 252.55 kg/hm2,死细根生物量占细根总生物量的比例为28.08%和24.30%;开割10 a胶园中,经土壤改良橡胶树活细根和死细根生物量分别为3 966.91和1 075.62 kg/hm2,对照组分别为3 596.80和2 660.05 kg/hm2。方差分析结果显示,除了开割5 a胶园中改良组和对照组之间的活细根生物量比较结果达到显著水平,其余胶园改良组和对照组之间相应指标的对比结果均无显著差异。结果表明:虽然3个胶园经土壤改良后,橡胶树细根生物量与对照组相比结果显著增加,但其死、活细根的生物量在总生物量中的比例没有较大的改变。方差分析结果进一步证明,经过土壤改良后,橡胶树细根总生物量增长,但活细根的比例不会明显增加,土壤酸度改良对橡胶树死、活细根的比例没有明显的影响。
2.2 酸性土壤改良对不同割龄橡胶树细根垂直分布的影响
由表2看出,不同割龄橡胶树在垂直剖面上的分布规律基本遵循随土壤深度的增加,细根生物量逐渐减小的规律。未开割、开割5 a及开割10 a 3个胶园中橡胶树细根生物量垂直分布改良组和对照组的最大值均出现在0~10 cm土层中。在0~10 cm土层的改良组与对照组中,未开割胶园细根生物量为2 092.039 kg/hm2和1 531.657kg/hm2,分别占细根总生物量的29.01%和32.29%,开割5 a胶园分别占细根总生物量的27.15%和27.19%,开割10 a胶园分别占细根总生物量的32.64%和33.30%。随着土层深度的不断增加,3个胶园细根生物量呈现出递减的趋势;在50~60 cm土层的改良组与对照组中,未开割胶园细根生物量分别为467.71和340.28 kg/hm2,分别占细根总生物量的6.49和7.17%,开割5 a胶园分别占细根总生物量的5.34%和10.19%,开割10 a胶园分别占细根总生物量的11.93%和9.93%。由表2可以看出,3个胶园细根在0~40 cm土层中细根生物量占细根总生物量均约为80%,为细根生物量的主要分布区域。结果表明:不同割龄的橡胶树细根生物量的垂直分布遵循随土壤深度的增加,细根生物量逐渐减小的规律,土壤改良对橡胶树细根生物量的垂直分布影响不明显。
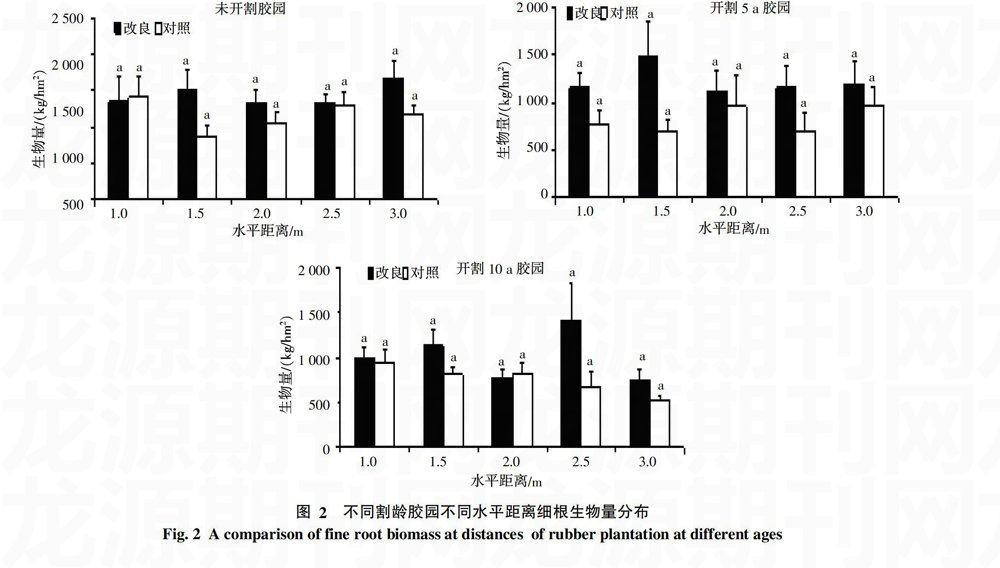
2.3 酸性土壤改良对不同割龄橡胶树细根水平分布的影响
图2表明,经石灰石粉改良后,未开割胶园橡胶树细根生物量在水平分布上的最大值出现在距离树干1.5 m处,其值为1 487.75 kg/hm2,其细根生物量的水平分布距树干离由近及远呈现出先上升,后下降的规律,2.0~3.0 m处细根生物量分布变化趋势不大;对照组细根生物量在水平分布上的2个峰值分别出现在距离树干2.0及3.0 m处。经石灰石粉改良后,开割5 a胶园橡胶树细根生物量的水平分布呈现双峰型变化趋势,2个峰值分别出现在1.5及3.0 m处,其细根生物量分别为1 512.17和1 665.18 kg/hm2;对照组中橡胶树细根生物量的水平分布则呈现出先下降再上升的变化趋势。经石灰石粉改良后,开割10 a胶园细根生物量在水平分布上的第一个高峰出现在距树干1.5 m处,随后下降,之后开始上升,在距树干2.5 m处其值为1 411.58 kg/hm2,之后又有小幅下降。对照组中细根生物量的水平分布呈现出随水平距离的增加而细根生物量下降的趋势,其细根生物量距离树干1.0 m处为最大值,之后,随距离的增加,细根生物量出现了缓慢下降的趋势。3个胶园细根生物量水平分布呈现出不同的规律,改良组及对照组组内与组间的细根生物量的水平分布规律也不相同。结果表明,经酸性土壤改良后,不同割龄胶园细根生物量的水平分布规律各不相同,相同割龄胶园改良组与对照组中细根生物量的水平分布规律也不相同;不同割龄胶园细根生物量的水平分布具有异质性,酸性土壤改良对橡胶树细根生物量的水平分布影响不显著。
2.4 酸性土壤改良对不同割龄橡胶树细根总生物量季节变化的影响
由图3可知,未开割、开割5 a及开割10 a 3个胶园橡胶树细根总生物量具有明显的季节动态变化规律,其改良组与对照组的变化规律具有很好的一致性。未开割及开割10 a胶园细根总生物量季节变化均呈现单峰型变化趋势,而开割5 a胶园呈现双峰型变化趋势。未开割胶园改良组与对照组细根总生物量最小值均出现在2012年3月,分别为3 849.47和2 341.29 kg/hm2;2012年3月至7月,细根总生物量呈现快速增长趋势,至7月,细根总生物量达到最高峰,之后,细根总生物量呈现下降趋势,改良组细根总生物量在2012年7月至9月间呈现较为明显下降趋势。对照组细根总生物量从2012年7月至2013年1月呈现缓慢下降趋势。开割5 a胶园改良组与对照组细根总生物量季节变化均出现两个峰值,分别为2012年7月与2013年1月,两个最低值分别出现在2012年3月与2013年11月。开割10 a胶园细根总生物量季节变化也呈现单峰型分布,改良组细根总生物量最高峰出现在2012年9月,而对照组最高值虽然出在2012年9月,但其在2012年11月的细根总生物量为4 546.75 kg/hm2,两者非常接近。由表3可知,3个胶园改良组和对照组细根生物量与变化t测验Pr>|t|值均<0.05,表明不同割龄胶园中改良组与对照组在细根月变化上结果有显著差异。结果表明,不同割龄细根总生物量具有明显的季节变化趋势。经酸性土壤改良后,不同割龄细根总生物量季节变化规律与其相应的对照组变化规律一致,土壤酸化改良对橡胶树细根总生物量的季节变化趋势无明显影响。
3 讨论与结论
在本研究中,对未开割(树龄7 a)、开割5 a(树龄12 a)、开割10 a(树龄17 a)3个胶园橡胶树进行酸性土壤改良处理,改良组与对照组的橡胶树细根生物量分布出现以下变化,即开割5 a胶园的细根总生物量最高,其次是未开割胶园,而开割10年胶园细根总生物量最低。通常,细根生长会根据立地条件的不同而不同,在较为贫瘠的土地上,细根生物量在与郁闭前生长缓慢,直至郁闭后保持较高水平;在条件较好的土地上,细根在郁闭前会快速生长,郁闭后调整为相对较低的水平[11]。张立华等[12]通过研究不同树龄的木麻黄人工林后认为,细根生物量与树龄有一定的相关性,活细根生物量随树龄的趋势为先上升后下降,树龄为30 a的木麻黄其活细根生物量为最大,之后随着树龄的增大,活细根生物量反而减小。据林希昊[13]对不同树龄橡胶树细根差异量的研究结果认为,5 a生橡胶树的细根生物量为最大,其次是9年生橡胶树,而16年生橡胶树的细根生物量最小。橡胶树与其它树种相比具有一定的特殊性,割胶后胶乳的排除,会导致橡胶树细根所分配到的光合产物量的减少,对橡胶树细根生长产生一定的影响[14]。Finer等[15]研究欧洲山毛榉后发现,其细根在酸性土壤中的细根生物量多于中性土壤,可能是因为树木为了吸收更多的土壤中的养分,导致细根生长量增高。但多个研究表明,通过对酸性土壤的改良,会使植物的生物量发生显著的变化,细根生物量提高[16-18]。本研究结果显示,酸性土壤改良后,橡胶树细根生物量增加,与前人研究结果相同。这可能与改良后的土壤酸度更适合细根生长有关。
树木细根的垂直分布具有明显的规律性,一般情况下,细根主要分布在土壤表层附近,会随土壤深度的增加而减少[19]。浅根性树种大部分根系位于0~50 cm土层中,并且多集中于枯枝落叶层和10 cm以上矿质土壤表层[7]。本研究结果显示,50%的细根生物量分布在0~20 cm深度的土层中,50~60 cm深度的土层中,细根生物量所占总生物量的比例最小,细根垂直分布具有明显的递减趋势。导致细根垂直分布规律的原因可能与土壤养分及水分有关,除此之外,植物根系分布还受到本身遗传特性的影响[20]。赵忠等[21]研究发现,土壤水分与橡胶树细根的垂直分布就有明显的相关性。Leuschner等[22]对欧洲山毛榉细根分布状况的研究也表明,细根的垂直分布会受到土壤养分和水分的影响,表层土壤养分和水分状况均好于更深层次的土层。用微根管法观测柠条的垂直分布,根长密度会随着土壤深度的增加而减少,可能是由于土壤水分的变化导致[23-24]。产胶对橡胶树细根垂直分布有一定的影响,橡胶树25%以上的细根分布在0~10 cm土层中,在0~60 cm土层中细根生物量的分布随树龄及土壤深度的增加而减少[4]。有研究显示,酸性土壤改良后,每层土壤中的细根生物量增加,但对细根垂直分布规律无明显影响[25],这与本研究结果类似。
细根的水平分布与树龄、树木冠幅及土壤条件有一定的相关性,橡胶树根幅可达冠幅的1.5~2.0倍[3]。甘卓亭等[26]通过对不同树龄的苹果树细根水平分布的研究发现,3龄苹果树的细根主要分布在水平距离1.5 m内,更大树龄的苹果树的细根水平分布距离超过2.0 m。张志山等[23]发现,柠条细根在水平方向上的分布遵循先上升后下降的趋势,主要是受到了土壤条件的影响;而也有研究显示,柠条在在距离植株20~100 cm距离内,根系分布较为均匀,有缓慢增加的趋势[24]。本研究发现,未开割、开割5 a和开割10 a 3个胶园橡胶树细根的水平分布具有异质性,总体分布较为均匀,具有先升高后降低的趋势。水平位置的分布主要受水平位置上土壤的空间异质性影响,林木树冠及树木之间的林隙造成的水分、温度等因素的异质性所致[23]。老龄橡胶树冠幅水平距离较幼龄橡胶树冠幅水平距离远,导致光线和水热条件分布的不同,使得1.0~1.5和2.5~3.0 m这2个距离内的细根分布出现不同,1.0~1.5 m范围内的细根多于2.5~3.0 m内的细根[13]。
本研究表明,橡胶树细根年变化为单峰型,未开割和开割5 a橡胶树细根生长的高峰出现在7月,而开割10 a的橡胶树细根的生长高峰出现在9月,酸性土壤改良对橡胶树细根年变化中峰值出现时间无影响,但使细根的生长量增加。Zewdie等[27]认为,细根在不同季节内,为适应环境的改变,细根的生长分布发生改变,使细根的生长分布出现季节性变化。通常细根在一年中会出现1~2个生长高峰,峰值出现时间受到树种、气候、土壤条件的影响而不同[7,19,28]。此外,真菌、病原菌和土壤植食性动物也是影响细根生长动态的因素[23]。房秋兰[7]对西双版纳橡胶树细根的动态特征进行了研究后发现,活细根生长在5月达到最大值,11月为最小值。不同树龄的橡胶树细根的年动态有所不同,虽然细根的生长规律均为双峰型,但5年生和9年生橡胶树2个细根的生长高峰分别出现在4月及8月,4月为小峰,8月为大峰,而16年生橡胶树细根的生长高峰出现在6月与10月[13]。本研究结果与前人研究结果具有相似之处,细根生长的最高值出现时间接近,海南4~10月气温高、降水较多,从4月开始橡胶树细根的成长加速,直至7~8月生长速率达到顶峰,开割10 a胶园的到达峰值时间相对滞后;本试验在采样方法与时间与前人研究略有不同,除此之外,土壤养分及气候因素的影响,可能也是导致峰值出现时间不同的原因。
参考文献
[1] Olesinski J, Lavigne M B, Kershaw Jr J A, et al. Fine-root dynamics change during stand development and in response to thinning in balsam fir(Abies balsamea L. Mill.)forests[J]. Forest Ecology and Management, 2012, 286: 48-58.
[2] Majdi H. Changes in fine root production and longevity in relation to water and nutrient availabity in a Norway spruce stand in northern Sweden[J]. Tree Physiology, 2001, 21(14): 1 057-1 061.
[3] 华南亚热带作物科学研究所橡胶栽培生态组. 华南热带作物科学研究所档案室.橡胶树根系研究1959-1963年工作总结[Z]. 1965.
[4]林希昊, 王真辉, 陈秋波, 等. 不同树龄橡胶林土壤养分变化特征及对细根的影响[J]. 热带作物学报, 2009, 30(8): 1 094-1 098.
[5]林希昊, 王真辉, 陈秋波, 等. 不同树龄橡胶(Hevea brasiliensis)林细根生物量的垂直分布和年内动态[J]. 生态学报, 2008, 28(9): 4 128-4 135.
[6] 林希昊, 陈秋波, 华元刚, 等. 不同树龄橡胶林土壤水分与细根生物量[J]. 应用生态学报, 2011, 22(2): 331-336.
[7] 房秋兰, 沙丽清. 西双版纳橡胶林细根生物量及其周转[J]. 中南林学院学报, 2005(5): 41-44.
[8] Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5 968): 1 008-1 010.
[9]Jentschke G, Drexhage M, Fritz H W, et al. Does soil acidity reduce subsoil rooting in 40-year-old Norway spruce(Picea abies)?[J]. Plant Soil, 2001, 237(1): 91-108.
[10] Godbold D L, Fritz H W, Jentschke G, et al. Root turnover and root necromass accumulation of Norway spruce(Picea abies)are affected by soil acidity[J]. Tree Physiology, 2003, 23(13): 915-921.
[11] Vogt K A, Vogt D J, Palmiotto P A, et al. Review of root dynamics in forest ecosystems grouped by climate, climatic forest type and species[J]. Plant and soil, 1995, 187(2): 159-219.
[12] 张立华. 海岸沙地木麻黄人工林细根生态学研究[D]. 福州: 福建农林大学, 2006.
[13] 林希昊. 土壤环境因子对不同树龄橡胶林细根分布与年内动态的影响[D]. 海口: 海南大学, 2008.
[14] 何 康, 黄宗道. 热带北缘橡胶栽培[M]. 广州:广东科技出版社, 1987.
[15] Finér L, Helmisaari H S, Lohmus K, et al. Variation in fine root biomass of three European tree species: Beech(Fagus sylvatica L.), Norway spruce(Picea abies L. Karst.), and Scots pine(Pinus sylvestris L.)[J]. Plant Biosystems, 2007, 141(3): 394-405.
[16] 杨永森, 段 雷, 靳 腾, 等. 石灰石和菱镁矿对酸化森林土壤修复作用的研究[J]. 环境科学, 2006, 27(9): 1 878-1 883.
[17] 孟赐福, 傅庆林. 施石灰石粉后红壤化学性质的变化[J]. 土壤学报, 1995, 32(3): 300-307.
[18] Richter A, Hajdas I, Frossard E, et al. Soil acidity affects fine root turnover of European beech[J]. Plant Biosystems-An International Journal Dealing with all Aspects of Plant Biology, 2012: 1-10.
[19] Lukac M, Godbold D L. Fine root biomass and turnover in southern taiga estimated by root inclusion nets[J]. Plant and Soil, 2010, 331(1-2): 505-513.
[20] Norby R J, Ledford J, Reilly C D, et al. Fine-root production dominates response of a deciduous forest to atmospheric CO2 enrichment[J]. PNAS, 2004, 101(26): 9 689-9 693.
[21]赵 忠, 李 鹏. 渭北黄土高原主要造林树种根系分布特征及抗旱性研究[J]. 水土保持学报, 2002, 16(1): 96-99
[22] Leuschner C, Hertel D, Schmid I, et al. Stand fine root biomass and fine root morphology in old-growth beech forests as a function of precipitation and soil fertility[J]. Plant and Soil, 2004, 258(1): 43-56.
[23]张志山, 李新荣, 张景光, 等. 用 Minirhizotrons观测柠条根系生长动态[J]. 植物生态学报, 2006, 30(3): 457-464.
[24] 史建伟, 王孟本, 陈建文, 等. 柠条细根的空间分布特征及其季节动态[J]. 生态学报, 2011, 31(3): 726-733.
[25] 潘 伟. 重庆铁山坪的森林健康及石灰改良作用[D]. 重庆: 西南大学硕士论文, 2008.
[26] 甘卓亭, 刘文兆. 渭北旱塬不同龄苹果细根空间分布特征[J]. 生态学报, 2008, 28(7): 3 401-3 407.
[27] Zewdie S, Fetene M, Olsson M. Fine root vertical distribution and temporal dynamics in mature stands of two enset(Enset ventricosum Welw Cheesman)clones[J]. Plant and Soil, 2008, 305(1-2): 227-236.
[28] Tufekcioglu A, Raich J, Isenhart T, et al. Fine root dynamics, coarse root biomass, root distribution, and soil respiration in a multispecies riparian buffer in Central Iowa, USA[J]. Agroforestry Systems, 1998, 44(2-3): 163-174.