多花水仙HDS基因cDNA全长克隆与序列分析
吴用 何炎森 李科 申艳红 李欢 陈晓静


摘 要 以‘黄花水仙2号和‘金盏银台为材料,水仙各自花瓣的cDNA为模板,采用RT-PCR和RACE技术克隆出2个HDS基因,分别命名为NtHDSY和NtHDSJ,测序结果表明,NtHDSY和NtHDSJ基因全长分别为2 592 bp和2 599 bp,2个基因均含有1个2 178 bp的开放阅读框(ORF),编码745个氨基酸。同源性分析表明,黄花水仙2号与金盏银台、铁皮石斛、长春花、大豆、葡萄和苹果的相似系数分别为:97.77%、79.29%、75.29%、75.51%、75.02%和74.40%。Real-time PCR分析表明:NtHDS基因在花瓣和副冠内的表达量在开花过程的花蕾期与盛花期存在明显差异,推测该基因可能与多花水仙香气物质的合成有关。
关键词 多花水仙;HDS基因;MEP途径;基因克隆;序列分析
中图分类号 S682.21 文献标识码 A
Cloning and Expression Analysis of HDS
Gene from Narcissus tazetta var
WU Yong1, HE Yansen1,3, LI Ke1,2, SHEN Yanhong1,2,
LI Huan1,2, CHEN Xiaojing1,2*
1 College of Horticulture,Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002,China
2 Institute of Genetics and Breeding in Horticuhural Plants,FAFU, Fuzhou, Fujian 350002,China
3 Mintai Horticulture Research Center, Fujian Academy of Agricultural Sciences, Zhangzhou,Fujian 363005, China
Abstract HDS is one of the important enzymes in the pathway of plant MEP. In this study, Huanghua Ⅱ and Jinzhanyintai were used as the experimental materials.The specific primers were designed according to the cloned HDS gene fragment and EST sequences. Two genes, named NtHDSY and NtHDSJ, were isolated from N. tazetta var by RACE and RT-PCR, and the fragments was about 2 592 and 2 599 bp, respectively. The open reading frame was 2 178 bp, encoding a polypeptide of 745 amino acids. Sequence analysis showed that the amino acid sequence of Huanghua Ⅱ shared 97.77%, 79.29%, 75.29%, 75.51%, 75.02% and 74.40% homologous with Jinzhanyintai, Dendrobium officinale, Catharanthus roseus, Glycine max, Vitis vinifera and Malus domestica,respectively. The real time RT-PCR showed that the transcription expression of HDS gene changed accordingly during flower blooming and flower organs, indicating that the possible role of HDS gene in the synthesis of aroma substances.
Key words Narcissus tazetta var; HDS gen; MEP pathway; Gene cloning; Sequence analysis
doi 10.3969/j.issn.1000-2561.2015.10.017
花香是一系列低分子量、挥发性物质组成的复杂混合物,由花朵释放来吸引和引导授粉的昆虫[1],是园艺观赏植物品质评价的一个重要指标,花香的合成是多种酶基因共同作用的结果。一般来说,花香物质可分为萜类、苯基/苯丙烷基类和脂肪酸衍生物3大类[2]。萜类在所有生物体内都有发现,然而在植物中尤其丰富多样[3-4]。在多花水仙挥发性成分中,萜类物质所占的比例最多[5]。随着生物技术研究的不断深入,利用基因工程手段改良植物香气物质的组成和含量已成为可能。
大部分的萜类化合物是由前体异戊烯基焦磷酸(isopentenyl diphosphate, IPP)碳骨架的五碳结构单元通过单萜或倍半萜合成酶的作用合成[6]。IPP合成的途径有2条,分别是位于细胞质中的甲羟戊酸(mevalonic acid, MVA)途径和位于质体中的甲基-D-赤藓糖醇-4-磷酸(methyl-D-eryth-ritol-4-phosphate, MEP)途径[7-8]。其中MEP 途径是一条高等植物合成萜类次生代谢产物的重要代谢途径(图1)[9],该途径是以3-磷酸甘油醛与丙酮酸为前体物质,通过7步不同的酶促反应生成萜类化合物的5碳单元前体IPP和二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)。HDS是MEP途径中第6步催化反应的酶,属于GCPE 蛋白家族, 定位在质体中,可催化2-C-甲基赤藓醇-2,4-环焦磷酸(2-C-methy1-D-erythrito1 2,4-cyclodiphosphate,ME-cPP)生成羟基甲基丁烯基-4-磷酸(1-hydroxy-2-methy1-2-(E)-butenyl 4-diphosphate,HMBPP),HMBPP继续在羟基甲基丁烯基-4-磷酸还原酶(1-hydroxy-2-methyl-2-(E)-butenyl 4-diphosphate reductase,HDR)的催化下生成IPP和DMAPP,IPP和DMAPP后经异戊烯基转移酶类的延伸反应以及萜类合酶的修饰作用,合成种类繁多且功能各异的萜类化合物[10-11]。因此,HDS既是萜类物质前体IPP合成的关键酶,也是单萜和双萜类芳香物质、类胡萝卜素、VE和叶绿素等重要物质合成的关键调控位点[12]。目前,高等植物中对HDS基因开展的研究不多,仅从可可、番茄、铁皮石斛、长春花、甜菊、杜仲、苹果、黄花蒿等10多种植物中克隆出HDS基因cDNA全长序列,对基因功能的研究仅局限于少数模式植物[13-14]。为此,本研究以多花水仙为材料,根据本课题组构建的多花水仙花瓣抑制消减杂交cDNA文库获得的EST序列设计特异引物,利用RT-PCR和RACE技术克隆出水仙HDS基因全长,并对其进行生物信息学分析,为后续利用多花水仙的HDS基因改良其它植物花香的转基因研究以及深入分析多花水仙MEP代谢途径的分子机制提供一定的参考。
1 材料与方法
1.1 材料
实验材料为多花水仙的2个品种,分别是取自漳州水仙生产基地的‘金盏银台和种植于福建农林大学园艺植物遗传育种研究所的‘黄花水仙2号。‘金盏银台副冠橙黄色,花瓣白色;‘黄花水仙2号副冠和花瓣均为黄色,而副冠颜色较浅。分别取花蕾期和盛花期2个时期的水仙花朵的副冠和花瓣,液氮速冻后置于-80 ℃下储藏备用。
1.2 方法
1.2.1 总RNA的提取与反转录 使用多糖多酚植物总RNA快速提取试剂盒(购自北京白泰克生物有限公司),按照说明书要求分别提取‘金盏银台和‘黄花水仙2号副冠和花瓣总RNA。3′-RACE模板按照Revert AidTM First Strand cDNA Synthesis Kit试剂盒说明书(购自Fermenta)进行逆转录。5′-RACE模板按照Super SMARTerTM RACE cDNA Amplification Kit试剂盒说明书(购自Contech公司)进行逆转录。按照SYBRPrime Script RT-PCR Kit(Perfect RealTime)试剂盒说明书(购自TaKaRa)逆转录的cDNA用于qRT-PCR。
1.2.2 ‘黄花水仙2号HDS全长cDNA的克隆 根据差减文库获得的基因片段设计RACE引物(表1),引物合成与测序分别委托北京六合华大基因科技股份有限公司和上海博尚生物科技股份有限公司。
以‘黄花水仙2号的cDNA为模板,分别进行5′-RACE和3′-RACE的扩增。PCR扩增反应条件:9 ℃预变性5 min;94 ℃变性30 s,50~58 ℃退火30 s,72 ℃延伸2 min,35循环;72 ℃延伸10 min。5′端序列的克隆:以HDS5′-1和UPM为引物进行第一轮扩增,将第一轮反应产物稀释10倍作为模板,以HDS5′-2和UPM作为引物扩增第二轮。3′端序列的克隆:以HDS3′-1和AUAP为引物进行第一轮扩增,将第一轮产物扩增10倍做为模板,以HDS3′-2和AUAP为模板进行第二轮扩增。
1.2.3 ‘黄花水仙2号与‘金盏银台ORF的克隆 通过DNAMAN软件对已知的HDS片段序列和克隆得到的3′和5′端序列进行拼接,并在DNAMAN软件对其ORF进行预测。再根据ORF两端序列设计特异性上下游引物HDS-U和HDS-A,对‘黄花水仙2号和‘金盏银台的编码区序列进行扩增,退火温度为55 ℃。通过凝胶电泳回收目的片段,与PGEM载体连接并转化DH5α(Escherichia coli.),经菌液鉴定后送往博尚生物科技股份有限公司进行测序。
1.2.4 序列分析 氨基酸多重序列比对和CDD功能区域分析使用NCBI中的BLASTX(http://blast.ncbi.nlm. nih.gov/Blast.cgi);氨基酸理化分析使用ExPASy-ProtParam tool(http://web.expasy.org/protparam);构建系统进化树使用MEGA5.05中的邻近相法neighbor-joining tree;氨基酸序列信号肽预测使用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP);氨基酸序列跨膜预测使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/);亚细胞定位使用softberry(http://linux1.softberry.com/berry.phtml)。
1.2.5 ‘黄花水仙2号和‘金盏银台qRT-PCR分析 以Actin作为内参基因,2种水仙的cDNA模板均稀释5倍,HDSY-L和HDSY-R为上下游引物来检测HDSY基因在2种水仙中不同时期的转录水平。使用25 μL qRT-PCR反应体系:SYBR Premix Ex TaqTM(2×)12.5 μL,PCR Forward Primer(10 μmol/L)0.5 μL,PCR Reverse Primer(10 μmol/L)0.5 μL,cDNA 2.0 μL,ddH2O 9.5 μL,每个样品设置3次重复。qRT-PCR程序为:Stage1:预变性,94 ℃,3 min;Stage2: PCR反应,94 ℃变性15 s;56 ℃退火35 s,40循环。Stage3:Dissociation。反应结束后,分析Bio-Rad CFX96中的熔解曲线和扩增曲线,导出数据。从不同时期的相关基因扩增曲线中得到Ct值,通过action的校正最终得到目的基因的相对表达量。
1.3 数据处理
采用2-△△ct(Livak)法,用Excel软件处理和分析数据。
2 结果与分析
2.1 多花水仙HDS基因cDNA全长克隆
以提取的‘黄花水仙2号总RNA反转录获得的cDNA为模板进行PCR扩增,经电泳后发现,5′RACE和3′RACE均获得约800 bp的片段(图2)。经过测序并将结果同其原始已知HDS序列进行拼接,得到长度为2 483 bp的基因片段,通过BLAST程序检索,发现该序列与葡萄(登录号:XP 002285130.1)、长春花(登录号: AAO24774.1)和铁皮石斛(登录号: AHN91473.1)的HDS基因mRNA序列的同源性分别达到68.64%、66.48%和71.16%,可初步确定该基因片段为‘黄花水仙2号的HDS基因片段。
2.2 ‘黄花水仙2号和‘金盏银台HDS基因ORF的克隆与分析
根据上述拼接的‘黄花水仙2号cDNA全长,分别设计用于基因3′RACE和5′RACE序列扩增的特异引物(HDS-U, HDS-A),对‘黄花水仙2号和‘金盏银台水仙HDS基因全长cDNA进行PCR扩增,分别扩增出2 592 bp和2 599 bp大小的条带。测序结果表明,‘黄花水仙2号ORF为2 238 bp,编码745个氨基酸;金盏银台ORF为2 238 bp,编码745个氨基酸。‘黄花水仙2号和‘金盏银台的HDS基因分别命名为NtHDS40Y(登录号: KM593243)和NtHDS40J(登录号:KM593244)。
2.3 多花水仙HDS基因的生物信息学分析
利用ExPASy-ProtParam推测2种水仙HDS蛋白,蛋白分子量、等电点、分子式、GRAVY(Grand average of hydropathicity)值、不稳定指数(表2)等基本理化性质,2种水仙的HDS蛋白均属于稳定蛋白。经TMHMM2.0预测,2种类型水仙的HDS蛋白跨膜螺旋数均为0,不形成跨膜区域,均不是跨膜蛋白。经SignalP4.1预测,2种类型水仙的HDS蛋白均无信号肽,故为非分泌蛋白。经Softberry在线工具分析,亚细胞均定位于膜结合叶绿体中。经NCBI-CDS在线分析,推测此蛋白属于GcpE Superfamily的成员。
根据开放阅读框推导的氨基酸进行同源序列比对分析(图3), ‘黄花水仙2号与铁皮石斛(Dendrobium officinale)、 长春花(Catharanthusroseus)、 大豆(Glycine max)、 葡萄(Vitis vinifera)、 苹果(Malus domestica)的相似性分别为: 85.66%、 84.97%、 84.70%、 84.03%和82.01%。说明这个基因的保守性较高,‘黄花水仙2号与‘金盏银台也存在一定的氨基酸差异,相似性为97.32%。
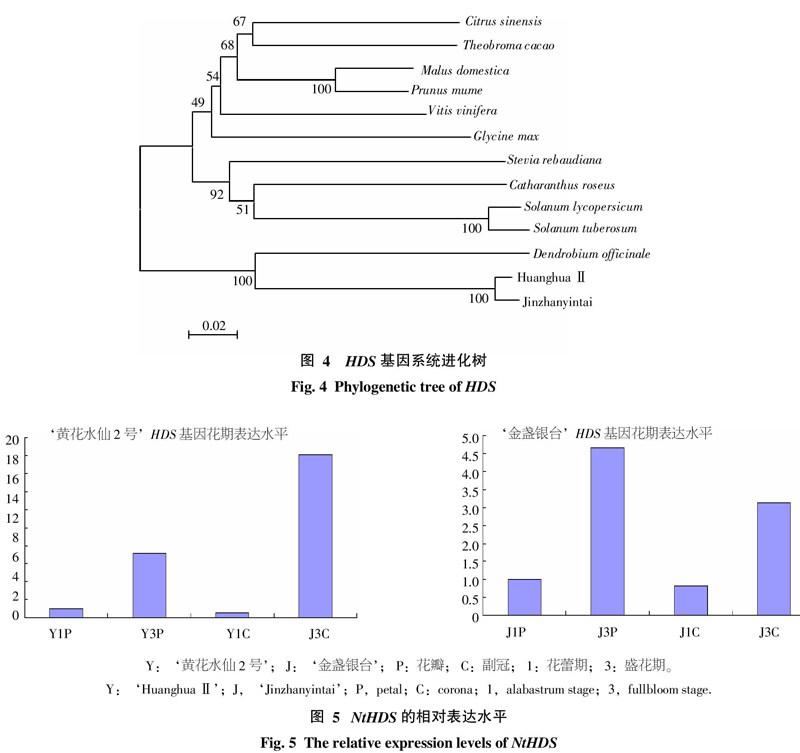
为了研究HDS的进化关系,用MEGA5.05软件构建了HDS的系统进化树(图4),分析表明,‘黄花水仙2号与‘金盏银台处于同一分支上,与‘黄花水仙2号进化距离比较远的是双子叶植物甜橙、可可、苹果、梅和葡萄,与单子叶植物铁皮石斛进化最为相近,马铃薯和番茄同属于茄科,因此它们处在进化树同一分支上。总体上来看,进化树基本上与植物分类学相一致。
2.4 多花水仙HDS基因在不同发育期的表达分析
根据实时荧光定量PCR扩增获得的扩增曲线和相关数据,制得‘黄花水仙2号和‘金盏银台花瓣与副冠在不同时期HDS基因的表达水平统计图(图5)。分析表明,NtHDSY和NtHDSJ的表达水平在花瓣(P)和副冠(C)上的变化趋势类似,在花蕾期向盛花期转变过程中,花瓣和副冠中的HDS表达水平均呈上升趋势。可能是由于NtHDS是花香的主要成分萜类物质合成途径中的重要酶类基因,表达水平的高低可能与花香物质的合成量多少有关。在花蕾期,花瓣没有绽放,无明显香味,NtHDS表达量相对偏低;而在盛花期,花瓣绽放,花香浓郁,NtHDS的表达量也较高。
3 讨论与结论
HDS是植物萜类物质合成MEP途径中催化第六步反应所需的酶,该途径产生的萜类吲哚生物碱(TIAs)是类异戊二烯生物合成的前体物质, 因此HDS被认为是类异戊二烯生物合成途径中代谢纽带的一个理想的目标基因[15]。本研究分离并且描述了2种多花水仙中的HDS基因。依据生物信息学的方法,对多花水仙HDS基因进行多角度的分析结果表明:HDS基因编码的蛋白质无跨膜结构。从不同植物HDS基因编码氨基酸序列进行同源性比对的结果可知,不同植物HDS基因序列存在一定的差异性,包括同属水仙属的‘黄花水仙2号和‘金盏银台之间,也存在2.68%的差异性,但从总体上来看,不同植物间HDS基因序列的保守性较高;基于不同植物HDS基因编码氨基酸序列的进化树上分析可知,不同植物HDS蛋白的功能在进化上是较为保守的,2个品种水仙在进化上处于同一分支上,而与2种水仙在进化上更为相近的是单子叶植物而不是双子叶植物,同属茄科的番茄和马铃薯在进化树上也处于同一分支,这些均与植物分类学一致。
多花水仙开花过程中香味的变化较为明显。在花蕾期,香气物质合成水平较低,花瓣包裹较为严密,无明显香味,此时不需要昆虫授粉;而在盛花期,香气物质合成水平相对较高,花瓣展开,柱头分泌粘液,花药散出花粉,花香浓郁,大量香气物质的释放会吸引授粉的昆虫,这一时期正是授粉的最佳时期。本研究结果显示,HDS的转录水平在开花过程中花蕾期和盛花期呈明显的时序性。盛花期HDS基因无论是在花瓣还是副冠中,它的表达量都明显高于花蕾期,这与花香物质的合成是一致的。由于盛花期,植物需要合成更多的香气物质去吸引昆虫前来授粉,异花授粉产生的植物多样性有利于生物对环境的适应,从而来保证后代遗传的多样性和稳定性,盛花期花香物质的大量合成是多花水仙与授粉昆虫协同进化的结果。
目前,高等植物中对HDS基因开展的研究不多,对于基因功能的研究局限于少数模式植物[16-18],尚未涉及有关多花水仙HDS基因的报道。水仙是中国十大名花之一,也是福建省的省花,具有非常高的观赏价值,因此克隆出多花水仙萜类代谢途径中的HDS基因具有很好的应用前景。一方面扩充了多花水仙的基因库,可以给植物花香相关的转基因研究直接提供目的基因,另一方面能够对多花水仙MEP途径分子机制的深入研究奠定基础。茉莉酸甲酯(MeJA)和紫外(UV)可使得MEP途径中HDS上游的一个酶基因MECs的表达上调,被称为诱导子,然而包含茉莉酸甲酯(MeJA),紫外(UV), 脱落酸(ABA)和丙烯腈(ASA)在内的诱导子对于HDS基因的表达均无直接响。因此,需进一步研究能够使HDS表达上调的诱导子,再利用基因工程的手段,以期增加TIAs的产量,有效地改良植物花香,更好的诱导昆虫前来授粉,从而保证了植物群体遗传的多样性和稳定性,提高园艺植物观赏价值,同时对植物花香精油产业的发展有一定推动作用。
参考文献
[1] 张 强, 田彦彦, 孟月娥, 等. 植物花香基因工程研究进展[J]. 基因组学与应用生物学, 2009, 28(1): 159-166.
[2] Campbell T L,Brown E D. Characterization of he depletion of 2-C-Methyl-D-Erythritol-2,4-Cyclodiphosphate synthase in Escherichia coli and Bacillus subtilis[J]. Bacteriol, 2002, 184:5 609-5 618.
[3] Chappell J. Biochemistry and molecular biology of the isoprenoid biosynthetic pathway in plants[J]. Ann Rev Plant Physiol Plant Mol Biol, 1995, 46: 521-547.
[4] McGravey D J, Croteau T. Terpene metabolism[J]. Plant cell,1995, 7: 1 015-1 026.
[5] Kuzuyama T, Seto H. Diversity of the biosynthesis of the isoprene units[J]. Nat Prod Rep, 2003, 20: 171-183.
[6] Rodriguez-Concepcio'N M, Querol J, Lois L M, et al. Bioinformatic and molecular analysis of hydroxymethylbuteny1 diphosphate synthase (GCPE) gene expression during carotenoid accumulation in ripening tomato fruit[J]. Planta, 2003, 217:476-482.
[7] Liao Z, Chen M, Gong Y, et al. A new geranylgerany1 diphosphate synthase gene from Ginkgo biloba, which intermediates the biosynthesis of the key precursor for ginkgolides[J]. DNA Seq, 2004, 15: 153-158.
[8] Chappell J. Biochemistry and molecular biology of the isoprenoid biosynthetic pathway in plants[J]. Ann Rev Plant Physiol Plant Mol Biol, 1995, 46: 521-547.
[9] Yue Zheng, Min Chen, Chunxian Yang, et al. Cloning and characterization of MECS and HDS genes from Rauvolfia verticillata[J]. Plant Omics, 2011, 4(2): 82-92.
[10] Dudareva N, Andersson S, orlova I, et al. The nonmenalonate pathway supports monoterpene and Sequiterpene formation in snapdragon flowers[J]. Pore Nat1 Acad Sci USA, 2005, 102(3): 933-938.
[11] 姜 丹, 荣齐仙, 袁庆军, 等. 白花丹参HDS基因的全长克隆与原核表达分析[J]. 药学学报, 2014, 11: 27.
[12] Pichersky D N. Biochemistry and molecular aspects of floral scent[J]. Plant Physiol, 2000, 122: 627-634.
[13] Gil M J, Coego A, Mauch-Mani B, et al. The Arabidopsis csb3 mutant reveals a regulatory link between salicylic acid-mediated disease resistance and the methyl-erythritol 4-phosphate pathway[J]. Plant, 2005, 44: 155-166.
[14] Kim S M, Kim S U. Characterization of 1-hydroxy-2-methyl-2-(E)-butenyl-4-diphosphate synthase(HDS)gene from Ginkgo biloba[J]. Mol Biol Rep, 2010, 37: 973-979.
[15] Altincicek B, Duin E C, Reichenberg A et al. LytB protein catalyzes the terminal step of the 2-Cmethyl-D-erythritol-4-phosphate pathway of isoprenoid biosynthesis[J]. FEBS Lett,2002, 532: 437-440.
[16] Manuel R C, Jordi Q, Luisa M L, et al. Bioinformatic and molecular analysis of hydroxymethylbutenyl diphosphate synthase (GCPE) gene expression during carotenoid accumulation in ripening tomato fruit[J]. Planta, 2003, 217:476.
[17] Sang Min K. Soo Un K. Characterization of 1-hydroxy-2-methyl-2-(E)-butenyl-4-diphosphate synthase (HDS) gene from Ginkgo biloba[J]. Mol Biol Rep, 2010, 37: 973-979.
[18] Jordi Q, Narciso C, Santiago I, et al. Functional analysis of the Arabidopsis thaliana GCPE protein involved in plastid isoprenoid biosynthesis[J]. FEBS Lett, 2002, 514: 343-346.

