肉桂油微乳在模拟人工肠液中的释药特性研究*
易 醒, 谭潇啸, 肖小年, 李 莉
(1.南昌大学 中德联合研究院,江西 南昌 330047;2.南昌大学 中德食品工程中心,江西 南昌 330047)
肉桂油微乳在模拟人工肠液中的释药特性研究*
易 醒2*, 谭潇啸1, 肖小年1, 李 莉2
(1.南昌大学 中德联合研究院,江西 南昌 330047;2.南昌大学 中德食品工程中心,江西 南昌 330047)
为研究肉桂油微乳在模拟人工肠液中的释药情况,并建立其释药动力学模型.采取模拟人工肠液的方法,以正相透析扩散法进行肉桂油微乳的体外释药实验,利用HPLC法测定肉桂醛的含量,检测微乳在体外模拟肠液中的释放情况.结果表明,随着取样时间的增加,肉桂醛的累积释放量和累积释放百分数都逐渐增高,肉桂油微乳释放到人工肠液中的浓度逐渐升高.肉桂油微乳在pH值为6.8的人工肠液中的释放模型符合Retger-peppas方程(Q=18.867 91t0.481 93,R2=0.939 87).
肉桂油; 微乳; 肉桂醛; 正相透析扩散; 释药特性
肉桂油是樟科樟属植物肉桂(CinnamomumCassiaPresl)的干燥枝、叶经水蒸气蒸馏提取的挥发油,可作香料.肉桂皮含有1%~2%挥发油,为黄棕色的澄清液体;有肉桂的特异香气,味甜、辛辣.肉桂油的主要活性成分是肉桂醛,肉桂醛具有解热、抗菌、消炎、利胆、镇静、镇痛、降血糖、降血压、抗肿瘤、抗惊厥和增强肠胃蠕动、抑制黄嘌呤氧化酶活性等作用[1~6].目前国内外的研究表明,肉桂油对人体免疫功能、消化系统、血液和心血管系统均有积极影响,除此之外还具有抗菌、降血糖、抗肿瘤、抗氧化、阵痛、平喘等作用.肉桂油易溶于乙醇和冰醋酸,肉桂醛在强酸性或者强碱性介质中不稳定,易导致变色,在空气中易氧化,并且极易挥发,这对肉桂油应用有一定的限制.微乳是由表面活性剂、助表面活性剂、油、水组成的均一体系.近些年,微乳制剂已广泛应用于天然产物及中药口服制剂的开发利用中,口服微乳可增加疏水性营养物质的溶解度,促进营养物质吸收,提高生物利用度.将肉桂油制成微乳制剂,能提高其疗效、稳定性及生物利用度,更加利于肉桂油的综合开发利用.本文着重考察了肉桂油微乳在模拟人工肠液中的释放特性,并初步探讨其释药动力学模型,为肉桂油口服微乳的生产开发和进一步研究提供依据.
1 主要仪器与试剂
Agilent1200高效液相色谱仪、HYQ-2121A型涡旋混匀器(上海精密科学仪器有限公司)、TGL-12C型台式高速离心机(上海菲恰尔分析仪器有限公司)、ZHWY-2102C型恒温培养振荡器(上海智城分析仪器制造有限公司)、0.45 μm微孔膜、电子天平、透射电镜、透析袋(分子量7 000~14 000、36DM/44mm)、B-260型恒温水浴锅(上海亚荣生化仪器厂).
肉桂油(购于广州和博香料有限公司)、Tween80、氢氧化钠、胰酶、肉桂醛标准品(购于北京恒元天启研究所)、甲醇(色谱纯)、磷酸、乙腈(色谱纯)、聚氧乙烯蓖麻油(CremopHor EL-40)、磷酸二氢钾、无水乙醇、十六酸异丙酯(IPP)、蒸馏水(自制)、超纯水(自制)、无水硫酸钠,其他试剂均为实验室常用试剂.
2 实验方法与结果
2.1 建立HPLC分析方法
2.1.1 色谱条件[7]色谱柱C18,流动相乙腈/0.1%磷酸溶液(33/67);检测波长285 nm(肉桂醛),柱温25 ℃;流速1.0 mL/min,进样量10 μL.
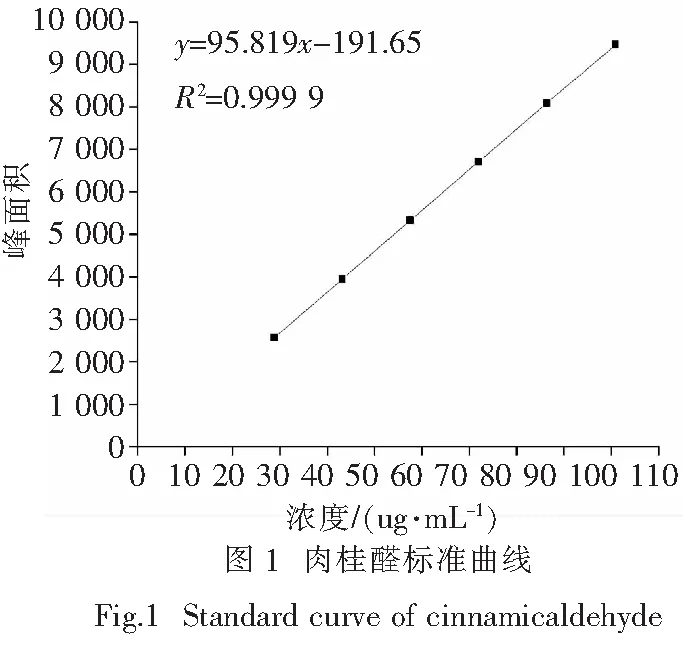
2.1.2 方法学验证 精确称取肉桂醛标准品0.018 0 g,用甲醇配制28.6,43.0,57.4,71.8,86.2,100.6 μg/mL的肉桂醛标准品溶液,各取10 μL注入高效液相色谱仪中进行测定.以肉桂醛的峰面积(y)对浓度(x)作线性回归,横坐标为肉桂醛标准品浓度,纵坐标为相应峰面积.得到标准曲线:y=95.819x-191.65,R2=0.999 9,表明肉桂醛标准品在28.6~100.6 μg/mL浓度范围内线性关系良好,标准曲线见图1.
2.2 肉桂油微乳的制备
本实验所用的肉桂油微乳配方为:无水乙醇/肉桂油/水/ Tween80/ EL-40/ IPP,制备温度为40 ℃.本实验所制备肉桂油微乳采用转相乳化法,各取一定量的油相(IPP/肉桂油=1∶1)、表面活性剂(Tween80/EL-40=1∶2)和助表面活性剂(无水乙醇/Km=2∶1)于烧杯中混合搅拌均匀,然后边搅拌边向烧杯中缓慢滴入水相(蒸馏水),体系先由澄清油相变浑浊再恢复澄清,此时形成油包水型(W/O)微乳,继续滴加蒸馏水,体系突然变为澄清黏稠难以搅拌,继续加水相至一定量,体系突然变稀,此时则制得水包油(O/W)型肉桂油微乳.本实验所制备肉桂油微乳pH值为5.23,平均粒径31 nm,黏度为104 mPa·s,电导率110 μs/cm,折光率为1.415nD.(其中肉桂油的百分含量为10.5%)
2.3 体外释放实验
2.3.1 人工肠液的配制 准确称量磷酸二氢钾(KH2PO4)6.8 g,加入蒸馏水定容至500 mL,然后用0.1 mol/L的氢氧化钠溶液调节pH值至6.8,称取胰酶10 g,加入适量蒸馏水溶解,将pH值为6.8的KH2PO4溶液与胰酶溶液混合均匀,加蒸馏水定容至1 000 mL,即制成pH值为6.8的人工肠液.
2.3.2 正相透析扩散 取一定量已制备好的O/W型肉桂油微乳,移取20 mL到经多次预处理(用沸水煮沸10 min)的透析袋中,将袋口扎紧,再把透析袋置于装有100 mL释放介质(所制备pH值为6.8的人工肠液)的三角瓶中,控制反应体系温度在(37±0.5) ℃,放入摇床中,控制转速在100 r/min,分别于0.5,1,2,4,6,8 h取样4 mL待测.每次取样后即立刻补充等体积同温度的新鲜释放介质于三角瓶中,以确保人工肠液的总体积不变.
2.3.3 肉桂油中肉桂醛含量的检测 用分析天平精确称取肉桂油0.252 0 g于25 mL容量瓶中,加入甲醇并定容至刻度,然后逐级稀释100倍,用高效液相色谱仪检测峰面积,将检测所得的峰面积代入到肉桂醛标准曲线中,即可求出相应浓度,通过换算后,得到0.252 0 g肉桂油中所含的肉桂醛含量,肉桂醛在肉桂油中的含量比为(m肉桂醛/m肉桂油)×100%.
2.3.4 肉桂油微乳样品中肉桂醛含量的检测 分别往0.5、1、2、4、6、8 h所取样品中加入2.0 g无水硫酸钠破乳.在70 ℃下水浴10 min.取上层溶液并加入甲醇,离心(8 000 r/min,15 min).取上清液定容至10 mL,随后按一定倍数稀释,用HPLC检测峰面积,代入到肉桂醛标准曲线中,求得各不同时间点所取样品的浓度.
2.3.5 体外释放数据处理 累积释放量(Mt)指在第a个取样时间内反应体系所释放的待测物质总量,借助以下公式进行计算:
Mt=VCa+∑Ca-1V样,
Ca为第a个取样时间肉桂醛释放到人工肠液中的浓度;V为第一次取样前的体积,本实验中V为100 mL;Ca-1为在第a个取样时间的前一个取样时间时肉桂醛的释放浓度;V样为每次所取样品的体积,本实验中V样为4 mL.
用以下公式计算累积释放百分数Q:
Q=Mt/体系中所含肉桂醛总量×100%.
2.3.6 体外释药动力学模型的建立 通过上述所求得的累积释放百分数,及其相对应的时间,借助Origin7.5软件进行曲线拟合,来判定肉桂油微乳的体外缓释属于哪种释药类型.本实验总共采用五种缓释方程进行拟合,分别是:
零级释药方程:Q=Kt
一级释放方程:ln(1-Q)=-Kt
Retger-peppas方程:Q=Ktn
Higuchi平面扩散模式方程:Q=Kt1/2
Hixcon-Crowell溶蚀方程:(100-Q)1/3= -Kt
其中Q为累积释放百分率;t为释放时间;K、n均为常数.
2.4 实验结果与分析
2.4.1 肉桂油中肉桂醛含量检测结果 经分析计算0.252 0 g的肉桂油中含有肉桂醛0.223 9 g,再经计算得到肉桂醛在肉桂油中的百分含量比为88.84%.
准确量取3份所制备肉桂油微乳(每份体积为5 mL),称量其质量分别为:4.77、4.82、4.81 g,取平均值:即每5 mL肉桂油微乳的平均质量是4.80 g.20 mL肉桂油微乳的平均质量则为19.2 g.本实验所制备得到的肉桂油微乳中肉桂油的百分含量为10.5%,肉桂醛在肉桂油中的百分含量比为88.84%.则20 mL肉桂油微乳中所含肉桂醛的质量为:19.2×10.5%×88.84%=1.808 g.
2.4.2 肉桂油微乳样品中肉桂醛含量检测结果 先对肉桂油微乳样品进行破乳处理,然后离心定容至10 mL,其中将在第0.5、1、2 h所取的样品稀释2倍,将在第4、6、8 h所取样品稀释5倍,用HPLC检测峰面积,将所测峰面积代入到肉桂醛标准曲线中,得到各时间点所取样品的肉桂醛浓度.结果见表1.
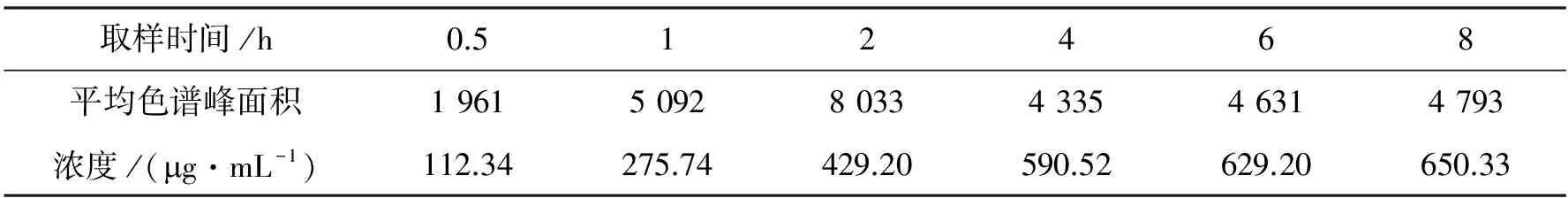
表1 样品检测结果
由表1中的数据,可以看出,肉桂油微乳释放到人工肠液中的浓度随时间的增加而增加.由于样品被检出的色谱峰面积必须控制在肉桂醛标准曲线的线性范围内,所以前后3个取样时间点样品稀释的浓度有所不同,但这并不影响最终实验结果.
2.4.3 体外释药数据处理结果 分别计算第0.5、1、2、4、6、8 h时体系中肉桂醛的累积释放量和累积释放百分数.结果见表2.

表2 累积释放量和累积释放百分数
由表2中数据可知,随着取样时间的增加,肉桂醛的累积释放量和累积释放百分数都在不断增加,体外释放8 h,累积释放百分数达到了47.9%.
2.4.4 体外释药动力学模型的建立 根据累积释放百分数与其对应的取样时间,用软件origin7.5进行不同类型的缓释方程拟合,拟合结果如表3所示.

表3 体外释药动力学模型的建立
由拟合结果可以看出,肉桂油微乳缓释方程符合Retger-peppas方程,但是与Higuchi平面扩散模式方程也具有较高的符合度.
方程拟合曲线如图2~图5.
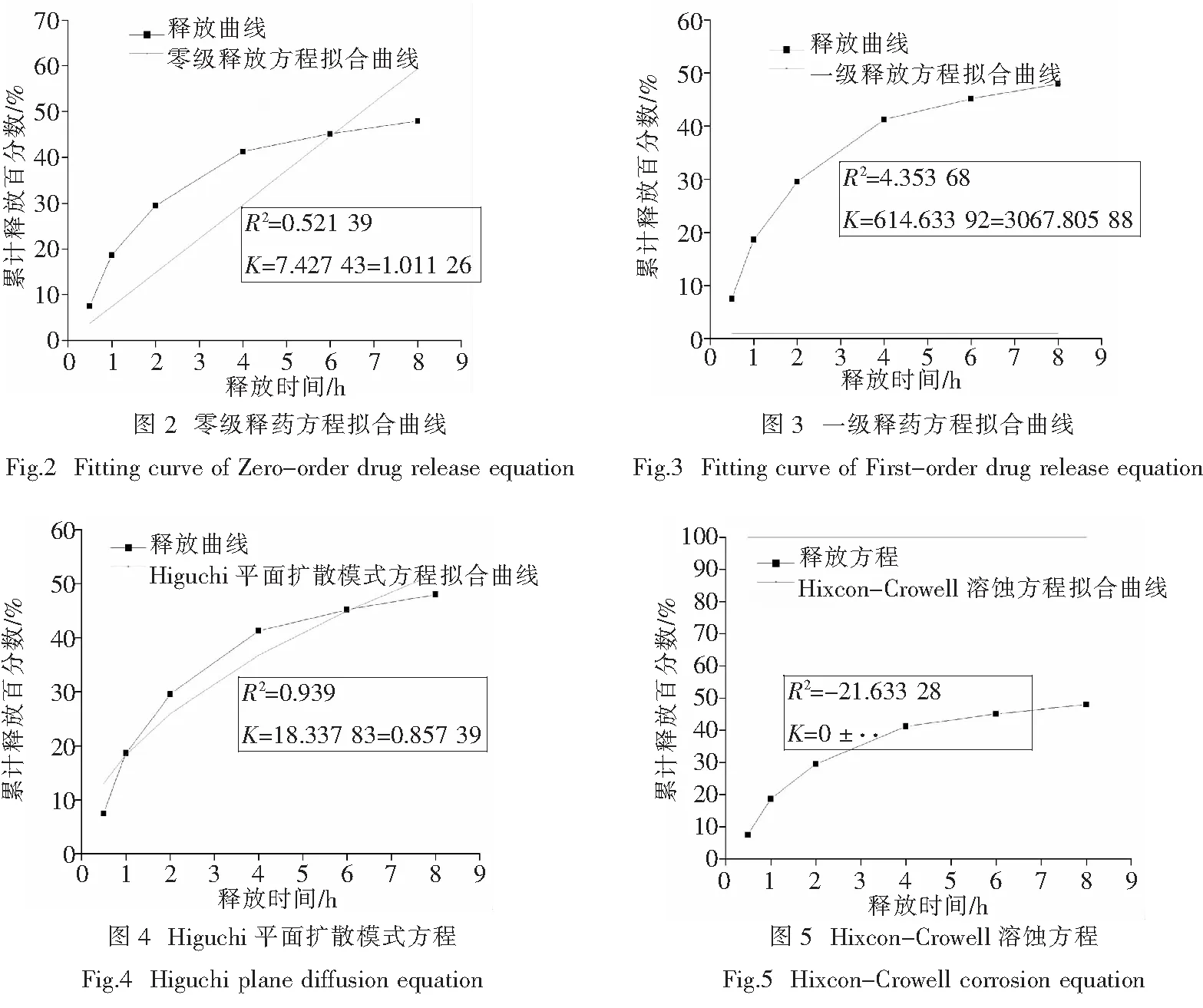
对所得实验数据进行缓释方程模型的拟合,综合上述结果表明,随着取样时间的增加,肉桂醛的累积释放量和累积释放百分数都逐渐增高,肉桂油微乳释放到人工肠液中的浓度逐渐升高,所制肉桂油微乳的释放模型符合Retger-peppas方程:Q=18.867 91t0.481 93,相关系数R2为0.939 87.
3 讨 论
近几年,国内学者姚琳[8]制作的肉桂油缓释胶囊具有明显缓释作用,体外释放符合Higuchi模型,可持续体外释药12 h,而且工艺简单,重现性好,这为肉桂油的进一步利用提供了依据.

诸多文献研究表明,将药物包埋在微乳内部制成口服制剂,可以避免药物直接接触消化道液,减少了消化道液破坏药物以及酶的降解作用,因此促进了药物的吸收;由于其表面张力比较低容易通过胃肠壁的水化层,使得药物能够直接接触胃肠上皮细胞,因此促进了药物的吸收;同时,微乳制剂也可被淋巴管吸收,克服了肝脏的首过效应,从而提高了药物的生物利用度.将肉桂油制成微乳弥补了肉桂油水溶性差的缺点,显著提高了它的生物利用度.此外微乳具有一定的靶向效应,有利于肉桂油在抗肿瘤治疗中的应用[9].
研究表明:肉桂油微乳释放到人工肠液中的浓度随着时间的增加而逐渐增高,于人工肠液中释放8 h,累积释放百分数达到了47.9%.通过建立体外释药动力学模型可得出,肉桂油微乳在人工肠液中的缓释方程符合Retger-peppas方程(Q=18.867 91t0.481 93,R2=0.939 87),但是与Higuchi平面扩散模式方程符合度也比较高.
[1] LI J J, JI B P, ZHOU F, et al. Study on extraction of two essential oils, analysis of major components and antimicrobial activities[J]. Food Science, 2006, 27(8) : 64-67.
[2] GU R Y, FU W C, YIN Y Z. Preliminary study on combined antiseptic effects of Clove and Cinnamon essential oils[J].Food Science, 2008, 29(10) : 115-117.
[3] ZHAO J X, LI P, HUANG Q F, et al. Effects of cinnamyl aldehyde on c-Fos and c-Myc expression in NIH3T3 cells[J].Chinese Journal of Pathophysiology, 2007, 23(12) : 2 448-2 450.
[4] HUANG J Q, WANG S W, LUO X X, et al. Effect of Cinnamaldehyde on proliferation and apoptosis of a heterologous graft in nude mice bearing human gastric carcinoma[J].Pharm J Chin PLA, 2006, 22(5) : 343-346.
[5] XU M, YU L, DING Y Y, et al. Experim ental study on hypotensive effects of Cinnamaldehyde in anesthetized rats[J].Chin Heart J, 2006, 18(3) : 272-276.
[6] MA Y Y, LI C H, LI L F, et al. Experimental study on antipyretic analgesic and anti-inflammatory actions of Cinnamaldehyde[J].Chinese Journal of Clinical Pharmacology and Therapeutics, 2006, 11(12) : 1 336-1 339.
[7] YI X, LI L, XIAO X N. The determination of Cinnamaldehyde in cinnamon oil microemulsion by HPLC[J].Li Shi Zhen Medicine and Materia Medica Research, 2011, 22(6) : 1 325-1 326.
[8] YAO L, DENG K Y, LUO J B, et al. Preparation and in vitro dissolution of the solid dispersions of Cinnamon Oil[J].J South Med Univ, 2008, 28(1) : 52-53.
[9] YU A H, CUI J, DAI J, et al. Solubilization of O/W Micro-emulsion for Cinnamon Oil[J].Li Shi Zhen Medicine and Materia Medica Research, 2012, 23(1) : 17-18.
责任编辑:朱美香
Research on Drug Release Characteristics of Cinnamon Oil Microemulsion in Simulated Artificial Intestinal Juice
YIXing2*,TANXiao-xiao1,XIAOXiao-nian1,LILi2
(1.Sino-german Joint Research Institution,Nanchang University, Nanchang 330047;2.Sino-german Food Engineering Center,Nanchang University,Nanchang 330047 China)
The drug release situation of cinnamon oil microemulsion in simulated artificial intestinal juice was researched, and the release kinetics model was established.The method of simulative artificial intestinal juice and cinnamon oil microemulsion release test in vitro to positive dialysis diffusion was selected, the content of cinnamaldehyde was determined by HPLC,the release of microemulsion in vitro simulated intestinal juice was detected. Results show that: With the increase of the sampling time, the cumulative release amount and cumulative release percentage of Cinnamaldehyde were increased gradually, the concentration of cinnamon oil microemulsion released in the artificial intestinal juice was increased gradually. Cinnamon oil microemulsion’s release model in artificial intestinal juice of pH 6.8 accords with Retger-peppas equation (Q=18.867 91t0.481 93,R2=0.939 78).
cinnamon oil; microemulsion; cinnamaldehyde; positive phase diffusion dialysis; drug release properties
2015-02-05
江西省教育厅项目(GJJ12029)
易醒(1967— ),男,江西 萍乡人,博士,副教授.E-mail:yixingtt@hotmail.com
Q811.7
A
1000-5900(2015)01-0067-05

