骨质疏松症的药物治疗
四川大学华西医院内分泌科 罗夕茗 范翩翩 郭彦宏 王覃 陈德才
对于绝经后妇女及50岁及以上男性,符合以下任意一项——①双能X线骨密度吸收仪(dual X-ray absorptiometry,DXA)中腰椎和/或髋部T值≤2.5;②骨量减少合并椎体、骨盆、肱骨近端或前臂远端等部位脆性骨折;③FRAX评分10年内髋部骨折发生率≥3%或主要骨质疏松相关性骨折发生率≥20%[1]——即应启动抗骨质疏松治疗。骨质疏松症的治疗包括非药物治疗和药物治疗。
非药物治疗主要包括合理膳食、适当运动、戒烟限酒及预防跌倒。骨骼的健康依赖于食物中充足的钙、维生素D、蛋白质及其他营养元素,它们为骨骼的新陈代谢提供物质基础。肢体神经受损或手术后局部制动都会导致患肢失用性骨质疏松,而适当负荷的运动可增强肢体协调性并避免骨量流失。同时,户外运动时阳光照射也可增加人体自身合成维生素D。吸烟及过度饮酒都会导致骨量丢失,戒烟及避免酗酒则可减少骨质流失。除椎体骨折外,其余部位骨折多与跌倒相关。防跌倒措施如防滑地板、清理障碍物、改善照明、增加扶手等可降低骨质疏松相关性骨折发生率。
非药物治疗是骨质疏松症的治疗基础,药物治疗则是骨质疏松症防治的主要措施。以下笔者就日前临床上常用和新靶点的抗骨质疏松药物及骨质疏松症药物的选择、序贯治疗、联合治疗等作简要介绍。
抗骨质疏松药物
根据其作用机制,抗骨质疏松症药物可分为骨吸收抑制剂(双膦酸盐、激素替代治疗、选择雌激素受体调节剂、组织选择性激素复合物、降钙素及狄诺塞麦)和骨形成促进剂(甲状旁腺素及其类似物)。同时,新靶点的药物如组织蛋白酶K抑制剂、硬化蛋白单克隆抗体等将为骨质疏松症药物治疗提供更多选择。
1. 当前抗骨质疏松药物(见表1)
1.1 骨吸收抑制剂
(1)双膦酸盐
双膦酸盐是稳定的含P-C-P结构焦磷酸盐类似物,根据结构中是否含氮,可分为含氮双膦酸盐及不含氮双膦酸盐。双膦酸盐与羟基磷灰石有高亲和力,并可被破骨细胞摄取。被摄取后含氮双膦酸盐抑制甲羟戊酸途径中法尼基焦磷酸合成酶活性。法尼基焦磷酸合成酶被抑制后,小分子GTP酶如Ras、Rho,Rac异戊烯化受阻[4],它们是破骨细胞执行关键功能等如维持细胞骨架及褶皱缘形成所必需的信号转导分子,由此破骨细胞活性下降并凋亡。不含氮双膦酸盐被破骨细胞代谢为细胞毒性ATP-双膦酸盐类似物,细胞失活并凋亡。综上,骨吸收明显下降,骨结构得到保护。含氮双膦酸盐(阿仑膦酸钠、利塞膦酸钠、伊班膦酸钠、唑来膦酸)骨吸收抑制作用明显强于不含氮双膦酸盐,临床上被广泛用于抗骨质疏松治疗。
双膦酸盐降低椎体骨折风险40%~70%,非椎体骨折风险大约降低25%[5,6]。
口服双膦酸盐最常见的不良反应为胃肠道反应(如吞咽困难,食管炎和胃溃疡),每周一次给药明显降低了其胃肠道刺激,且和每日给药有相同疗效。静脉制剂输注后可发生短暂的急性期反应,包括发热、头痛及关节肌肉疼痛,上述症状多于3d后明显缓解,后续治疗中可减轻或消失。双膦酸盐罕见不良反应有下颌骨坏死和股骨近端非典型骨折[7]。其他不良反应包括低钙血症、炎性眼病及急性肾功能衰竭。
(2)作用于雌激素受体的药物
雌激素为类固醇激素,通过与靶细胞胞内受体结合激活激素反应元件发挥生理作用。雌激素受体广泛分布于各器官和组织,如子宫、乳腺及骨组织和心血管等。
1)激素替代治疗(Hormone Replace Therapy,HRT)
雌激素与受体结合后可促进肠道钙吸收和抑制破骨细胞活性。停经后妇女体内雌激素水平下降,骨骼失去雌激素保护成为其骨质疏松症重要原因之一。HRT可分为单独使用雌激素(estrogen,ET)及联合使用雌孕激素(estrogen progestogen therapy,EPT)。HRT可改善阴道萎缩及围绝经期综合征如潮热、多汗。WHI研究[8]表明,口服结合雌激素5年后降低椎体及髋部骨折风险34%、降低其他类型脆性骨折风险23%,但HRT会增加浸润性乳腺癌、冠心病、脑卒中、深静脉血栓及肺栓塞风险。因此仅提倡重度围绝经期综合征患者最小有效剂量、最短疗程使用,并定期进行子宫、乳腺检查。
2)选择性雌激素受体调节剂(selective estrogen receptor modulators,SERMs)
此类药物是人工合成的非甾体雌激素类似物,仅针对靶组织(如骨组织、心血管)中的雌激素受体起激活作用,而在其他器官或组织(如子宫、乳腺)则表现为抑制作用。MORE研究[9]表明,每日口服雷洛昔芬60mg,3年后可降低无骨折史患者椎体风险50%、降低有骨折史患者椎体骨折风险30%,但对非椎体骨折的预防无效;可降低浸润性乳腺癌风险,但脑卒中、静脉血栓形成风险升高并可能加重停经后血管舒缩症状。新一代的SERMs如巴多昔芬、拉索昔芬、奥培米芬组织选择性更高,但其有效性和安全性待进一步证实。
3)组织选择性雌激素复合物(tissue selective estrogen complex,TSEC)
结合雌激素/巴多昔芬适用于中、重度围绝经期综合征妇女的骨质疏松症防治。研究[10]表明,与对照组相比,口服Duavee(0.45mg/20mg)12个月后腰椎及全髋骨密度分别提升1.51%、1.21%。其不良反应包括肌痉挛、恶心、腹泻、消化不良、上腹痛、咽痛、眩晕和颈痛。因其中含有雌激素,故也有雌激素类药物上述不良反应。对于高骨折风险的妇女,不推荐单独使用以抗骨质疏松。
(3)降钙素
降钙素可降低破骨细胞活性,增强成骨细胞活性。鲑鱼降钙素作用强于人降钙素40~50倍,故被广泛应用于临床。PROOF研究[11]表明,每日降钙素200IU(鼻喷剂)可降低椎体骨折风险33%,对降低非椎体骨折无明显效果。此外,降钙素对椎体压缩性骨折所致骨痛有戏剧性效果。皮下注射及肌肉注射制剂不良反应包括恶心、颜面潮红,偶有过敏反应。鼻喷剂使用方便且不良反应少。降钙素增加某些肿瘤如肝癌风险[12],欧洲已不推荐其用作抗骨质疏松治疗。
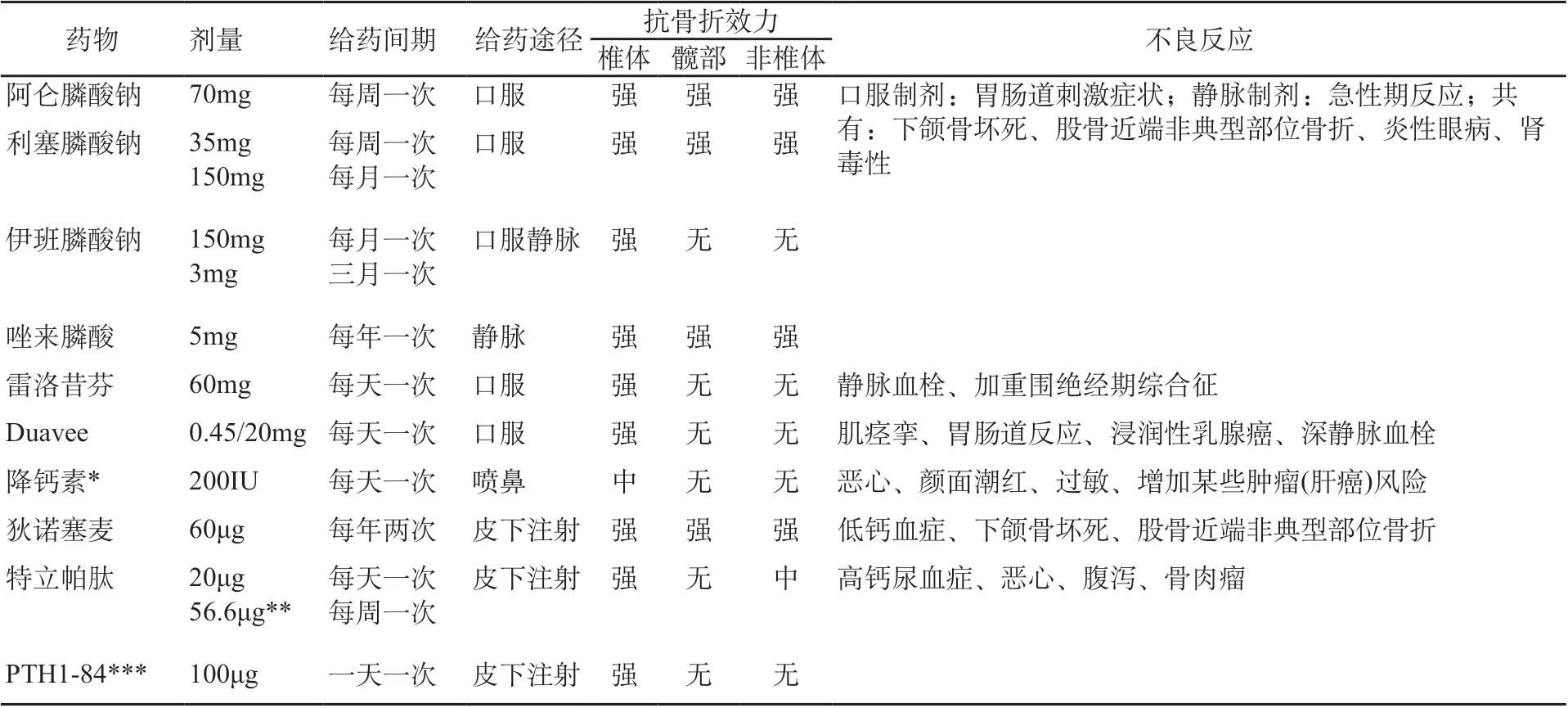
表1 当前抗骨质疏松药物[2,3]
(4)狄诺塞麦(见图1)
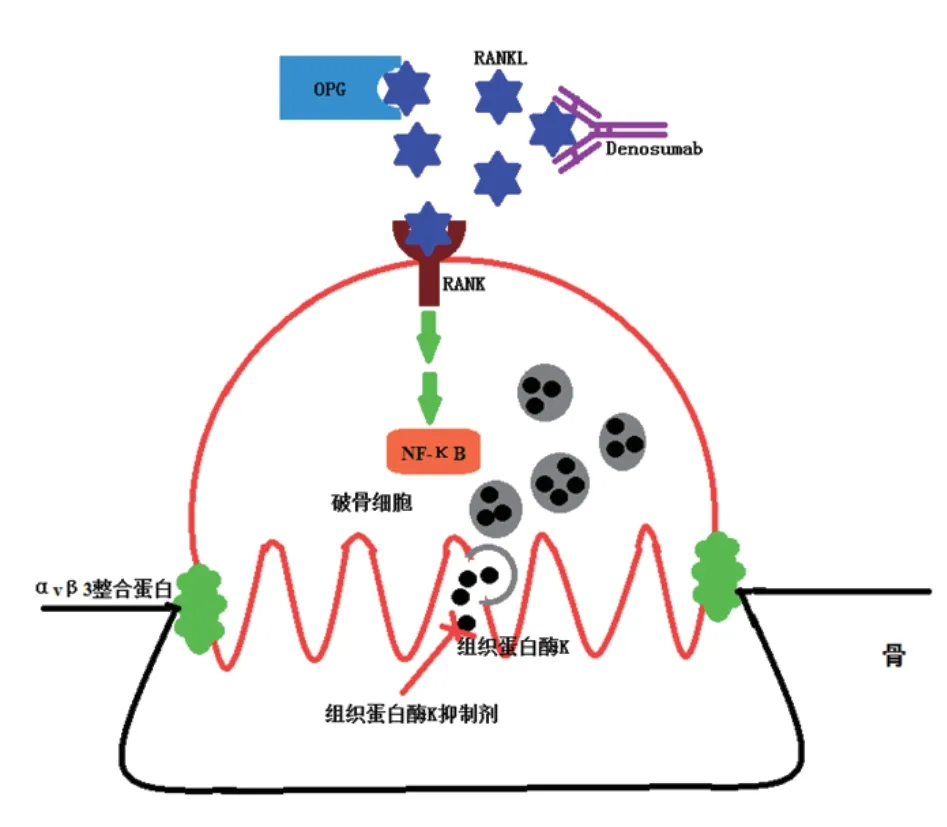
图1 破骨细胞信号转导通路中的药物治疗靶点[18]
狄诺塞麦是核因子κB活化受体配体(receptor activator of nuclear factor κB ligand,RANKL)的人源性,属于肿瘤坏死因子α(tumor necrosis factor -α,TNF-α)家族,与位于破骨细胞表面的核因子κB活化受体(receptor activator of nuclear factor kB,RANK)结合后可活化核因子κB(nuclear factor-kappa B,NFκB),后者进入细胞核影响相关基因的表达,对破骨细胞的分化、增生、多核化、活化和存活起关键作用。骨保护蛋白(osteoprotegerin,OPG)是RANKL天然的拮抗剂。狄诺塞麦与RANKL有高亲和力,从而抑制破骨细胞活性、提升骨密度。
FREEDOM研究[13]表明,每6月一次狄诺塞麦60mg皮下注射,3年后可明显降低骨折风险:椎体68%、髋部40%、非椎体20%;腰椎和全髋骨密度分别升高9.2%、6.0%。FREEDOM延伸试验[14]中,与基线相比腰椎及全髋骨密度6年后升高15.2%、7.5%。
狄诺塞麦总体耐受性好,但湿疹和蜂窝织炎(如丹毒)发生率升高。狄诺塞麦可导致低钙血症,使用前应注意纠正低血钙,尤其是肾功能不全患者。与双膦酸盐类似,狄诺塞麦也可导致下颌骨坏死及股骨近端非典型部位骨折。与双膦酸盐比较,狄诺塞麦优点如下:①每6月一次皮下注射,给药简便,患者依从性高。②无肾毒性,肾功能不全患者仍可使用。③提升骨密度效力更强。缺点是费用昂贵。
1.2 骨形成促进剂——特立帕肽和rhPTH 1-84
原发性或继发性甲状旁腺功能亢进时,持续PTH刺激会对骨骼(尤其是骨皮质)产生损害。然而,间断性应用PTH可提高成骨细胞的质和量,使骨量增加,改善松质骨和皮质骨结构,增加皮质骨厚度。rhPTH 1-84是全长重组人甲状旁腺素;特立帕肽则是甲状旁腺素N端1~34氨基酸残基片段,保留了PTH生物学活性。
在一项Ⅲ期临床研究[15]中,每天一次特立帕肽20μg皮下注射21个月后,提升椎体骨密度9.7%、股骨颈2.8%和全髋2.6%,椎体骨折风险降低65%,非椎体50%,但髋部骨折风险无明显下降。目前正在开展一项Ⅳ期临床试验,对比特立帕肽与利塞膦酸钠的抗骨折效力。
特立帕肽最常见不良反应包括恶心、下肢抽搐和头痛。在临床前研究中,特立帕肽增加实验动物骨肉瘤风险,因此Paget病及有放疗史患者应避免使用。然而最近有研究[16]表明,使用特立帕肽或rhPTH 1-84患者骨肉瘤发生率并不升高。
日本TOWER研究[17]显示,每周56.5μg特立帕肽皮下注射72周后,患者椎体骨折风险降低80%(14.5% vs 3.1%)。表明特立帕肽每日疗法(降低股骨颈皮质骨密度)和每周疗法效果大致相当。
特立帕肽透皮贴剂(TPTD patches,TPTD-P)可使特立帕肽较快达到血药高峰。研究表明[18],40μg TPTD-P使用6个月后腰椎、全髋骨密度分别上升4.97%及1.33%,20μg特立帕肽皮下注射组(TPTD injection,TPTD-I)为3.55%,全髋及股骨颈骨密度变化不大。6个月后TPTD-P组和TPTD-I组1型前胶原氨基端肽(amino-terminal propeptide of type I procollagen,P1NP)分别上升314%和116%,血清C末端肽(C-terminal telopeptide,CTX)分别上升105%和47%。上述研究提示TPTD-P可更有效提高骨密度。
2. 新靶点抗骨质疏松药(见表2)
2.1 骨吸收抑制剂——奥当卡替(Odacanatib) 奥当卡替是组织蛋白酶K抑制剂。破骨细胞产生的组织蛋白酶K是一种丝氨酸蛋白酶,降解骨基质蛋白和I型胶原,在骨吸收中起重要作用。以高骨密度、高骨脆性、身材矮小和远端指/趾骨骨溶解为特征的致密性成骨不全是因为患者组织蛋白酶K无能,破骨细胞功能低下。与其他类型的组织蛋白酶相比,组织蛋白酶K组织特异性和亲和力更高。
一项Ⅱ期临床研究[19]表明,每周口服50mg奥当卡替2年,奥当卡替组腰椎、全髋骨密度分别提升5.5%、3.2%。该临床研究延伸至3年后腰椎及全髋骨密度继续升高,与基线值相比分别为7.9%、5.8%,尿Ⅰ型胶原氦基末端肽下降50.5%,而骨特异性碱性磷酸酶(bone-specific alkaline phosphatase,BAP)与基线水平相近[20],且未发现硬皮病样皮肤损害病例。LOFT研究表明,与基线水平相比,奥当卡替提升椎体及全髋骨密度分别为11.2%及9.5%;椎体、非椎体及全髋骨折风险分别下降72%、27%及47%。
经典的骨吸收抑制剂(双膦酸盐及狄诺塞麦)使破骨细胞凋亡,阻断破骨细胞与成骨细胞之间的信号转导,骨吸收被明显抑制后骨形成也同时被抑制。新型骨吸收抑制剂奥当卡替使破骨细胞失活,但其与成骨细胞的双向信号转导仍存在,从而维持成骨细胞的骨形成作用。
2.2 骨形成促进剂
(1)Abaloparatide
Abaloparatide是一种新的甲状旁腺素相关蛋白PTHrp1-36。与特立帕肽相比,Abaloparatide治疗窗[9~28μg/(kg·d)]更宽。24周的Ⅱ期临床研究[21]中,Abaloparatide 20μg、40μg及80μg与特立帕肽20μg组腰椎骨密度分别升高2.9%、5.2%、6.7%及5.5%,股骨颈骨密度分别升高为2.7%、2.2%、3.1%及1.1%,全髋骨密度分别升高为1.4%、2.0%、2.6%及0.5%。P1NP在40μg、80μg及特立帕肽组分别升高55%、52%及98%,骨钙素(osteocalcin,OC)与P1NP趋势大致相同,CTX分别升高32%、23%及76%。与对照组和特立帕肽组相比,各剂量Abaloparatide组高钙血症发生率无统计学差异。上述研究表明,Abaloparatide可能为甲状旁腺类似物治疗骨质疏松症带来新的选择。
(2)硬化蛋白单克隆抗体
Wnt/β连锁蛋白通路在成骨细胞分化中起扳机作用(见图2)。β连锁蛋白降解复合体由支架蛋白Axin募合催化β连锁蛋白磷酸化的糖原合成酶3β(glycogen synthase kinase 3β,GSK-3β)和能增强复合体与β连锁蛋白亲和力的肠腺瘤样息肉蛋白(adenomatous polyposis coli,APC)构成。β连锁蛋白复合体能催化β连锁蛋白丝/苏氨酸磷酸化,后者随后被泛素化降解。Wnt蛋白与低密度脂蛋白受体相关蛋白5/6(low density lipoprotein receptor-related protein 5/6,LRP5/6)和卷曲蛋白(frizzled,Frz)结合后使β连锁蛋白降解复合体解体,细胞内β连锁蛋白浓度升高,进入细胞核调节基因转录,进而调节成骨细胞分化。硬化蛋白(slcerostin)抑制Wnt蛋白与LRP5/6结合而抑制成骨细胞募集和活化。硬化蛋白单克隆抗体可使Wnt/β连锁蛋白通路激活,从而促进成骨作用。
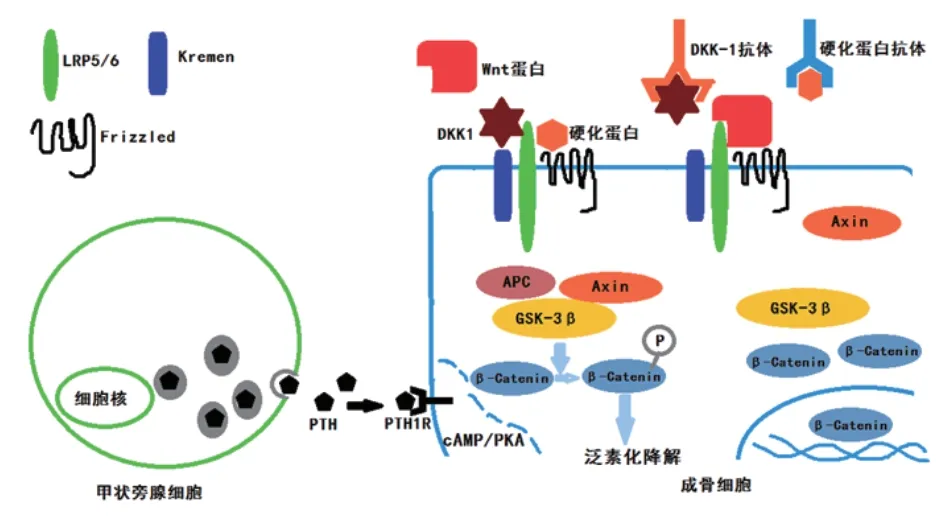
图2 甲状旁腺细胞及成骨细胞信号转导通路中的药物治疗靶点[18]
1)Romosoumab
一项I期临床研究[22]显示,皮下注射remosoumab 10mg/kg组P1NP、BAP及OC最大升高幅度为184%、126%及176%,静脉注射5mg/kg组分别为167%、125%及143%。同时CTX呈剂量依赖性下降,皮下注射组、静脉注射组最大下降幅度分别为54%及49%。和对照组之间,remosoumab不良反应无差异。尽管6名受试者产生了中和抗体,但对药动学、药效学及安全性无影响。
一项Ⅱ期临床[23]表明,每月一次皮下注射210mg romosoumab,1年后提升腰椎骨密度11.3%,阿仑膦酸钠组、特立帕肽组、对照组分别为4.1%、7.1%及-0.1%。Ⅲ期临床正在开展以评估其有效性,预计将于2016年1月完成。
2)Blosozumab
一项Ⅱ临床[24]显示,blosozumab 180mg/2周、180mg/4周、270mg/2周皮下注射1年后,腰椎骨密度分别提升8.4%,14.9%及17.7%;全髋骨密度分别提升2.1%,4.5%及6.7%。 不良反应主要为注射部位反应。以评估骨折风险为目标的Ⅲ期临床在本文执笔时尚未宣布开始。
此外,另一种硬化蛋白抗体BPS804亦在临床研究中。
骨质疏松症用药方案
1. 基础治疗
充足的钙剂和维生素D的补充是抗骨质疏松症药物治疗的基础。综合考虑膳食摄入量、血尿钙及25(OH)D水平,推荐剂量为元素钙每天1000~1200mg,维生素D每日800IU或每季100000IU[25]。
2. 单药方案
双膦酸盐是日前抗骨质疏松治疗的一线用药[26]。口服双膦酸盐不能耐受或依从性欠佳者可考虑静脉双磷酸盐制剂。对于估算肾小球滤过率(estimated glomerular filtration rate,eGFR)<30~35ml/(min·1.73m2)者,推荐使用狄诺塞麦。针对中、重度围绝经期症状,骨折风险低的妇女可酌情考虑小剂量短疗程HRT;对于乳腺癌高风险妇女建议使用SERMs或TSEC。在充分评估效益和风险后,无论HRT还是SERMs、TSEC,都建议尽早改成双膦酸盐或狄诺塞麦。对于骨折高风险患者,经济情况允许时可考虑使用狄诺塞麦、特立帕肽、PTH 1-84或联合治疗[27]。
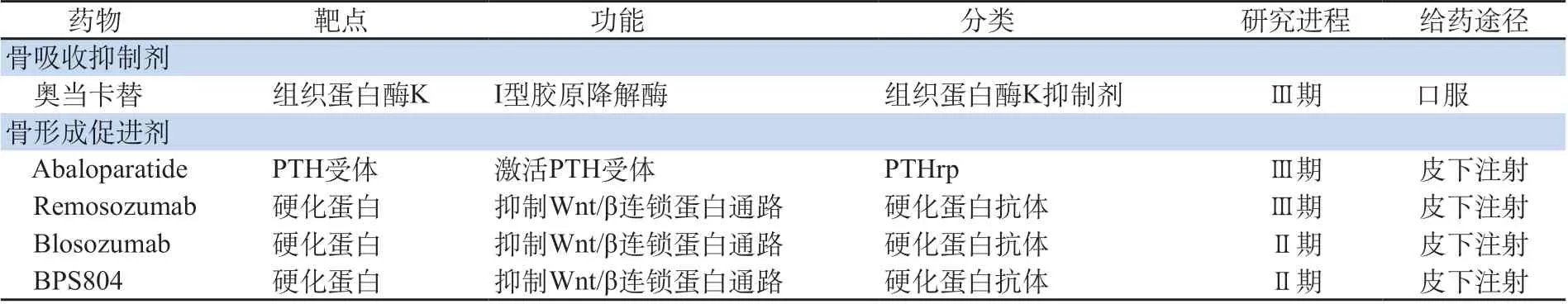
表2 新靶点抗骨质疏松药
3. 序贯治疗和联合治疗
对于使用双膦酸盐效果欠佳者,可改用特立帕肽。终止非双膦酸盐类抗骨质疏松药物治疗后,提升的骨量将迅速丢失,续以双膦酸盐治疗可维持或进一步提高骨密度。这是日前效果明确的类似于序贯治疗方法的措施。
尽管日前抗骨质疏松药物疗效确切,但单药治疗仍存在骨密度的提升空间及进一步降低骨折风险的可能。因此,便提出了联合治疗。联合治疗大致可分为骨吸收抑制剂的联合和骨吸收抑制剂与骨形成促进剂的联合。研究表明,阿仑膦酸钠和HRT合用有协同作用。关于其他骨吸收抑制剂联合用药的临床研究较少。理论上骨形成促进剂和骨吸收抑制剂联合用药在提高骨密度及骨强度方面比单药治疗可产生更优的效果,但研究结果却差强人意。特立帕肽和阿仑膦酸钠联用试验表明,骨吸收和骨形成标志物都降低,比特立帕肽单药治疗疗效差。特立帕肽和雷洛昔芬或利塞膦酸钠联合略强于特立帕肽单药治疗,尤其可提高髋部骨密度。特立帕肽和唑来膦酸合用提升腰椎骨密度效力同特立帕肽单药相当,髋部则和唑来膦酸单药相同[28]。DATA延伸试验[29]表明,24月后特立帕肽和狄诺塞麦联用组、特立帕肽组、狄诺塞麦组腰椎骨密度分别提升12.9%、9.5%及8.3%;股骨颈为6.8%、2.8%及4.1%;全髋为6.3%、2.0%及3.2%。对于髋部骨折高风险患者,和单药相比,特立帕肽与唑来膦酸或狄诺塞麦联合应用,患者可能获益更大。然而,上述联合方案皆无以骨折事件为终点的临床研究,其抗骨折效力仍有待进一步证实。
4. 药物假期
终止双膦酸盐抗骨质疏松治疗后仍有3~5年的骨骼保护作用,长期使用双膦酸盐抗骨质疏松治疗导致下颌骨坏死及股骨近端非典型部位骨折发生率升高——导致人们提出药物假期的概念。对于规律使用双膦酸盐抗骨质疏松3~5年的患者,若其转变为低骨折风险(DXA骨密度>-2.5和FRAX评分提示10年内髋部骨折风险<3%、主要部位骨折风险<20%)则可以考虑停药,2~3年后再次评估是否需要继续治疗;若骨密度仍为骨质疏松或FRAX评分提示骨折高风险,则应继续服用双膦酸盐或换用其他方案治疗[30]。
总 结
随着平均寿命的延长,人类将更有可能发生骨质疏松症。骨质疏松所致的骨痛和脆性骨折严重影响人们的生活质量并增加死亡率。因此,有必要抗骨质疏松治疗以缓解骨痛和降低骨折发生率。骨质疏松症的治疗包括非药物治疗和药物治疗。非药物治疗是骨质疏松治疗的基础,包括合理膳食、适度运动、戒烟限酒及预防跌倒。药物治疗则是日前骨质疏松症防治的主要措施。根据其作用机制,抗骨质疏松药物可分为骨吸收抑制剂(双膦酸盐,HRT、SERMs、TSEC、降钙素及狄诺塞麦)和骨形成促进剂(甲状旁腺素及其类似物)。其中,双膦酸盐是日前骨质疏松药物治疗的一线方案,任何新药的有效性都以其为准绳。处于临床研究的新型抗骨质疏松药物如组织蛋白酶K抑制剂(奥当卡替)、PTHrp(Abaloparatide)、硬化蛋白单克隆抗体(Romosoumab,Blosozumab,BPS804)等可能会有更理想的治疗效果、更轻微的不良反应,从而为骨质疏松症用药提供更多选择。
[1] Eriksen EF, Diez-Perez A, Boonen S. Update on long-term treatment with bisphosphonates for postmenopausal osteoporosis: A systematic review[J]. Bone, 2014, 58: 126-135.
[2] Joann V, Pinkerton, Semara Thomas, et al. Osteoporosis treatment and prevention for postmenopausal women: current and future therapeutic options[J]. Clin Obstet Gynecol, 2013, 56(4): 711-721.
[3] Rachner TD, Khosla S, Hofbauer LC. Osteoporosis: now and the future[J]. Lancet, 2011, 377(9773): 1276-1287.
[4] Khosla S, Bilezikian JP, Dempster DW, et al. Benefits and risks of bisphosphonate therapy for osteoporosis[J]. J Clin Endocrinol Metab, 2012, 97(7): 2272-2282.
[5] Black DM, Cummings SR, Karpf DB, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group[J]. Lancet, 1996, 348(9041): 1535-1541.
[6] Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis[J]. N Engl J Med, 2007, 356(18): 1809-1822.
[7] Watts NB, Diab DL. Long-term use of bisphosphonates in osteoporosis[J]. J Clin Endorinol Metab, 2010, 95(4): 1555-1565.
[8] Rossouw JE, Anderson GL, Prentice RL, et al. Writing Group for the Women's Health Initiative Investigators. Risk and benefits of estrogen plus progestin in healthy postmenopausal women[J]. JAMA, 2002, 288(3): 321-333.
[9] Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation(MORE) Investigators[J]. JAMA, 1999, 282(7): 637-645.
[10] Cosman F, de Beur SJ, LeBoff MS, et al. Clinician's guide to prevention and treatment of osteoporosis[J]. Osteoporos Int, 2014, 25(10): 2359-2381.
[11] Chesnut CH 3rd, Silverman S, Andriano K, et al. A randomized trial of nasal spray salmon calcitonin in postmenopausal women with established osteoporosis: the Prevent Recurrence of Osteoporotic Fractures Study[J]. Am J Med, 2000, 109(4): 267-276.
[12] Sun LM, Lin MC, Muo CH, et al. Calitonin Nasal Spray and Increased Cancer Risk: A Population-Based Nested Case-Control Study[J]. J Clin Endocrinol Metab, 2014, 99(11): 4259-4264.
[13] Cummings SR, San Marin J, McMlung MR, et al. Denosumab for prevention of fractures in postmenopausal woman with osteoporosis[J]. N Engl J Med, 2009, 361(8): 756-765.
[14] Bone HG, Chapurlar R, Brandi ML, et al. The effect of three or six years of denosumab exposure in women with postmenopausal osteoporosis: results from the FREEDOM extention[J]. J Clin Endocrinol Metab, 2013, 98(11): 4483-4492.
[15] Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone(1-34) on fracture and bone mineral density in postmenopausal women with osteoporosis[J]. N England J Med, 2001, 344(19): 1434-1441.
[16] Cipriani C, Irani D, Bilezikian JP. Osteoanabolic therapy for osteoporosis: a decade of experience[J]. J Bone Miner Res, 2012, 27(12): 2419-2428.
[17] Nakamura Y, Sugimoto T, Nakno T, et al. Randomized Teriparatide[Human Parathyroid Hormone(PTH) 1-34] Once- Weekly Efficacy Research(TOWER) trial for examining the reduction in new vertebral fractures in subjects with primary osteoporosis and high fracture risk[J]. J Clin Endocrinol Metab, 2012, 97(9): 3097-3106.
[18] Cosman F, Lane NE, Bolognese MA, et al. Effect of transdermal teriparatiede administration on bone mineral density in postmenopausal women[J]. J Clin Endocrinol Metab, 2010, 95(1): 151-158.
[19] Bone HG, McClung MR, Roux C, et al. Odanacatib, a cathepsin-K inhibitor for osteoporosis: a two-year study in postmenopausal women with low bone density[J]. J Bone Miner Res, 2010, 25(5): 937-947.
[20] Eisman JA, Bone HG, Hosking DJ, et al. Odanacatib in the treatment of postmenopausal women with low bone density: three-year continued therapy and resolution of effect[J]. J Bone Miner Res, 2011, 26(2): 242-251.
[21] Leder BZ, O'Dea LS, Zanchetta JR, et al. Effect of abaloparatide, a human parathyroid hormone-related peptide analog, on bone miner density in postmenopausal women with osteporosis[J]. J Clin Endcrinol Metab, 2015, 100(2): 697-706.
[22] Padhi D, Jang G, Stouch B, et al. Single-dose, placebo- controlled, randomized study of AMG 785, a sclerostin monoclonal antibody[J]. J Bone Miner Res, 2011, 26(1): 19-26.
[23] McClung MR, Grauer A, Boonen S, et al. Romosozumab in postmenopausal women with low bone mineral density[J]. N Engl J Med, 2014, 370(5): 412-420.
[24] Recker RR, Benson CT, Matsumoto T, et al. A randomized, doubleblind Phase 2 clinical trial of blosozumab, a sclerostin antibody, in postmenopausal women with low bone mineral density[J]. J Bone Miner Res, 2015, 30(2): 216-224.
[25] Bischoff-Ferrari HA. How to select the doses of vitamin D in the management of osteoporosis[J]. Osteoporos Int, 2007, 18(4): 401-407.
[26] Cooper C, Reginster JY, Cortet B, et al. Long-term treatment of osteoporosis in postmenopausal women: a review from the European Society for Clinical and Economic Aspects of Clinical and Osteoarthritis(ESCEO) and the International Osteoporosis Foundation(IOF)[J]. Curr Med Res Opin, 2012, 28(3): 475-491.
[27] Lim SY, Bolster MB. Current approaches to osteoporosis treatment[J]. Curr Opin Rheumatol, 2015, 27(3): 216-224.
[28] Cosman F. Combination therapy for osteoporosis: a reappraisal[J]. Bonekey Rep, 2014, 3: 518.
[29] Leder BZ, Tsai JN, Uihlein AV, et al. Two years of denosumab and teriparatide administration in postmenopausal women with osteoporosis(The DATA Extension Study): a randomized controlled trial[J]. J Clin Endocrinol Metab, 2014, 99(5): 1694-1700.
[30] Eriksen EF, Diez-Perez A, Boonen S, et al. Update on long-term treatment with bisphosphonates for postmenopausal osteoporosis: A systematic review[J]. Bone, 2014, 58: 126-135.