卟啉调控生物还原亚硒酸盐及合成硒纳米颗粒
赵 蕊,宋圆圆,郭建博,何 月
(天津城建大学a.环境与市政工程学院;b.天津市水质科学与技术重点实验室,天津 300384)
随着科技、经济的发展和进步,硒已广泛应用于石油炼制、电子及光电产业、化石燃料燃烧等各种工业活动,如今人为将其排放到环境中已造成环境污染问题[1].大量含硒工业废水、废渣及废气排放到当地环境中造成硒污染[2],特别是地下水受到硒污染的威胁,若长期处于含高浓度硒的环境中,将导致硒中毒[3].硒的含氧阴离子(Se(VI)、Se(IV))和硒化物(Se(-II))都是有毒物质,其中亚硒酸盐Se(IV)易溶于水,流动性大,毒性更强,是硒污染的重点研究对象.相比较物理、化学的去除方法,微生物修复法具有操作方便、生长速度快、环境适应性强、自分泌催化剂、环保、经济等优点[4],具有较大的发展前景,是目前处理含亚硒酸盐废水的一种较好的方法.此外,利用微生物可以将亚硒酸盐还原为硒纳米颗粒(SeNPs)排出胞外并进行硒资源回收.但由于生物还原法电子传递效率较低,极大地限制了亚硒酸盐废水生物处理的性能[5-6].因此,提高电子传递效率达到更好的亚硒酸盐废水生物处理性能至关重要.近年来,卟啉由于其良好的电子传递特性被广泛地应用于环境污染物处理领域[7-8].卟啉在生物体中可作为多种酶的活性辅基,在电子传递过程中起着重要的作用. 但以前的研究主要应用于环境污染物的化学催化,在环境的生物修复方面的研究和应用较少[9-10],并且关于卟啉对生物合成SeNPs 的性能影响仍不清楚.
此外,希瓦氏菌(Shewanella Oneidensis·MR-1)是研究最广泛深入的异化金属还原菌[11].其所具有的电子传递能力、灵活的代谢能力以及对重金属离子毒性的高耐受力等特性,使其在生物能源利用以及污染物生物修复等领域具有重要的应用潜力,并受到广泛关注[4,12].本研究针对生物法还原亚硒酸盐电子传递效率低的问题,开展卟啉调控亚硒酸盐生物还原研究.利用模型卟啉——四磺酸苯基卟啉(TPPS),采用单因素分析法探讨不同环境因素对TPPS 调控亚硒酸盐生物还原的性能影响(投加浓度、温度、pH、碳源等);并探讨对SeNPs 合成的影响,拟构建TPPS 调控亚硒酸盐高效生物还原系统,为环境中硒污染的微生物修复提供理论依据.
1 材料与方法
1.1 试验材料
1.1.1 菌种来源
希瓦氏菌(Shewanella Oneidensis·MR-1)由中国海洋微生物菌种保藏管理中心(MCCC)购买(菌种保藏编号1A01706).
1.1.2 培养基
LB 培养基(g/L):胰蛋白胨(10)、酵母粉(5)、NaCl(10)、pH 为7.0(±0.02).无机盐培养基(g/L):NaCl(5.850)、(4-(2-羟基哌啶基)哌嗪-1-二甲磺酸)HEPES 钠盐(11.910)、NH4Cl(1.498)、KCl(0.097)、NaH2PO4·2H2O(0.670). 微量元素组成[13](g·L-1):MgSO4·7H2O(30)、氨三乙酸(1.5)MnSO4·H2O(5)、NaCl(10)、FeSO4·7H2O(1)、CaCl2·2H2O(1)、CoCl2·6H2O(1)、ZnCl2(1.3)、CuSO4·5H2O(0.1)、AlK(SO4)2·12H2O(0.1)、H3BO3(0.1)、Na2MoO4·2H2O(0.25)、NiCl2·6H2O(0.25)、Na2WO4·2H2O(0.25). 微量元素浓度为1 mL·L-1.培养基中的碳源为乳酸钠(20 mmol-1),pH 控制为8.0(±0.02).LB 培养基用于希瓦氏菌的扩大培养,无机盐培养基用于亚硒酸盐生物还原.实验中将扩大培养后的希瓦氏菌接入无机盐培养基并控制OD600=1.2±0.1.
1.1.3 实验试剂
亚硒酸盐及配置培养基的药品均购自于北京奥博星生物技术有限公司,TPPS 购自上海源叶生物技术有限公司,呼吸抑制剂均购自美国Sigma 化学试剂公司,所有药品均为分析级.
1.2 实验方法
本研究用Na2SeO3配制储备液,保证体系中亚硒酸盐初始浓度为0.5 mmol·L-1. 无特殊说明情况下,TPPS 的浓度为0.2 mmol·L-1. 对照组为希瓦氏菌+亚硒酸盐、实验组为TPPS+希瓦氏菌+亚硒酸盐.所有实验均用N2吹脱3 次,设有3 组平行对照,结果取平均值. 亚硒酸盐含量检测采用电感耦合等离子体质谱仪ICP-MS(安捷伦7700e 美国)测定.SeNPs 表面的zeta电位及粒径利用zeta 电位仪进行测定.样品前处理步骤:首先用无菌注射器从血清瓶中取50 mL 样品并将其进行离心处理(10 000 r·min-1,10 min),离心后的样品留沉淀待用;用0.9%的NaCl 溶液将沉淀冲洗2 次(10 000 r·min-1,10 min);将冲洗后的沉淀重新悬浮于50 mM·L-1的Tris/Hcl 缓冲溶液中(pH 为8.0),利用细胞破碎仪对样品进行细胞破碎(4 min,功率32%);将破碎后的样品进行离心(10 000 r·min-1,30 min),留上清液后,再次将上清液进行离心(20 000 r·min-1,30 min)并收集沉淀;将沉淀的SeNPs 重新悬浮于超纯水中并配制不同的pH;最后进行SeNPs 表面的zeta 电位以及粒径分析.同时将处理后的SeNPs 进行冷冻干燥,用研钵研磨至粉末状后可进行傅里叶红外光谱分析.
2 结果与讨论
2.1 不同浓度TPPS 对希瓦氏菌还原亚硒酸盐的影响
设置pH 为8.0,温度为35 ℃,亚硒酸盐的初始浓度为0.5 mmol·L-1,分别测定TPPS 在10,5,100,200,300 μmol·L-1的条件下,希瓦氏菌还原亚硒酸盐的加速效果(见图1).在实验过程中可观察到血清瓶中有不同程度上的红色Se(0)纳米颗粒沉淀生成,表明不同浓度TPPS 对亚硒酸盐加速效果不同.24 h 所对应的亚硒酸盐还原速率分别为1.322,1.554,1.621,1.622,1.619 mg·L-1,对应的去除率分别为80.3%,94.4%,98.5%,98.5%,98.4%.当TPPS 浓度逐渐增大,亚硒酸盐的生物还原速率会随之升高,当TPPS 浓度接近饱和时,亚硒酸盐的生物还原速率逐渐趋于稳定,表明TPPS 在所选浓度范围内不会对希瓦氏菌的生长起抑制作用. 当TPPS 浓度大于200 μmol·L-1时,希瓦氏菌对亚硒酸盐的生物还原速率趋于稳定,所以TPPS的最佳投加浓度为200 μmol·L-1,在后续考察其他影响因素对希瓦氏菌还原亚硒酸盐的影响时,都选用200 μmol·L-1TPPS.
理论表明,氧化还原介体的标准氧化还原点位(E0’)位于电子供体和受体之间,这一过程的亚硒酸盐还原酶及其辅因子的理论(E0’)在NADH/NAD+(E0’=-0.32 V vs.SHE)到Se(IV)/Se(0)(E0’=+0.41 V vs.SHE)的范围内.TPPS 与c 型细胞色素的辅因子亚铁血红素具有相同的卟啉母体结构,因此具有相似的介导电子传递的电化学特性[14-15].具体来说,(E0’TPPS=-0.81 Vvs.SCE)或(E0’TPPS= -0.09 Vvs. SHE)介 于E0’(NADH/NAD+)和E0’(Se(IV)/Se(0))之间[16-17],这表明TPPS 可以作为亚硒酸盐生物还原的氧化还原介体,显著提高了亚硒酸盐生物还原的介导电子传递效率.
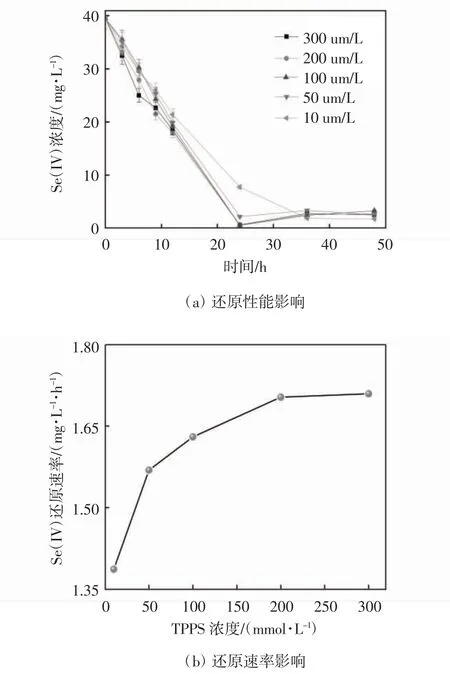
图1 不同浓度TPPS 对生物还原亚硒酸盐的性能及速率影响
2.2 不同pH 对TPPS 调控希瓦氏菌还原亚硒酸盐的影响
设置温度为35 ℃,亚硒酸盐的初始浓度为0.5 mmol·L-1,TPPS 投加浓度为200 μmol·L-1,实验考察了不同初始pH 的条件下,TPPS 对希瓦氏菌还原亚硒酸盐的生物还原效果,实验结果如图2 所示.
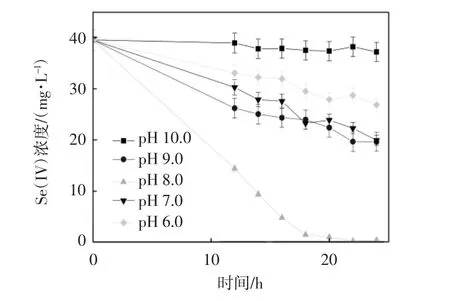
图2 不同pH 对生物还原亚硒酸盐浓度及还原速率的影响
该菌在生物还原亚硒酸盐的过程中受pH 的影响较大. 当初始pH 分别为6.0,7.0,8.0,9.0,10.0 时,在36 h 所对应的去除率分别为45.1%,68.5%,97.3%,86.1%,10.0%.在pH<7.0 和pH>8.0,即环境过于酸性或过于碱性的条件下,亚硒酸盐的生物还原速率较低,这表明希瓦氏菌生物还原亚硒酸盐的反应受到了抑制,主要是因为过酸和过碱的环境对微生物的生长不利,使希瓦氏菌的生长受到了抑制.当pH 为10.0时,其生物还原速率明显低于pH 为6.0 时的还原速率,表明过于碱性的环境对希瓦氏菌还原亚硒酸盐的抑制作用更大.由图2 可知,在pH 为8.0~9.0 的条件下,亚硒酸盐的生物还原速率较大,表明希瓦氏菌更适于在弱碱性的环境生长.在pH 为8.0 时,亚硒酸盐的去除效果最好,因此可以确定希瓦氏菌还原亚硒酸盐的最适pH 为8.0 左右.在后续实验考察其他影响因素对希瓦氏菌还原亚硒酸盐的影响效果时设置pH 为8.0.
2.3 温度对TPPS 调控希瓦氏菌还原亚硒酸盐的影响
设置pH 为8.0,TPPS 投加浓度为200 μmol·L-1,亚硒酸盐的初始浓度为0.5 mmol·L-1,实验考察了不同温度对TPPS 调控生物还原亚硒酸盐的影响,实验设置在5,25,35,45,55 ℃的条件下,TPPS 调控希瓦氏菌生物还原亚硒酸盐的效果,结果如图3 所示.
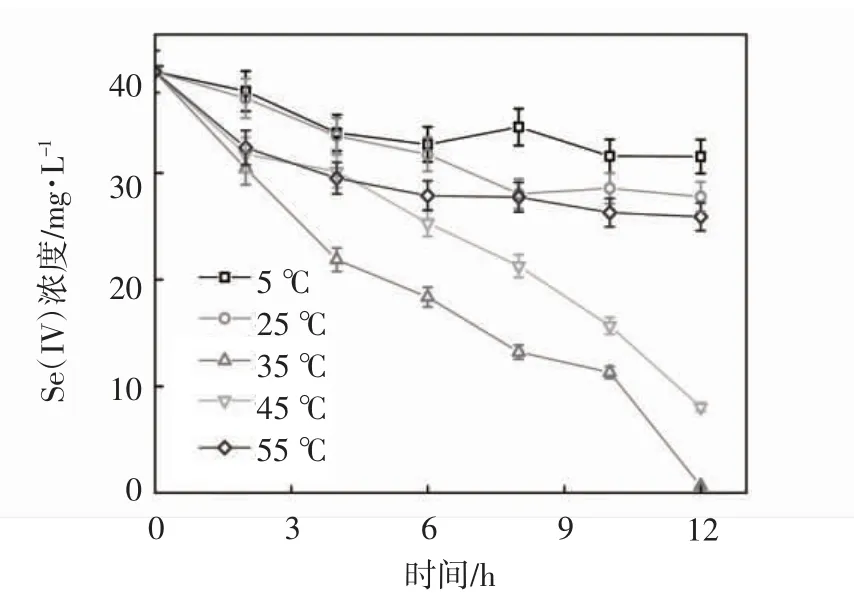
图3 不同温度对TPPS 调控希瓦氏菌还原亚硒酸盐的影响
在温度为5~55 ℃时,对应的亚硒酸盐去除率分别为20%,26%,99%,75%,30%. 当温度为5 ℃和55 ℃时,可以看出希瓦氏菌对亚硒酸盐还原速率明显降低,这是因为在过高或过低的温度条件下,虽然加入了和微生物菌体细胞内c 型细胞色素具有相似化学结构和电子传递特性的TPPS,但在极端温度环境条件下微生物体内的酶活性极低,从而影响了希瓦氏菌还原亚硒酸盐的还原性能.在5~35 ℃条件下,希瓦氏菌对亚硒酸盐的还原性能逐渐升高,这是因为随温度升高,希瓦氏菌体内的酶活性升高,使生物还原过程的活化能降低.在35~55 ℃条件下,随温度升高,微生物体内的酶活性逐渐降低,甚至失活,导致微生物的生长受到了抑制.结果表明,在12 h,温度35 ℃左右时,亚硒酸盐去除率最高.希瓦氏菌还原亚硒酸盐的最适温度在35 ℃左右.在后续实验考察其他影响因素对希瓦氏菌还原亚硒酸盐的影响效果时设置温度为35 ℃左右.
2.4 不同碳源对TPPS 调控希瓦氏菌还原亚硒酸盐的影响
设置pH 为8.0,温度35 ℃,TPPS 投加浓度为200 μmol·L-1,亚硒酸盐的初始浓度为0.5 mmol·L-1.实验考察了分别投加乳酸钠、乙酸钠、草酸钠和可溶性淀粉四种不同的碳源(20 mmol·L-1).TPPS 对希瓦氏菌生物还原亚硒酸盐的性能影响如图4 所示.
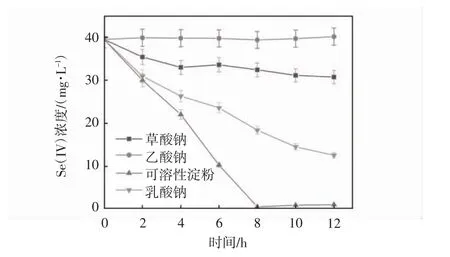
图4 不同碳源对TPPS 调控希瓦氏菌还原亚硒酸盐的影响
其中乙酸钠为外加碳源时,希瓦氏菌对亚硒酸盐无还原能力,表明希瓦氏菌不能利用乙酸钠作为碳源对亚硒酸盐进行生物还原.在8 h 时,当投加乳酸钠,草酸钠和可溶性淀粉这三种外加碳源时,对应亚硒酸盐的还原效率为100%,20%,72.5%.因此,希瓦氏菌生物还原亚硒酸盐的最佳碳源是乳酸钠.
2.5 TPPS 对SeNPs 合成尺寸的影响
为了考察TPPS 对生物合成SeNPs 粒径的影响,控制初始TPPS 浓度为200 μmol·L-1,温度为35℃,pH 为8.0,构建对照组、实验组生物还原体系进行探究,并对这两个生物还原体系中合成的SeNPs 的粒径进行了分析,结果如图5 所示.
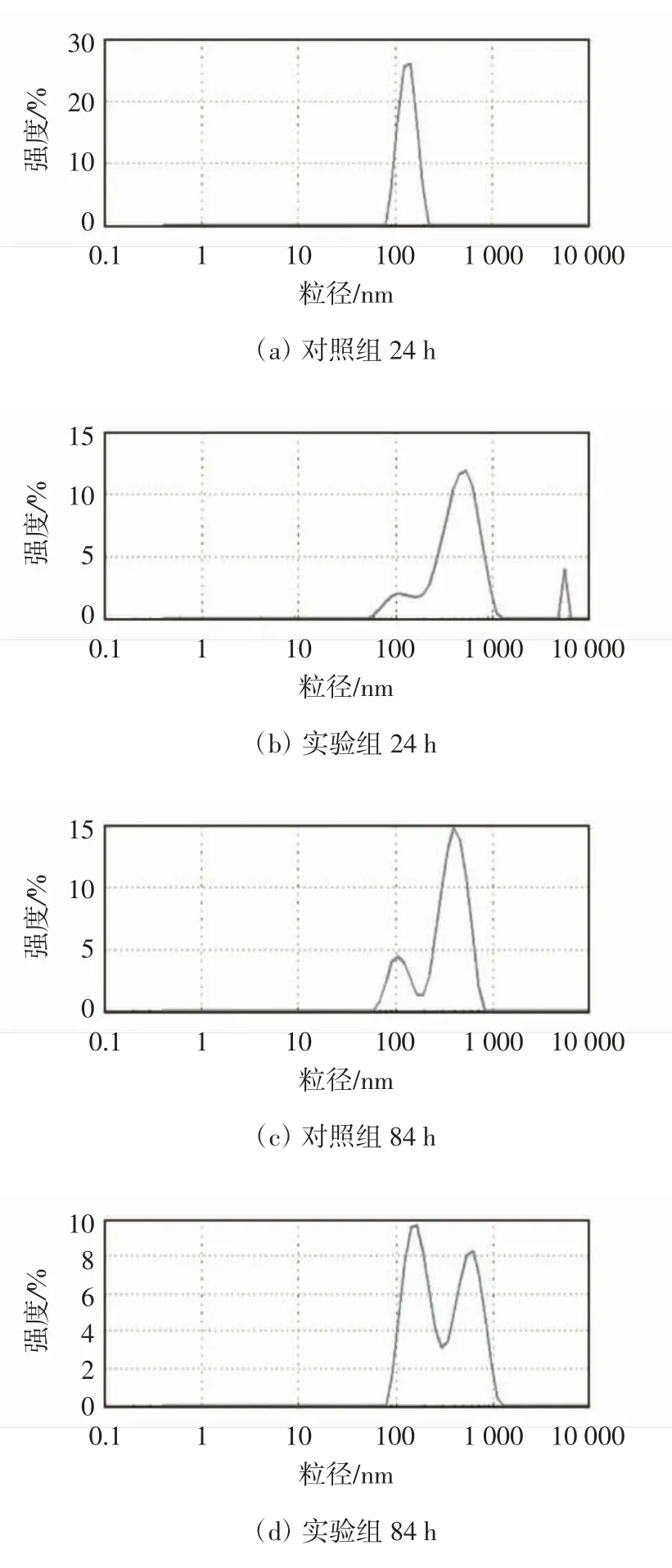
图5 SeNPs 粒径分析
由图5 可知,24 h 还原反应后,对照组和实验组合成的SeNPs 的平均粒径分别为120 nm 和655 nm左右.这表明TPPS 在调控亚硒酸盐生物还原速率的同时也会影响合成SeNPs 的粒径大小和分布. 24 h后,TPPS 调控SeNPs 的平均粒径变大,这与在24 h 内TPPS 可以加速亚硒酸盐还原的结果一致. 在24~84 h期间,对照组和实验组合成的SeNPs 的平均粒径分别为650 nm 和446 nm 左右,表明TPPS 可以调控SeNPs的粒径令其更小、更均匀.这就为人工调控合成纳米颗粒的尺寸提供了新的思路,即通过在生物合成体系投加不同种类介体或通过控制培养时间来进一步调控合成SeNPs 的尺寸.此前,Brown 等[18]发现一类胞外蛋白可以控制Au 纳米颗粒的形状尺寸,由此可以推断,TPPS 的加入可能影响了亚硒酸盐生物还原体系中微生物的胞外分泌物EPS,进而改变了SeNPs 表面的有机包覆层的成分从而间接导致SeNPs 粒径的不同.纳米材料的性能取决于它们的形状尺寸,从而表现出不同的光电特性[19].因此,模型卟啉类物质TPPS 具有用于人工合成具有独特光电特性的SeNPs 的应用潜能.
目前,多数研究表明纳米颗粒的生长机理可以用奥斯特瓦尔德熟化机制(Ostwald ripening)来描述.该过程致使大颗粒的生长依赖于小颗粒溶解并重新沉积在大颗粒上的过程称为奥斯瓦尔德熟化机制. 由此推测TPPS 调控的SeNPs 形成的机理可能为TPPS 通过影响SeNPs 表面有机包覆层的含量和组成,特别是对有机包覆层中蛋白质组分的影响,导致颗粒粒径和颗粒间静电力发生变化[20].故详细地了解此过程和该过程中的作用机制仍需要进一步更加深入的研究. 只有充分掌握生物合成纳米颗粒的形成和生长机制,才能更好地利用TPPS 控制纳米材料的尺寸和形态,满足所需的性能要求.
2.6 TPPS 对SeNPs 表面静电斥力及表面有机包覆层的影响
TPPS 对SeNPs 表面静电斥力及表面有机包覆层的影响如图6 所示.由图6a 可知,84 h 后,当pH 值的范围为6.0~10.0 时,对照组和加入了TPPS 的实验组合成的SeNPs 表面的zeta 电位值均为负值. 当pH 值的范围为6.0~10.0 时,对照组的zeta 电位值分别为-0.1,-4.2,-7.8,-10.2,-12.8 mV;相同pH 条件下,加入了TPPS 的实验组合成的SeNPs 表面的zeta 电位值分别为-10.3,-11.9,-11.8,-13.9,-14 mV. 由此可得,加入了TPPS 可使合成的SeNPs 表面zeta 电位值更低.类似的结果也出现在Russ 等[21]的研究中,他们发现生物合成的SeNPs 表面包覆有一层有机物质,且这种有机物质可以增加SeNPs 表面的静电斥力,从而使SeNPs 达到更加稳定的分散状态. 为了进一步分析这种有机包覆层的成分,分别对对照组和实验组的SeNPs 进行了傅里叶红外光谱分析. 如图6b 所示,两个亚硒酸盐生物还原系统中的SeNPs 的傅里叶红外光谱显示1 200 cm-1处代表P=O 伸缩[22],1 038 cm-1和1 050 cm-1代表C—O—C 变形. 峰值1 630 cm-1代表—C=O 拉伸峰值,峰值2 943 cm-1表示H—C—H伸展[23].这些官能团的存在表示该有机包覆层中含有碳水化合物[24],这证明了合成的SeNPs 表面由C、H、O 组成的有机包覆层的存在.同时,在1 552 cm-1和3 288 cm-1处的峰是氨基化合物的特征峰,这表明了有机包覆层中存在大量的蛋白质[25],且TPPS 加入使这几种化合物的特征峰值增大,含量增多,这种蛋白极有可能是催化亚硒酸盐生物还原并调控SeNPs 生物合成的某些胞外酶.
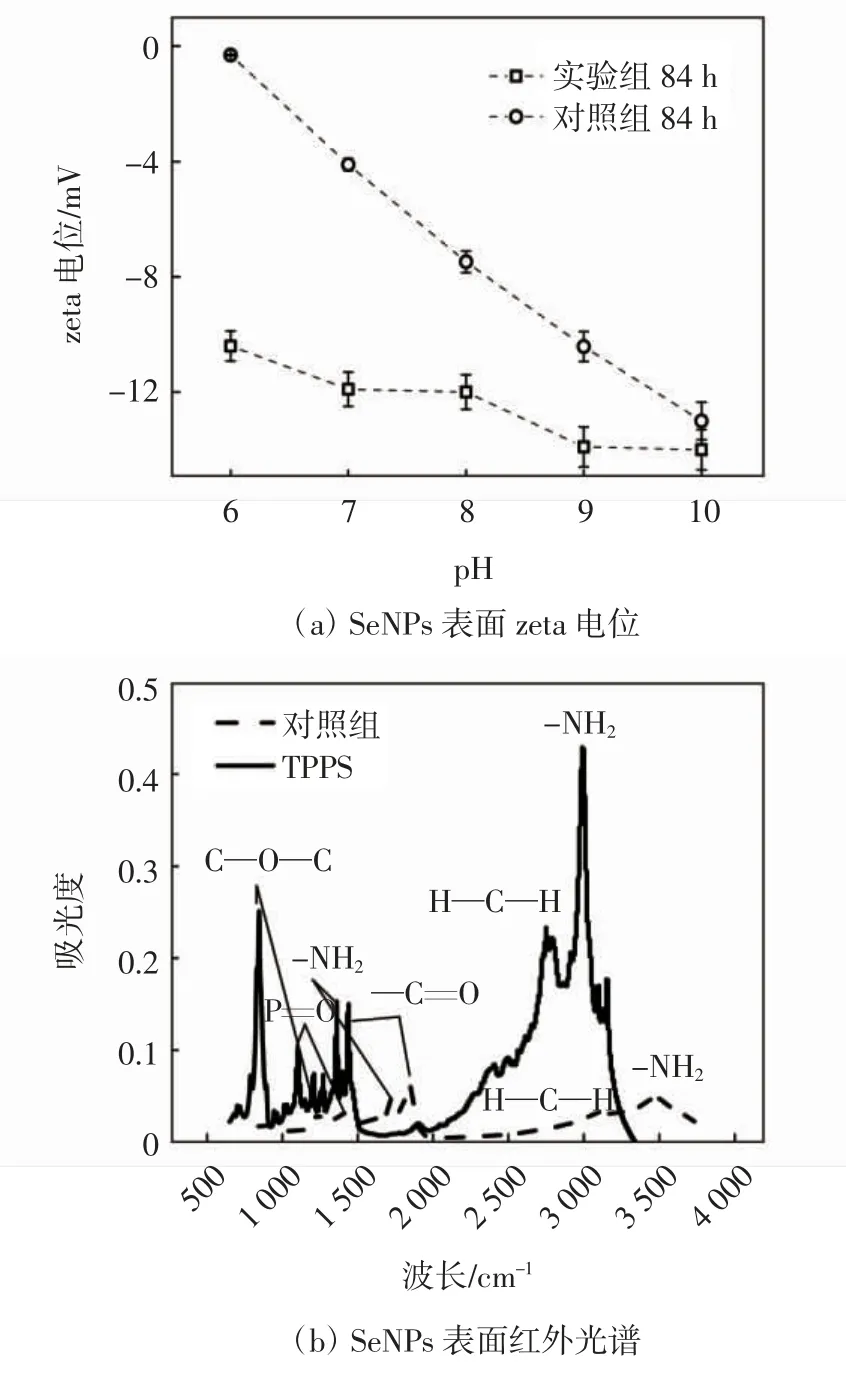
图6 SeNPs 表面静电斥力及包覆层特性
3 结 论
(1)卟啉TPPS 可以作为氧化还原介体对希瓦氏菌还原亚硒酸盐有加速作用.TPPS 调控亚硒酸盐的生物还原速率受到pH、温度、碳源种类的影响.TPPS 加速希瓦氏菌对亚硒酸盐的还原的最佳条件为:TPPS 投加浓度为200 μmol·L-1、pH 为8.0,温度为35 ℃,碳源为乳酸钠.
(2)TPPS 通过影响SeNPs 表面有机包覆层的蛋白质组分使颗粒粒径和颗粒间静电力发生变化. 加入TPPS 的生物还原体系中合成的SeNPs 表面的zeta 电位更低,粒径更小更均匀,颗粒分散更稳定.

