青蒿琥酯对人结肠癌细胞HCT116和HT29的增殖与凋亡*
贾文斌 孙欣 杜志杰 郭建昇
结肠癌是西欧、北美等发达国家最常见的恶性肿瘤,也是我国九大常见恶性肿瘤之一。在过去30多年的时间里,包括我国在内的多数国家或地区结肠癌发病率呈上升趋势。在我国因结肠癌死亡者,男性居恶性肿瘤死亡的第5位,女性居第6位。从流行病学的观点看,结肠癌的发病与社会环境、生活方式(尤其是饮食习惯、缺乏体力活动)、遗传因素有关。年龄、结直肠息肉史、溃疡性结肠炎及胆囊切除史也是结肠癌的高危因素[1-2]。但总体而言,结肠癌的病因似不十分清楚。60%以上结肠癌患者被确诊时已经失去根治手术机会,因此术后化疗成为主要治疗办法,但化疗药物的毒副作用及患者自身的耐药性是目前影响患者预后的相关因素。
青蒿素(artemisine)是从中药黄花蒿中提取的有过氧基团的倍半萜内酯抗疟新药。青蒿素是中国发现的第一个被国际公认的天然药物,在其基础上合成了多种衍生物,如双氢青蒿素、蒿甲醚、青蒿琥酯等。青蒿素类药物毒性低、抗虐性强,被WTO批准为世界范围内治疗脑型疟疾和恶性疟疾的首选药物[3]。除上述作用外,还发现青蒿素对白血病、黑色素瘤、结肠癌、前列腺癌和乳腺癌细胞株高度敏感,有效抑制癌细胞的增殖[4]。
1 材料与方法
1.1 实验材料
1.1.1 实验药物 青蒿琥酯(广西桂林南药股份有限公司,批号:LA120306)
1.1.2 实验仪器 CO2培养箱(Heal Force,型号:HP900),酶标仪(美国Thermo,型号:5250030),倒置显微镜(Olympus,型号:CKX41SF),流式细胞仪(美国B-D公司,型号:Facscalibur)。
1.1.3 实验试剂 人结肠癌细胞株HCT116和HT29细胞来自于山西医科大学细胞生理学省部共建教育部重点实验室,10%无支原体小牛血清(杭州四季青生物工程材料有限公司,批号:121004),噻唑兰(Biotopped,批号:410C055),二甲基亚砜 (Solarbio,批号:302A035),DMEM高糖培养基(Hyclone,批号:NYF0905),0.25% 胰酶(Hyclone,批号:NWM0527),凋亡检测试剂盒(南京凯基生物科技发展有限公司,批号:130605)。
1.2 实验方法
1.2.1 细胞培养 人结肠癌CHT116和HT29细胞复苏后采用RPMI 1640培养液、37 ℃、5%CO2培养箱中培养,2~3 d换液1次,取对数期生长细胞用于检测。每组实验重复3次。
1.2.2 MTT法检测细胞抑制率 取对数生长期细胞,调整细胞悬液密度为5×104个/mL,每孔200 μL铺于96孔板。培养24 h后细胞贴壁,弃去培养液,加入不同浓度(7.5、15、30、60、120 μg/mL)青蒿琥酯,每种浓度设5个复孔,每孔200 μL。同时设置空白孔(只加培养液)、阴性对照孔(只加细胞和培养液)。37 ℃、5%CO2:培养箱中分别培养48 h后弃去培养液,每孔加入20 μL MTT溶液(MTT质量浓度为5 mg/mL),继续培养4 h后终止培养。弃去培养液,每孔加入二甲基亚砜(DMSO)150 μL,于摇床低速振荡10 min。在酶标仪490 nm波长处测量每孔的吸光度(A)值。整理数据后计算细胞抑制率,使用SPSS 13.0软件计算IC50值。每组实验重复5次。
细胞抑制率=[1-(实验孔A值-空白孔A值)/(阴性对照孔A值-空白孔A值)]×100%。
1.2.3 流式细胞术检测细胞凋亡 取对数生长期的细胞,调整细胞悬液密度为1×105个/mL,每孔l mL接种于6孔板,每孔各加1 mL培养液,吹打均匀后放入37 ℃、5%CO2培养箱培养。单层细胞铺满板底后,加入不同浓度的青蒿琥酯培养液(0、60、120 μg/mL),继续培养24 h后收集细胞到10 mL离心管。每样本细胞数为1×106个左右。离心半径13.5 cm,1000 r/min离心5 min,弃去培养液,PBS 5 mL悬浮细胞。滤网过滤细胞悬液,离心半径13.5 cm,1000 r/min离心5 min,弃去上清液加入500 μL的Binding Buffer悬浮细胞;加入5 μL Annexin V—FITC混匀后,加入5 μL Propidium Iodide,混匀;室温避光,反应5~15 min;在1 h内,用流式细胞仪进行观察和检测。每组实验重复3次。
1.3 统计学处理 应用SPSS 13.0统计学软件对数据进行处理,计量资料以(±s)表示,组间比较采用单因素方差分析,组内两两比较采用LSD-t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 青蒿琥酯对细胞增殖的影响 人结肠癌细胞经不同浓度青蒿琥酯处理后,细胞生长受到不同程度的抑制(表1),且抑制程度随着药物浓度的增加而增强。不同浓度青蒿琥酯处理同种细胞后,抑制率间的差异具有统计学意义(P<0.05);相同药物浓度下两种细胞之间抑制率的差异有统计学意义(P<0.05)。青蒿琥酯作用HCT119和HT29细胞48 h后的IC50值分别为57.34 μmol/L 和 26.64 μmol/L。

表1 不同浓度Art对HCT116和HT29的抑制作用比较(x-±s)%
2.2 青蒿琥酯对人结肠癌细胞凋亡率的影响 随青蒿琥酯浓度升高,作用24 h后两种人结肠癌细胞的凋亡率均逐渐上升,加药组与阴性对照组凋亡率比较差异有统计学意义(P<0.05),见表2、图1~6。
3 讨论
目前手术、化疗、放疗仍是结肠癌治疗的主要方法,但中药因其独特的生物调节功能也日益发挥着突出的作用。青蒿琥酯作为一种中药成分,临床上主要用于抗疟疾方面的治疗。近年发现其能发挥一定的抗肿瘤作用。Therese Ericsson等[5]长期临床观察发现青蒿琥酯在乳腺癌患者中治疗中具有意义;Yang等[6]发现青蒿琥酯在细胞溶酶体中积累,促进溶酶体功能和铁蛋白退化,然后导致线粒体ROS生产和最终的细胞死亡;Serkan Sertel等[7]经基因检测得出5356的基因包含一个或多个结合位点的c-Myc/最大的上游该基因的位置,结论是c-myc和最大介导的转录控制基因表达可能有助于提高青蒿琥酯对癌细胞的治疗效果;Wai等[8]提出ART相关的化合物具有强效
性与细胞周期相关;梅昕等[9]采用逆转录-聚合酶联反应与酶联免疫吸附法检测得出青蒿琥酯可能通过抗炎及调节Treg/Th17平衡而发挥免疫作用;黄伟炜等[10]经细胞培养试验发现青蒿琥酯可明显抑制结肠癌HCT-8细胞的侵袭,其作用机制可能与其下调ICAM-1、VEGF165和Ang-2蛋白表达有关;朱天明等[11]提出青蒿琥酯能够抑制人胃癌细胞GC-7901的增殖,促进其凋亡,Caspase 3蛋白的高表达在促进SGC-7901细胞凋亡中起着重要作用;刘亮等[12]研究表明Art诱导Ec9706细胞凋亡的机制可能是通过降低细胞线粒体膜电位,启动内源性线粒体凋亡途径,激活Caspase-3蛋白,从而诱导细胞凋亡;孙雅洁等[13]采用四甲基偶氮唑盐法测定青蒿素、双氢青蒿素、蒿甲醚和青蒿琥酯体外抑制人肺癌细胞、人胃癌细胞、人结肠癌细胞、人红白血病细胞和人肝癌细胞的活性,认为青蒿素及其衍生物在体外对不同的肿瘤细胞有抑制活性作用;吴理茂等[14]检测青蒿琥酯对拓扑异构酶的影响显示,青蒿琥酯能提高DNA拓扑异构酶的活性,随着浓度的提高作用渐趋明显。本实验通过运用不同浓度的青蒿琥酯干预两种不同的人结肠癌细胞,发现其能抑制人结肠癌细胞的增殖。其抑制效应随着剂量增加而逐渐增强,60 μg/mL浓度的青蒿琥酯处理人结肠癌HCT116和HT29细胞48 h后抑制率可达74%左右,呈剂量依赖效应。青蒿琥酯作用HCT116和HT29细胞48 h后两种胃癌细胞的IC50值分别为57.34、26.64 μg/mL。表明青蒿琥酯对分化程度较低的人结肠癌细胞HCT116抑制作用较为明显。运用流式细胞术检测结果显示药物处理24 h后两种人结肠癌细胞凋亡率逐渐上升,呈剂量依赖效应,与对照组相比差异有统计学意义。

表2 不同浓度青蒿琥酯处理两种人结肠癌细胞24 h后的细胞凋亡率 %

图1 HCT116细胞阴性对照

图2 HCT116细胞30 μg/mL

图3 HCT116细胞60 μg/mL
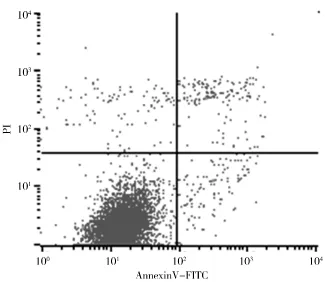
图4 HT29细胞阴性对照

图5 HT29细胞30 μg/mL

图6 HT29细胞60 μg/mL
青蒿琥酯不但在抑制癌细胞增殖及诱导细胞凋亡方面方面广受关注,而且还有报道指出青蒿琥酯可逆转肿瘤细胞多药耐药等作用[15-16]。术后化疗现在仍作为治疗中晚期结肠癌必不可缺的治疗手段之一,而现在肿瘤药物耐药性及副作用日趋明显,本试验通过对青蒿琥酯对人结肠癌细胞HCT116和HT29的增殖与凋亡,为青蒿琥酯在临床抗肿瘤应运提供可能,为今后关于结肠癌治疗的基础和临床研究提供一定的思路和方法。
[1]尹潞,代敏,李霓,等.德国肿瘤预防控制概况[J].中国肿瘤,2011,20(6):396-400.
[2]汪建平.重视结直肠癌流行病学研究[J].中国实用外科杂志,2013,33(8):622-624.
[3]刘爱菊.新药青蒿琥酯对抗重症疟疾效果优于奎宁[J].中华医学杂志,2011,91(27):1937-1937.
[4]王玮琴,殷红.青蒿琥酯对人白血病K562,K562/ADM细胞凋亡的作用及对NF-κB p65表达的影响[J].中国药师,2014,(5):729-731.
[5] Therese Ericsson, Antje Blank,Cornelia Von Hagens,et al.Population pharmacokinetics of artesunate and dihydroartemisinin during long-term oral administration of artesunate to patients with metastatic breast cancer[J].Eur J Clin Pharmacol,2014,70(12):1453-1463.
[6] Yang N D, Tan S H, Ng S,et al.Artesunate induces cell death in human cancer cells via enhancing lysosomal function and lysosomal degradation of ferritin[J].The Journal of Biological Chemistry,2014,10(564 567):1-32.
[7] Serkan Sertel,Tolga Eichhorn,Christian H, et al.Pharmacogenomic identification of c-myc/max-regulated genes associated with cytotoxicity of artesunate towards human colon[J].Ovarian and Lung Cancer Cell Lines, 2010,15(5):2886-2910.
[8] Wai M, Liu P,Andrew M,et al.The antimalaria l agent artesunate possesses anticancer properties that can be enhanced by combination strategies[J].International Journal of CancerInt,2011,128(5):1471-1480.
[9]梅昕,刘婧,白枚.青蒿琥酯的免疫抑制作用及其机制研究[J].中国药学杂志,2013,48(8):878-883.
[10]黄伟炜,牛红军,刘宁.青蒿琥酯对人结肠癌HCT-8细胞侵袭能力影响及机制研究[J].中成药,2011,33(8):2062-2064.
[11]朱天明,颜宏锐,胡金敏.青蒿琥酯对人胃癌 SGC-7901细胞增殖与凋亡及Caspase-3蛋白表达的影响[J].中国临床研究,2011,24(8):556-558.
[12]刘亮,左连富,王静.青蒿琥酯对食管癌Ec9706细胞线粒体膜电位及凋亡的影响[J].解放军医学杂志,2014,39(8):25-29.
[13]孙雅洁,王京燕.青蒿素及其衍生物体外抗肿瘤活性研究[J].解放军药学学报,2010,26(5):315-317.
[14]吴理茂,赵一,王勤,等.青蒿琥酯治疗肝癌的机理初探[J].中国中医基础医学杂志,2002,25(8):593-594.
[15]刘亮,左静,李金丫,等.青蒿琥酯逆转食管癌Eca109/ADN细胞对多柔比星的耐药[J].中国肿瘤生物治疗杂志,2011,18(2):155-159.
[16]吕翠岩,陈信义,唐炳华.青蒿素及其衍生物逆转肿瘤耐药作用初探[J].中国中医药信息杂志,2006,3(4):12-14.
——青蒿素

