冠脉显色指导下冠脉结扎法在制作大鼠心肌梗死模型中的应用*
许云俊 李兴岳 卢新林 梁伟钧
大鼠是常用来制作急性心肌梗死的模型动物。造模的方法多采用冠脉结扎法,部位为左冠状动脉前降支近段。大鼠模型心肌梗死面积大小差异也十分显著。Tucci[1]报道雄性成年大鼠的心梗造模存活率为56%、雌性成年大鼠存活率为83%,雄性成年大鼠建立心梗模型后,心肌经TTZ染色后测量心梗面积,得出其面积(40±19)%,变异系数(CV)=47%,跨越了大面积心肌梗死的界限值40%。65%存活的大鼠心肌梗死面积在45%以上,有1/3大鼠心梗面积低于40%,其后续研究发现大面积心肌梗死与非大面积心肌梗死在血流动力学上有着显著的差异。Luciano等[2]测得大鼠心梗面积为(21.7±22.0)%,CV=101%;Zornoff等[3]报道心梗面积为4%~65%;国内高琴等[4]研究得出大鼠术后6周的存活率为52.5%,心梗面积占左心室的(42±13)%,CV=31%;雷敬辉等[5]研究结论为术后4周的存活率为75%,心梗面积占左心室的(41±13)%,CV=32%。可见,急性心肌梗死模型建立后心肌梗死面积并不稳定,将导致后续实验结果数据的偏倚。心梗面积变异大的重要原因可能是左冠状动脉前降支走行的解剖变异,导致被结扎的冠状动脉供血区域大小不一。本研究从左冠状动脉解剖走行入手,试图找出结扎后心梗面积变异大的原因,并寻找一个理想的结扎点,减少结扎后心梗面积的变异。
1 材料与方法
1.1 实验材料及方法 12~14周龄雄性SD大鼠170只,体重320~380 g,由广东省实验动物中心提供[许可证号:SCXK(粤)2013-0002],饲养条件:室温(20±2)℃,相对湿度(60±10)%,室内保持12 h明/12 h暗昼夜交替;G-10琼脂糖(GENE美国);珠江牌蓝墨水。
1.2 方法
1.2.1 琼脂糖凝胶的配制 分别将琼脂糖0.5、1、1.5、2 g用双蒸水定容至50 mL,加入蓝墨水3 mL,加热煮沸,冷却至37 ℃保温备用,即为1%、2%、3%、4%液态琼脂糖凝胶。
1.2.2 大鼠离体心脏主动脉插管 大鼠颈椎脱臼处死后,开胸取出心脏,注意保留足够长升主动脉,插入直径为1.5 mm的PVC管至主动脉根部,20 mL肝素盐水冲洗冠脉后备用。SD大鼠8只分别用37 ℃ 1%、2%、3%、4% 4种不同浓度的琼脂糖凝胶行主动脉灌注,每组两只,观察其显色效果。2% 37℃琼脂糖凝胶主动脉灌注,压力为80 mm Hg,持续至冠脉远端充盈良好,保持灌注压力下立即置入室温生理盐水中冷却,滤纸吸干心脏表面水,数码相机拍照,多角度成像。
1.2.3 左冠脉结扎点的确定 选取101只大鼠不同心脏照片中相同角度的图片,使用ACDsee Pro 2.5及Office 2010软件处理,沿心缘剪切图片,使得每张图片尺寸相同,标记左心耳下缘至心尖中1/3区域供应左室游离壁及心尖的冠脉,将101张图片中的标记线叠合,可见线条最密集区域有两处,高位结扎点位于肺动脉圆锥左缘与左心耳下缘交点,低位结扎点位于左心耳下缘至心尖连线的中点的前室间沟左侧8~10 mm。
1.2.4 急性心肌梗死模型的制作 将60只SD大鼠按体重、窝别、周龄等因素均衡后随机分为两组。用1%戊巴比妥钠按45 mg/kg行腹腔注射进行麻醉,并同时腹腔注射青霉素10万单位,前胸备皮后仰卧固定,小动物呼吸机(泰盟科技有限公司 成都)接面罩行持续正压无创通气,气道压力8~12 cm H2O,消毒铺巾,按照Olivetti G法[6],左侧胸第4、5肋间隙切口开胸,逐层钝性分离胸壁,不剪断肋骨进入胸腔,剥离心包及脂肪组织,暴露心脏,于高位结扎点结扎大鼠左冠状动脉的前降支30例,低位结扎点结扎左冠状动脉左室支30例。结扎深度1 mm,宽度2~3 mm。观察左室游离壁及心尖的颜色、室壁运动变化。成功后,关闭胸腔,胸腔抽负压后,拔除胸腔引流管,呼吸机脱机,保温至麻醉清醒后单笼饲养。
1.2.5 N-BT染色测定心肌梗死面积 参照文献[7],术后第4天,颈椎脱臼法处死大鼠,取出心脏,用生理盐水冲洗干净心腔内积血,去除心房组织、右心室游离壁及脂肪组织后称重;将左心室平行左室横断面切成6~8片,浸入氯化硝基四氮唑蓝(NBT)磷酸缓冲液中,置37 ℃恒温水浴30 min,待染色完全后取出,正常心肌染成蓝色,缺血心肌或坏死心肌不染色。切下缺血心肌称重,用缺血心肌与左心室湿重百分比计算心肌梗死面积。
1.3 统计学处理 使用SPSS 13.0统计软件进行分析,计量资料以(±s)表示,比较采用t检验,计数资料以率表示,以P<0.05表示差异有统计学意义。
2 结果
2.1 不同溶度琼脂糖凝胶行主动脉灌注效果的比较 1%琼脂糖凝胶主动脉灌注后,冠脉着色的同时心肌也被染色,冠脉与背景不能形成鲜明的对比,冠脉显色模糊(图1a);2%琼脂糖凝胶主动脉灌注后,冠脉着色而心肌不被染色,冠脉与背景形成鲜明的对比,冠脉显色清晰(图1b);3%、4%琼脂糖凝胶主动脉灌注后,琼脂糖凝胶不能充盈冠脉远端,冠脉远端不能显示(图1c、图1d)。具体见图1。
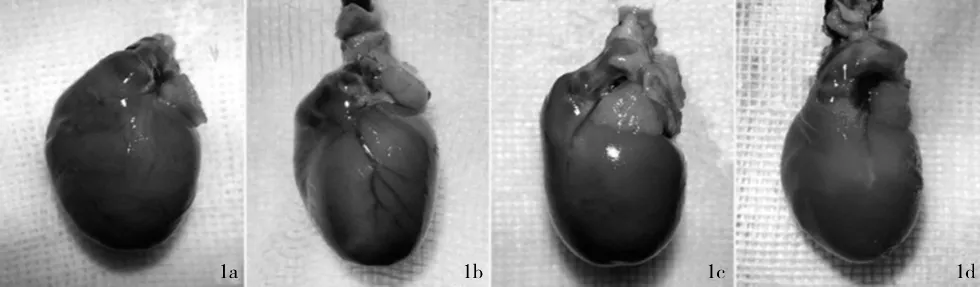
图1 不同溶度琼脂糖凝胶行主动脉灌注效果
2.2 左冠状动脉及分支走行情况 采用2%琼脂糖凝胶行主动脉灌注后,可见冠脉走行分为4种类型。类型a:左冠状动脉主干从左心耳后方发出后即分为前降支和回旋支,前降支延续为左室支(图2a);类型b:左主干发出后直接延续为左室支至心尖(图2b);类型c:左主干延续为前降支后分为3~5支供应左室游离壁及心尖(图2c);类型d:左主干延续为前降支后沿前室间沟走行,沿途垂直发出3~5个分支(图2d)。具体见图2及表1。

表1 101只大鼠冠脉走行4种类型所占比例
2.3 N-BT法检测大鼠心肌梗死面积 大鼠心肌梗死模型术后第4天,处死大鼠,取出心脏,行N-BT染色。具体见图3。
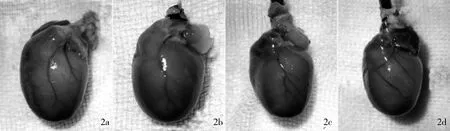
图2 左冠状动脉及分支走行情况

图3 N-BT法检测大鼠心肌梗死面积
2.4 高位结扎与低位结扎存活率、梗死面积的比较 高位结扎30例大鼠,死亡13例;11例结扎后数分钟内出现的室颤,立即捏闭术口行胸外心脏按压,3例存活,8例死亡;3例为术中损伤肺动脉圆锥出现大出血,1例麻醉过深,过早撤离呼吸机,呼吸衰竭死亡。低位结扎30例,死亡4例,2例麻醉过深,过早撤离呼吸机,呼吸衰竭死亡,1例出现室颤,1例术后第2天死亡,死因不明。所有大鼠均为无创通气辅助呼吸,术中未出现呼吸机辅助呼吸相关的不良事件。高位结扎制作的心梗模型组梗死面积大于低位结扎组(P<0.01)。高位结扎组及低位结扎组心肌梗死面积的变异系数均小于文献报道中的各值,该方法结扎的稳定性较好。见表2。
3 讨论
急性心肌梗死是临床上常见病与多发病。实验性心肌梗死动物模型的制备是研究缺血性心脏病发病与治疗机理的重要手段与工具。杨永辉等[8]利用新西兰兔建立急性心肌梗死的简易模型,但存在费用高,冠脉侧枝循环多等不利情况,不能广泛应用于实验,而大鼠具有优势。建立模型的方法多种多样,由于结扎冠脉所形成的心肌梗死或心肌缺血最接近急性心肌梗死的病理及病理生理过程,因此造模多选择冠脉结扎法。但是该模型制作方法存在需要气管插管或气管切开下呼吸机支持、造模后动物存活率低、心肌梗死面积大小不一等问题。卢新林等[9]采用面罩接呼吸机无创通气行呼吸支持能减少实验动物的死亡率,本研究亦采用该方法。为解决结扎冠状动脉制作在体大鼠心梗模型存在的问题,需要寻找导致问题的根源。由于大鼠冠状动脉位于心外膜下,动脉血液充盈下肉眼下无法与其同样呈鲜红色的背景心肌组织辨认出来。能较易看到的是静脉,因其呈暗红色,可与背景心肌组织区别开来。因此,结扎冠状动脉就存在盲目性,这是以往造模失败的主要原因[10]。Degabriele等[11]研究显示建模的成功率,心功能及梗死程度主要取决于结扎的部位。在心梗模型建立过程中,冠脉结扎位置的选择上报道存在差异,Miyahara等[12]选择距离肺动脉圆锥与左房交界(冠脉起始处)的远端2~3 mm处结扎;而Vakeva等[13]选择在冠脉起始处远端3~4 mm结扎。国内的文献报道亦是众说纷纭。到底在哪结扎,取决于左侧冠状动脉的解剖位置。因此,能在新鲜的心脏标本上显示出冠脉的走行尤为重要。
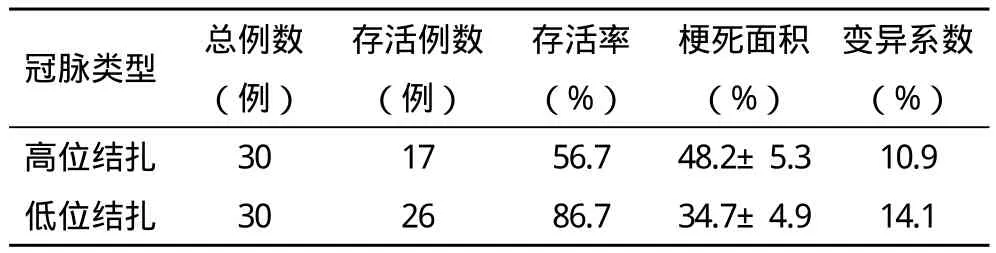
表2 高位结扎与低位结扎结果在存活率、梗死面积的对比
本研究利用2%琼脂糖凝胶的特性,高温下呈液态,从主动脉根部灌注时能充盈冠脉系统,冷却至室温时呈固态,加入蓝墨水后能很好的与背景心肌的鲜红色形成对比,从而能清楚地显示出冠脉的走行。1%的琼脂糖灌注时由于其黏度较低,迅速将心肌染色蓝色,不利于作为背景与冠脉的蓝色对比。3%以上的琼脂糖凝胶粘度过高,不能较好的充盈冠状动脉的远端,不能显示出整个冠脉系统。101只大鼠心脏标本均通过该方法清楚地显示出冠脉的走行情况。可见左侧冠脉的走行有4种类型,解剖变异非常大。姜宗来等[14]研究大鼠冠脉铸型亦得出类似结果,因此结扎后心梗面积大小不一与之密切相关。如何能消除解剖变异导致的结扎后心梗面积不稳定,需要找到一个或多个结扎点,使得各种类型的大鼠左冠状动脉同一节段都通过改点。用图像叠合的方法可以看出大鼠左冠状动脉有两个点重叠最显著。其一为高位结扎点,即为左心耳根部与肺动脉圆锥左缘的交点;其二为低位结扎点,左心耳下缘至心尖连线的中点的前室间沟左侧8~10 mm。本研究从两个结扎点各造模30例,可见高位结扎点能建立大面积心肌梗死模型,N-BT染色测量心梗面积为42.9%~53.5%,标准差为5.3;低位结扎点结扎亦能稳定的心梗模型,心梗面积为29.8%~39.6%,标准差为4.9。高位结扎虽能获得更大面积的心梗模型,但由于梗死面积过大,易导致术中室颤,且结扎点离肺动脉圆锥近,该处心肌组织菲薄,可能至右室流出道穿孔,大大降低大鼠心梗模型的存活率;相反,结扎低位结扎点由于梗死心肌有限,不易发生室颤,且此处为左室壁,心肌厚,不易出血,亦能较好的满足实验的需要。
综上所述,大鼠左侧冠状动脉解剖变异是心梗模型的心梗面积大小不一的重要原因,高位结扎与低位结扎均能获得心梗面积稳定的大鼠模型。但本研究未进一步从血流动力学、心室重构、心脏功能等方面研究高位结扎与低位结扎是否存在显著差异,需要进一步研究。冠脉显色指导下冠脉结扎法在制作大鼠心肌梗死模型值得推广。
[1] Tucci P J.Pathophysiological characteristics of the post-myocardial infarction heart failure model in rats[J].Arq Bras Cardiol,2011,96(8):420-424.
[2] Luciano F L, Jorge M, Eduardo E V,et al.Myocardial infarction area quantification using high-resolution SPECT images in rats[J].Arq Bras Cardiol, 2013,101(1):59-67.
[3] Zornoff L A, Paiva S A, Minicucci M F, et al.Experimental myocardium infarction in rats:analysis of the model[J].Arq Bras Cardiol,2009,93(9):434-436.
[4]高琴,关瑞锦.心力衰竭大鼠模型的制作及意义[J].心血管康复医学杂志,2004,13(1):27-30.
[5]雷敬辉,康玉明.充血性心力衰竭大鼠模型制备的改进[J].山西医科大学学报,2008,39(9):769-771.
[6] Olivetti G,Capasso J M,Meggs L G,et al.Cellular basis of chronic ventricular remodeling after myocardial infarction in rats[J].Circ Res,1991, 68(12):856-869.
[7] DerIas N W, Adams C W.Macroscopic enzyme histochemistry in myocardial infarction:use of coenzyme, cyanide, and phenazine methosulphate[J].Clin Pathol,1982,35(13):410-413.
[8]杨永辉,李彤,赵越,等.一种简易兔心肌梗死模型的建立[J].中国医学创新,2012,9(10):1-3.
[9]卢新林,岳玉霞,严泉祥,等.在无创性通气条件下快速建立小鼠心肌梗死模型的简易方法[J].中国医学创新,2014,11(30):23-26.
[10]李昌繁,江时森.心力衰竭动物模型的研究进展[J].医学研究生学报,2007,20(5):532-534.
[11] Degabriele N M, Griesenbach U, Sato K, et al.Critical appraisal of the mouse model of myocardial infarction[J].Exp Physiol, 2004, 89(4):497-505.
[12] Miyahara Y, Nagaya N, Kataoka M., et al.Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction[J].Nat Med, 2006, 12(4) :459-465.
[13] Vakeva A P, Agah A, Rollins S A, et al.Myocardial infarction and apoptosis after myocardial ischemia and reperfusion:role of the terminal complement components and inhibition by anti-C5 therapy[J].Circulation, 1998, 97(22):2259-2267.
[14]姜宗来,胡海涛.大鼠冠状动脉的解剖观察[J].解剖学报,1984,15(2):136-141.

