辣椒素受体在大鼠坐骨神经损伤再生过程中的作用研究*
张宏 齐超 钱贝 刘俊肖 张华 乔晓玲 李夏青
辣椒素受体(Capsaicin receptor)是一种可被辣椒素激活的非选择性阳离子通道,属于瞬时感受器电 位 通 道(transient receptor potential channels, TRP channels)家族,又称为瞬时受体电位香草酸受体1(transient receptor potential vanilloid 1,TRPV1)。 由Aδ类和C类神经纤维支配的组织几乎都有TRPV1分布[1],TRPV1可被辣椒素、热刺激、低pH和源于多巴胺的内源性脂质激活,被认为是有害物理、化学刺激信号的整合器,也称之为伤害性感受器(noxious sensor)。目前认为,TRPV1主要参与痛觉的传导,与痛觉的产生和痛觉增敏密切相关。然而,也有文献[2]报道TRPV1与CGRP、TrkA等与神经再生有关的物质存在密切关系。因此推测TRPV1有可能参与/干预神经损伤与再生过程。为此本研究基于坐骨神经压榨性损伤的在体模型,在损伤前给予TRPV1阻断剂以观察TRPV1对坐骨神经压榨性损伤后再生过程的影响。
1 材料与方法
1.1 材料
1.1.1 动物来源 中国人民解放军军事医学科学院实验动物中心提供SPF级SD大鼠24只,体重(190±10)g,许可证编号SCXK(军)2007-004。
1.1.2 主要试剂和仪器来源 AMG-517(Selleck Chemicals,USA),微量注射器(上海注射器三厂提供),甲苯胺蓝(北京化工厂提供),光学显微镜(Olympus,日本),戊二醛、锇酸、二甲胂酸钠由本校中心实验室提供。
1.2 方法
1.2.1 动物模型制备 雄性SD大鼠(180~200 g)24只,随机分为单纯损伤组和给予拮抗剂组(AMG517组),每组12只,每组均设1周、2周时间段。1%戊巴比妥钠(40 mg/kg)腹腔麻醉。其中,给予拮抗剂组于损伤前1 h用微量注射器于右后肢足底皮下注射AMG517(300 μg/kg)[3];单纯损伤组于损伤前于右后肢足底皮下按同等标准注射生理盐水。右后肢脱毛、消毒,股部行纵形切口切开皮肤约1.5 cm,延肌间隙分离筋膜、肌肉,暴露坐骨神经,在距梨状肌下缘5 mm处用止血钳夹闭坐骨神经60 s。逐层缝合后单独饲养。
1.2.2 标本的制备 在预计的观察时间点麻醉动物,除去双后肢被毛,行股后部纵形切口切开皮肤,分离筋膜、肌肉,充分暴露并游离坐骨神经,从梨状肌下缘至坐骨神经分叉处将其剪下,右侧再分别分为近、中、远约0.5 mm各三段,放入4%戊二醛中,4 ℃条件下放置3 h后,放入0.1 mol/L二甲胂酸钠(pH=7.3)漂洗5次,1%锇酸固定2 h,双蒸水漂洗后梯度酒精脱水。环氧树脂包埋。
1.2.3 半薄切片制作及甲苯胺蓝染色 使用超薄切片机上分别对所取标本连续切取8~10张1 μm横切面(其中右侧标本均于靠近损伤部位切取),放在滴有1滴蒸馏水的干净载玻片上,酒精灯烘干,滴加1%甲苯胺蓝染液,间断加热至染液微干,洗瓶冲洗掉多余染液,滤纸吸去多余水分,晾干后中性树脂封片。
1.2.4 神经纤维计数 染色后Olympus显微镜观察,JVC显微摄像仪摄取图像。每个标本选取6张横切面记数神经纤维数目。
1.3 统计学处理 采用graph-pad prism 5.0统计学软件对数据进行处理,计量资料以(±s)表示,比较采用ANOVA检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 正常坐骨神经半薄切片特征 神经纤维髓鞘密集,排列规则。总体特征见图1。
2.2 坐骨神经压榨性损伤后神经纤维数量变化 损伤近端与正常坐骨神经相比,神经纤维数量减少。损伤中心及损伤远端在损伤1周后可见大量髓鞘崩解产物和炎细胞浸润,2周后可见施万细胞(Schwann cell)包绕的新生有髓纤维。见图2~4、表1。
2.3 损伤前给予AMG517对神经轴突再生的影响损伤前给予AMG517,术后2周时,神经纤维数目多于单纯损伤组(P<0.01),且排列规则。术后1周时,损伤前是否给予AMG517对神经纤维数目无明显影响(P>0.05)。见图2~4、表1。
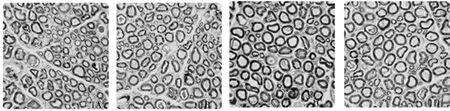
图1 健侧坐骨神经半薄切片甲苯胺蓝染色(×1000)注:图1A、1B为单纯损伤组,图1C、1D为给予拮抗剂再损伤组;图1A、1C为术后1周,图1B、1D为术后2周

表1 各组神经纤维数目(x-±s) 个

图2 坐骨神经损伤近端半薄切片甲苯胺蓝染色(×1000)注:2A、2B为单纯损伤组,2C、2D为给予拮抗剂再损伤组;2A、2C为术后1周,2B、2D为术后2周;损伤近端损伤后2周神经纤维数目与1周相比差异不明显;相同时间点上,单纯损伤组与给予拮抗剂组神经神经纤维数目差异不明显

图3 坐骨神经损伤中心半薄切片甲苯胺蓝染色(×1000)注:3A、3B为单纯损伤组,3C、3D为给予拮抗剂再损伤组;3A、3C为术后1周,3B、3D为术后2周;术后1周时,损伤中心可见大量髓鞘崩解产物和炎细胞浸润;术后2周时,给予拮抗剂组的神经神经纤维数目多于单纯损伤组,且排列较为规则

图4 坐骨神经损伤远端半薄切片甲苯胺蓝染色(×1000)注:4A、4B为单纯损伤组,4C、4D为给予拮抗剂再损伤组;4A、4C为术后1周,4B、4D为术后2周;术后1周时,损伤远端可见大量髓鞘崩解产物和炎细胞浸润;术后2周时,给予拮抗剂组的神经神经纤维数目多于单纯损伤组,且排列较为规则
由表1可以得出,健侧、损伤近端各组比较差异无统计学意义(P>0.05);损伤中段:单纯损伤组1周与2周、AMG517组1周与2周、单纯损伤2周与AMG517组2周,两两比较差异均有统计学意义(P<0.01),后者神经纤维数目多于前者,其余组别间无统计学差异(P>0.05);损伤远端:单纯损伤组1周与2周、AMG517组1周与2周、单纯损伤组2周与AMG517组2周,两两比较差异均有统计学意义(P<0.01),后者神经纤维数目多于前者,其余组别间无统计学差异(P>0.05)。
3 讨论
辣椒素受体(TRPV1)属于TRP通道家族,是TRPV子族的首位成员,也是哺乳动物6种热敏通道之一。它有6个跨膜区,其中在第5和第6个跨膜区之间有一个短的孔状疏水结构,此结构参与并调控了辣椒素激活 VR1 的过程。其氨基末端的亲水区(432个氨基酸)包含了一个脯氨酸富集区,其连接了3个钩状重复区域,据推测可能参与了受体蛋白之间的相互作用;羧基末端(154个氨基酸)包含了一些不可识别的基序[4]。
研究发现,由Aδ类和C类神经纤维支配的组织,几乎都有TRPV1分布,包括神经系统、呼吸系统、消化系统、心脑血管系统和泌尿等系统。如脑内的大脑皮质、下丘脑和背侧丘、小脑皮质、纹状体、嗅核、中脑、嗅球、脑桥、蓝斑、海马和导水管周围灰质等脑区,以及脊髓和感觉神经节(背根神经节和三叉神经节)都有表达[5]。除辣椒素外,TRPV1还可被热刺激(≥43 ℃)以及多种化学物激活,包括内源性大麻素、大麻素、外用止痛药、崁酮、胡椒碱、蒜素。有害性化学物质或热刺激引起的TRPV1介导的阳离子流,会因为低pH值而得到加强。实际上,与损伤相关的组织酸中毒(pH≤5.9)这一特征性状态,会引起TRPV1热活化阈值的改变,所以TRPV1才会在室温状态下被激活。TRPV1活化阈值的改变和辣椒素介导的反应的增强也可由酒精、尼古丁、炎症细胞因子引起。此外,缓激肽、神经生生长因子等一些促进痛觉形成的物质,可以活化磷脂酶C,继而引起的PIP2水平下降以及PKC介导的对TRPV1受体的磷酸化作用,两者均可使TRPV1的活性增强。所以,TRPV1是一个多种信号的整合器,可以转换由多种伤害性刺激诱发产生的信号[6]。一些TRPV通道的功能受到嵌入或停留在浆膜的调节。TRPV1与神经胞吐蛋白(SNARE)依赖的胞吐途径中的一些成分相互作用,这些相互作用可以促进PKC介导的TRPV1向胞膜的迁移。而且,促痛因子如神经生长因子可通过酪氨酸激酶介导的对TRPV1的酪氨酸磷酸化作用促进TRPV1向胞膜表面的嵌入[7]。最近有研究发现,TRPV1与突触前、突触后蛋白质共存于脊髓皮质神经元中,并能影响脊髓形态。而且,TRPV1存在于内生的突触小体里。在背根神经节来源的一种细胞系里,TRPV1富集于细长的丝状伪足以及细胞接触部位。而且在突触的转运小体、丝状伪足的传输小泡中、神经突中也检测到TRPV1。TRPV1的激活可快速调节这些囊泡的循环和融合,使得丝状伪足结构得到快速重组。说明TRPV1参与了神经网络的形成、突触调节、神经递质释放等过程[8]。而且TRPV1跟降钙素基因相关肽(CGRP)、神经营养因子受体(TrkA)等与神经再生有关的物质存在密切关系。因此推测TRPV1可能参与了神经再生。已经证实CGRP与感觉信息,特别是伤害性刺激信息的传入与整合关系密切、是参与疼痛信号传导的主要分子之一,且实验也已证实CGRP与TRPV1免疫共定位于Aδ与C纤维的感觉神经细胞[2]。近10多年CGRP在神经损伤及再生过程中的作用受到了广泛重视。周围神经压榨损伤后,残留的未损伤神经纤维及相应背根神经节细胞(Dorsal root ganglia, DRG)CGRP的表达上调[9],这种上调提示CGRP可能参与了早期向中枢传递损伤信号并可能参与激活或诱导神经再生的信号转导机制。表达CGRP的DRG神经元中有84%同时可以表达TrkA;大多数CGRP免疫荧光阳性神经元也同时为TRPV1阳性[10]。全身应用辣椒素可使感觉神经元CGRP大量释放而耗竭同时伴有TrkA表达下降,这种现象可通过给予NGF后逆转[11]。有人提出TRPV1激活所引起的钙调素依赖性蛋白激酶/cAMP反应元素结合蛋白(Ca2+/calmodulin-dependent protein kinases Ⅱ/cAMP responsive element binding protein,CaMK Ⅱ/CREB)磷酸化的增加是导致感觉神经元CGRP合成增加的机制之一[12]。而NGF通过其受体-TrkA促神经元存活及神经突起再生的信号机制目前认为主要与有丝分裂原激活的蛋白激酶(The mitogen-activated protein kinases,MAPKs) 信号通路蛋白ERK1/2(extracellular signal-regulated kinase 1/2)及 JNLs(c-Jun N-terminal kinases)的磷酸化增强有关[13];也有人认为非钙依赖性磷酸肌醇酯-激酶(3phosphoinositide-3 kinase,PI3K)及其相关下游信号通路蛋白(Akt/PKB)的激活也是神经营养因子促使神经再生及分支的机制之一[14]。
辣椒素受体作为一种多型信号探测器及多种疼痛感受器,虽然上世纪末才被成功克隆,却因其生物学特点,成为现今最受关注、得到研究最为广泛的非选择性阳离子通道之一,以其为靶点的临床药物研究也同样开展广泛[15]。本实验采用坐骨神经压榨性损伤在体模型,观察使用或不使用TRPV1拮抗剂阻断该受体前提下,受损神经的不同修复情况,以探讨其对神经损伤后再生的影响。本实验表明,在阻断TRPV1的条件下,再生有髓神经纤维数目多,排列规则。可见阻断TRPV1有利于大鼠坐骨神经压榨性损伤后的修复。
可以提出以下设想:神经损伤局部由于各种伤害性物质的产生可导致TRPV1体激活;激活的TRPV1可通过与TrkA相似的细胞内信号转导机制MEK/MAPK-ERK或PI3K/Akt(PKB)等影响包括CGRP在内的与轴突再生有关的细胞结构合成及表达增加,以此参与神经再生过程。实验结果提示,作为新一代镇痛药物的TRPV1拮抗剂,是否有可能在临床应用中作为有利于神经损伤后修复的药物来使用。
[1] LUO Xiu-ju, PENG Jun, LI Yuan-jian.Recent advancesin the study on capsaicinoids and capsinoids[J].Eur J Pharmacol, 2011, 650(1):1-7.
[2] Horie S,Michael G J,Priestley J V.Co-localization of TRPV1-expressing nerve fibers with calcitonin-gene-related peptide and substance P in fundus of Rat Stomach[J].Inflammopharmacology,2005,13(1-3):127-137.
[3] Wanner S P, Garami A, Pakai E, et al.Aging reverses the role of the transient receptor potential vanilloid-1 channel in systemic inflammation from anti-inflammatory to proinflammatory[J].Cell Cycle,2012,11(2):343-349.
[4]骆昊,万有,韩济生.辣椒素及其受体[J].生理学进展,2003,34(1):11-15.
[5] ALAWI K, KEEBLE J.The paradoxical role of the transient receptor potential vanilloid 1 receptor in inflammation[J].Pharmacol Ther,2010,125(2):181-195.
[6] Venkatachalam K, Montell C.TRP channals[J].Annu Rev Biochem,2007,76(1):387-417.
[7] Morenilla-Palao C, Planells-Cases R, Garcia-Sanz N,et al.TRV1 involvement in inflammatory pain:mechanisms and pharmacological modulation[J].Journal of Neurochemistry ,2003,85(2):65-72.
[8] Goswami C,Rademacher N, Smalla K H.TRPV1 acts as a synaptic protein and regulates vesicle recycling[J].J Cell Sci,2010,123(12):2045-2057.
[9] Li X Q, Verge V M K,Johnsion J M,et al.CGRP peptide and regenerating sensory axons[J].J Neuropathol Experi Neurol,2004,63(10):1092-1103.
[10] Aoki Y, Ohtori S, Takahashi K, et al.Expression and CoEexpression of VR1,CGRP,and IB4binding glycoprotein in dorsal root ganglion neurons in rats:differences between the disc afferents and the cutaneous afferents[J].Spine,2005,30(13):1496-1500.
[11] Ruiz G,Banos J E.The effect of endoneurial nerve growth factor on calcitonin gene-related peptide expression in primary sensory neurons[J].Brain Res, 2005,1042(1):44-52.
[12] Nakanishi M,Hata K,Nagayama T.Acid activation of TRPV1 leads to an up-regulation of calcitonin gene-related peptide expression in dosal root ganglion neurons via the CaMK-CREB cascade:a potential mechanism of inflammatory pain[J].Mol Bio Cell,2010,21(15):1568-2577.
[13] Waetzig V, Loose K, Haeusgen W, et al.c-Jun N- terminal kinases mediate Fas-induced neurite regeneration in PC12 cells[J].Biochem Phamacol,2008,76(11):1476-1484.
[14] Gallo G, Letourneau P C.Localized sources of neurotrophins initiate axon collateral sprouting[J].J Neurosci,1998,18(14):5403-5414.
[15]李魁君,李春刚,刘兴君.辣椒素受体(TRPV1)的生物学作用及其作为药物靶点的研究进展[J].沈阳药科大学学报,2011,28(11):917-927.

