牛大力糖蛋白的分离、鉴定及抗氧化活性*
赵强忠 冯梦莹 林恋竹 赵谋明
(华南理工大学 轻工与食品学院, 广东 广州 510640)
牛大力糖蛋白的分离、鉴定及抗氧化活性*
赵强忠 冯梦莹 林恋竹 赵谋明†
(华南理工大学 轻工与食品学院, 广东 广州 510640)
为深入了解牛大力糖蛋白的结构组成、理化性质和生物活性,根据牛大力粗糖蛋白(MSCG)的分子质量分布情况,采用超滤、凝胶柱层析(Sephadex G-75)、反相C-18色谱柱层析(ODS)方法,对牛大力粗糖蛋白进行分离纯化,得到两种组分MSCG-1和MSCG-2.通过HPLC、GC、GC-MS、红外光谱等方法对两种组分的结构进行了鉴定.结果表明:MSCG-1的分子质量约为62.0 ku,MSCG-2的分子质量约为1.94 ku;MSCG-1含50.22%的蛋白质和38.07%的糖,糖链主要由→4,6)-Galp-(1→和Araf-(1→构成;MSCG-2含69.37%的蛋白质和6.70%的糖,糖链由→6)-Glcp-(1→构成主链,糖链分支度高;MSCG-1和MSCG-2中都含有O-糖肽键.MSCG-2中含有的可能对抗氧化有贡献的氨基酸总量比MSCG-1中的高31.3%;MSCG-1和MSCG-2的氧自由基吸收能力分别为(56.10±18.49)和(1 077.19±60.82) μmol/g;MSCG-2的抗氧化活性明显高于MSCG和MSCG-1,说明糖蛋白的分子组成、分子质量大小及结构特性决定了其抗氧化活性.
牛大力;糖蛋白;分离;纯化;结构鉴定;抗氧化剂
牛大力(MillettiaSpeciosaChamp.)为蝶形花科鸡血藤属,其干燥根可入药,性味甘、平,具有补虚润肺、强筋活络等功用,药用历史悠久,临床上证明其对多种慢性疾病(如腰痛、肾虚带下、风湿性关节炎、腰肌劳损、慢性肝炎、病后体虚等)有治疗作用[1].近年来的研究表明,牛大力具有提高免疫、抗氧化、祛痰、镇咳、平喘及保肝作用[2].
目前对牛大力的研究主要集中在种植、培养等方面,对其含有的有效成分的结构、活性研究则较少.对牛大力水提物的研究主要包括牛大力多糖的提取、部分活性探讨及初步的结构鉴定,对牛大力醇提物的研究则主要集中在结构鉴定方面.
糖蛋白具有广泛的生物活性和复杂的结构,目前尚未见有关牛大力糖蛋白的研究报道.文中重点研究牛大力糖蛋白的分离纯化方法,进一步对其结构进行了鉴定,并初步探讨了其抗氧化活性,以期为牛大力资源的开发和综合利用提供理论依据.
1 实验
1.1 原料与试剂
以海南野生牛大力块根为原料.
主要试剂如下:水溶性维生素E(Trolox)、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)、荧光黄(Fluorescein)、各单糖标准品、肌醇,购于美国Sigma-Aldrich公司;Sephadex G-75凝胶、十八烷基硅胶(ODS),购于GE Healthcare Life Science公司;三氟乙酸、冰乙酸、盐酸、氢氧化钠、苯酚、三氯甲烷、正丁醇、无水乙醇、盐酸羟胺、吡啶、二氯甲烷、醋酸酐、二甲基亚砜、碘甲烷、硼氢化钠、无水硫酸钠,均为分析纯;甲醇,色谱纯.
1.2 实验方法
1.2.1 牛大力粗糖蛋白的制备工艺
牛大力块根干燥后,切片粉碎,过60目筛.粉末按照1∶6的料液比(质量(g)与体积(mL)的比例)加入95%乙醇微沸回流提取3 h以脱脂、脱色.趁热过滤,留下残渣,置烘箱中于50 ℃干燥并除去残留乙醇.经脱脂脱色后的牛大力块根粉末用超声辅助热水提取糖蛋白,条件如下:超声时间30 min,料液比1∶20,超声功率800 W,提取温度55 ℃.经抽滤得到牛大力提取液,提取液经50 ℃减压浓缩至一定体积后,用Sevage法除去游离蛋白质.将除去游离蛋白后的提取液加入4倍体积的无水乙醇,冷藏静置后得到沉淀,离心除去上清液,经冷冻干燥得到淡黄色粗糖蛋白粉末,命名为MSCG.
1.2.2 牛大力糖蛋白的分离纯化工艺
使用截留分子质量为10 ku的超滤膜分离MSCG,得到截留液与透过液.截留液经Sephadex G-75凝胶柱层析分离,将去离子水洗脱的第一个峰命名为MSCG-1;透过液经反相C-18色谱柱层析(ODS)分离,将10%乙醇洗脱组分命名为MSCG-2.
1.2.3 纯度鉴定
[3]方法,通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)对牛大力糖蛋白进行纯度检验.其中分离胶和浓缩胶的含量分别为150和50 g/L,采用考马斯亮蓝染色.
1.2.4 分子质量测定
采用高效液相色谱(HPLC)法测定分子质量.色谱柱为TSK-G2000SWXL,检测器为示差检测器,流动相为加1‰ TFA的磷酸盐缓冲液(20 mmol/L),进样量为10 μL,流速为1 mL/min.以蛋白标准品分子质量对数(lgM)及保留时间(t)做标准曲线,如图1所示.
1.2.5 基本成分测定
蛋白含量测定参照GB 5009.5—2003[4],采用凯氏定氮法.总糖含量测定采用苯酚-硫酸法[5],以葡萄糖为标准品.
1.2.6 氨基酸分析
采用A300自动氨基酸分析仪测定样品氨基酸组成[6].样品经6 mol/L盐酸在110 ℃下水解后用HPLC进行分析.测定条件为:membraPureT259钠离子交换柱,反应器温度为115 ℃,流动相速度为160 μL/min,茚三酮溶液流速为80 μL/min,进样体积为20 μL;采用双可见光光度计检测器,在570和440 nm处进行检测.
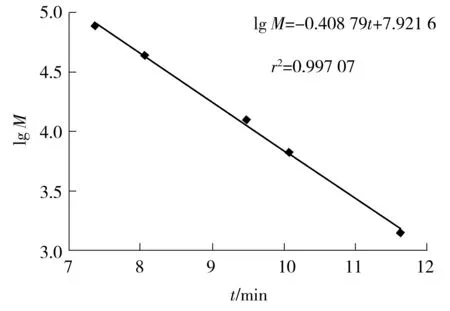
图1 HPLC测定分子质量的标准曲线
1.2.7 单糖组成分析
参照Guerrant等[7]报道的糖腈乙酸酯衍生物气相色谱法,并稍作修改,来分析单糖组成.取50 mg样品加入10 mL 4 mol/L的三氟乙酸中,110 ℃下水解2 h后用甲醇洗涤3次,减压浓缩干燥.再加入10 mg盐酸羟胺、1 mg肌醇和2 mL吡啶,90 ℃下反应30 min后继续加入2 mL醋酸酐,90 ℃下反应30 min,最后加入2 mL蒸馏水终止反应.用二氯甲烷萃取反应液,取二氯甲烷相,加入无水硫酸钠除水,用0.22 μm微孔滤膜过滤后使用7890A气相色谱仪检测.测定条件为:HP-5石英毛细管柱(30 m×0.32 mm×0.25 μm);采用20 PSI恒压模式;进样口采用不分流模式,温度为250 ℃;氢气、空气和氮气流速分别为30、400和25 mL/min;进样体积为1 μL.
1.2.8 糖苷键连接方式分析
糖苷键的分析参照Dong等[8]的方法并稍作修改.取50 mg样品,加入5 mL二甲基亚砜(DMSO)超声处理30 min.继续加入200 mg NaOH,超声处理30 min.加入3 mL碘甲烷,避光反应12 h.反应结束后用氯仿萃取甲基化反应液,取氯仿相,减压浓缩至干.加入5 mL 4 mol/L的三氟乙酸,110 ℃下水解2 h后,用甲醇洗涤3次,旋干.向水解物中加入4 mL蒸馏水,用NaOH调节pH至10~12.加入20 mg硼氢化钠,室温下反应8~12 h.反应结束后用乙酸调节pH至中性,减压浓缩至干,再用甲醇洗涤3次.加入2 mL吡啶和2 mL醋酸酐,90 ℃下反应30 min后,加入2 mL蒸馏水终止反应.用二氯甲烷萃取反应液,取二氯甲烷相,加入无水硫酸钠除水,用0.22 μm微孔滤膜过滤后,使用Trace DSQ-Ⅱ气相色谱-质谱联用仪检测.测定条件如下:TR-5MS 30 m×0.25 mm×0.25 μm规格的弹性毛细管柱;进样口温度为250 ℃;载气为氦气,流量为1 mL/min,分流比为10∶1.质谱条件如下:传输线温度为280 ℃;离子源温度为250 ℃;电子能量为70 eV;质量扫描范围m/z为30~650;进样体积为1 μL.
1.2.9 糖肽键分析
通过β-消去反应测定牛大力糖蛋白中的O-糖肽键[9].称取1.5 mg样品溶解于0.2 mol/L氢氧化钠溶液中,另取1.5 mg样品溶解于蒸馏水中作为对照,在45 ℃水浴锅中反应30 min.用全波长扫描仪测定样品在220~300 nm波段的吸收值.
1.2.10 红外光谱分析
红外光谱分析参照Kumar等[10]的溴化钾压片法.将2~4 mg冷冻干燥后的糖蛋白样品与适量溴化钾混匀、研磨,将粉末装入压片机压成薄片.薄片用红外光谱仪扫描,扫描波长为400~4 000 cm-1.
1.2.11 氧自由基吸收能力(ORAC)测定
ORAC测定参考文献[11]的方法并作适当修改.在96孔板各微孔中分别加入20 μL 0.05 mg/mL的糖蛋白样品、20 μL pH=7.4的磷酸盐缓冲溶液和20 μL 7 nmol/L的荧光素溶液,在37 ℃下孵育15 min后,再用多道移液器迅速在各孔中加入140 μL 12 mmol/L的AAPH启动反应,维持温度为37 ℃,于酶标仪中反应2 h,每2 min测定一次荧光强度.荧光测定的激发波长为485 nm,发射波长为538 nm.
2 结果与讨论
2.1 牛大力糖蛋白的分离纯化结果
2.1.1 牛大力粗糖蛋白的超滤分离结果
由图2所示的HPLC图谱可以看出,牛大力粗糖蛋白MSCG主要由两部分组成,分别是分子质量大于10 ku的组分和分子质量为1~3 ku的组分.由于两组分的分子质量差异较大,因此选用超滤法进行第一步的分离纯化工作.经超滤分离后,透过液部分均为分子质量在1~3 ku之间的组分;而截留液保留了全部的分子质量大于10 ku的组分,但有少量1~3 ku的组分残留.因此,超滤法对牛大力粗糖蛋白的初步分离起到了较好的效果.

图2 MSCG及其超滤液的HPLC图谱
2.1.2 截留液的凝胶柱层析分离纯化结果
由超滤实验结果可知,牛大力糖蛋白截留液仍含有一些小分子物质,需进一步纯化除去.经填料筛选后,采用Sephadex G-75进行柱层析,洗脱液为去离子水.由洗脱曲线(如图3所示)可知,蛋白峰与糖峰基本重合,推测样品是蛋白质与糖的结合物.第一个峰为分子质量大于10 ku的糖蛋白,峰的对称性较好,说明物质较为均一.收集此峰,减压浓缩后冷冻干燥,命名为MSCG-1.
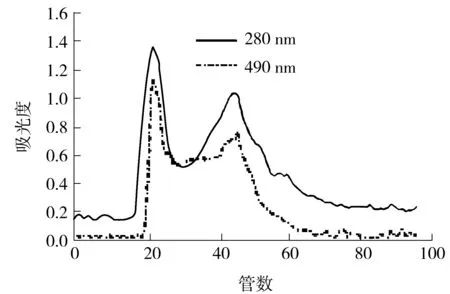
图3 截留液的Sephadex G-75洗脱曲线
Fig.3 Elution curves of the trapped fluid on Sephadex G-75 column
2.1.3 透过液的反相色谱柱层析分离纯化结果
牛大力糖蛋白透过液用ODS柱层析,分别用2%、5%、10%、15%、20%、25%、50%乙醇洗脱,收集洗脱液.其中10%乙醇洗脱组分在HPLC检测(检测条件见1.2.4节)中呈单一对称峰,说明组分较纯,故命名为MSCG-2,供后续研究.
2.2 糖蛋白纯度鉴定与分子质量测定结果
2.2.1 电泳结果分析
图4为MSCG以及纯化后的牛大力糖蛋白组分MSCG-1、MSCG-2的电泳条带图.可以看出,MSCG成分较杂,主要集中在凝胶中上部和凝胶下部,说明其中既含有分子质量较大的物质,又含有分子质量较小的物质.MSCG-1在凝胶中部形成一个明显的条带,在其余部分基本不显色,说明组分较纯.MSCG-2在凝胶下部形成一个明显的条带,说明MSCG-2富集了MSCG中小分子的糖蛋白,组分也比较纯.电泳结果表明,所采用的分离纯化方法能较好地纯化牛大力糖蛋白.
2.2.2 分子质量测定结果
采用高效液相色谱法分析MSCG-1和MSCG-2的分子质量.以蛋白标准品分子质量及保留时间做标准曲线,将样品的出峰时间代入标准曲线即可得到样品的分子质量.计算得到MSCG-1的分子质量约为62.0 ku,MSCG-2的分子质量约为1.94 ku.由图5所示牛大力纯化糖蛋白的分子质量分布图可以看出,MSCG-1与MSCG-2都是较为对称的单峰.此结果与电泳结果一致,表明牛大力粗糖蛋白经纯化后得到的两种组分都是成分较为均一的物质.
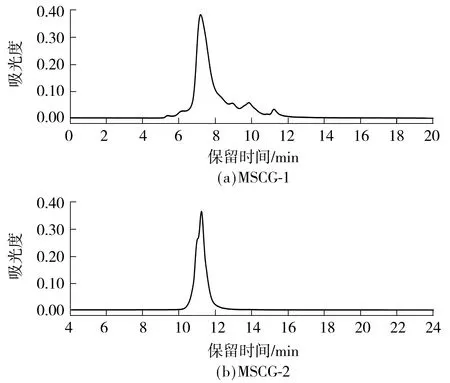
图5 MSCG-1和MSCG-2的分子质量分布
2.3 基本成分分析
表1列出了MSCG、MSCG-1和MSCG-2的蛋白与总糖含量.分析表中结果可知:MSCG-1是一种糖含量相对较高的糖蛋白,蛋白含量为50.22%,总糖含量为38.07%,二者之比为1.32∶1;而MSCG-2中的主要成分是蛋白质,含量为69.37%,总糖含量为6.70%,二者之比为10.35∶1.可见,这两种纯化糖蛋白除分子质量差异较大外,成分差异也较大.
表1 MSCG、MSCG-1和MSCG-2的蛋白与总糖含量
Table 1 Protein and carbohydrate contents of MSCG,MSCG-1 and MSCG-2

组分含量/%MSCGMSCG-1MSCG-2蛋白质51.10±1.5350.22±1.8269.37±1.55总糖15.58±0.5338.07±0.806.70±0.74
2.4 氨基酸组成分析
采用氨基酸分析仪对各样品中的氨基酸组成进行分析,结果如表2所示.可以看出,MSCG-1与MSCG-2的氨基酸组成差异很大.MSCG-1中天冬氨酸含量最高,占氨基酸总量的12.9%,其次是谷氨酸、丝氨酸、亮氨酸、脯氨酸、缬氨酸和苏氨酸,在总氨基酸中的占比均在7%~9%之间.MSCG-2中含量最高的氨基酸是脯氨酸,其在总氨基酸中的占比高达26.1%,其次是半胱氨酸,占比为20.7%,这两种氨基酸几乎占总氨基酸的50%.
表2 MSCG、MSCG-1和MSCG-2的氨基酸组成
Table 2 Amino acid composition of MSCG,MSCG-1 and MSCG-2

氨基酸名称氨基酸含量/(mg·g-1)MSCGMSCG-1MSCG-2酪氨酸21.326.031.6苯丙氨酸17.637.23.2组氨酸17.316.99.4半胱氨酸102.0—155.0丙氨酸48.837.586.8缬氨酸17.746.01.1亮氨酸30.152.628.2天冬氨酸70.675.422.8谷氨酸64.454.0116.0赖氨酸16.324.71.6精氨酸16.317.635.4脯氨酸103.247.9195.0苏氨酸19.144.813.9丝氨酸39.653.846.5甘氨酸8.324.8—异亮氨酸15.525.10.7总氨基酸608.1584.3747.1抗氧化氨基酸158.280.1199.2疏水性氨基酸96.6136.1116.1酸性氨基酸135.0129.4138.8可能对抗氧化有贡献的氨基酸389.8345.6454.1
研究表明,肽链中氨基酸的种类与连接方式直接决定肽的生物活性.对于抗氧化活性肽来说,氨基酸组成极大地影响其抗氧化活性.不同的氨基酸抗氧化机理也不相同,有些氨基酸本身就具有抗氧化活性,可充当亲核试剂或螯合金属离子,如组氨酸、半胱氨酸、酪氨酸等[12];有些氨基酸具有疏水性,其分子结构与表面活性剂类似,在水溶性和油溶性体系中起抗氧化作用,如丙氨酸、缬氨酸、亮氨酸[13];酸性氨基酸(如天冬氨酸和谷氨酸)也有抗氧化活性,这可能与其侧链羧基螯合金属离子有关[14].由表2分析可知,MSCG-2中含有的可能对抗氧化有贡献的氨基酸总量比MSCG-1中高31.3%,尤其是其中的抗氧化氨基酸含量约为MSCG-1的2.5倍.
2.5 单糖组成分析
采用气相色谱法测定各糖蛋白样品的单糖组成,结果列于表3.由表3可知,MSCG-1和MSCG-2中均含有自然界中常见的7种单糖.但是岩藻糖在MSCG中未被检测到,在MSCG-1和MSCG-2中的含量(以摩尔分数表示,下同)也很低,均不到2%.分析其原因,有可能是在分离纯化过程中,MSCG中的岩藻糖被富集,因而在纯化糖蛋白中被检出.显然,MSCG-1和MSCG-2的单糖组成差异很大.MSCG-1中阿拉伯糖含量最高,达到41.13%,其次是半乳糖,为34.77%,其余单糖含量均不高,鼠李糖、阿拉伯糖、岩藻糖、木糖、甘露糖、葡萄糖、半乳糖的摩尔比为1.27∶25.55∶1.16∶1.00∶4.12∶7.42∶21.60;MSCG-2则主要由葡萄糖构成,含量高达75.84%,其余单糖含量均低于10%,鼠李糖、阿拉伯糖、岩藻糖、木糖、甘露糖、葡萄糖、半乳糖的摩尔比为1.84∶5.35∶1.17∶1.00∶3.13∶48.62∶3.00.
郑元升[15]和陈蓉蓉等[16]对牛大力多糖的单糖组成进行了检测,发现牛大力多糖主要由葡萄糖和果糖组成,并含有少量的半乳糖、甘露糖和鼠李糖.文中并未从牛大力糖蛋白中检测到果糖,但是检测到了阿拉伯糖、岩藻糖和木糖,可能是因为牛大力糖蛋白中的单糖组成与牛大力多糖的单糖组成存在差异.
表3 MSCG、MSCG-1和MSCG-2的单糖组成分析
Table 3 Monosaccharide composition of MSCG,MSCG-1 and MSCG-2
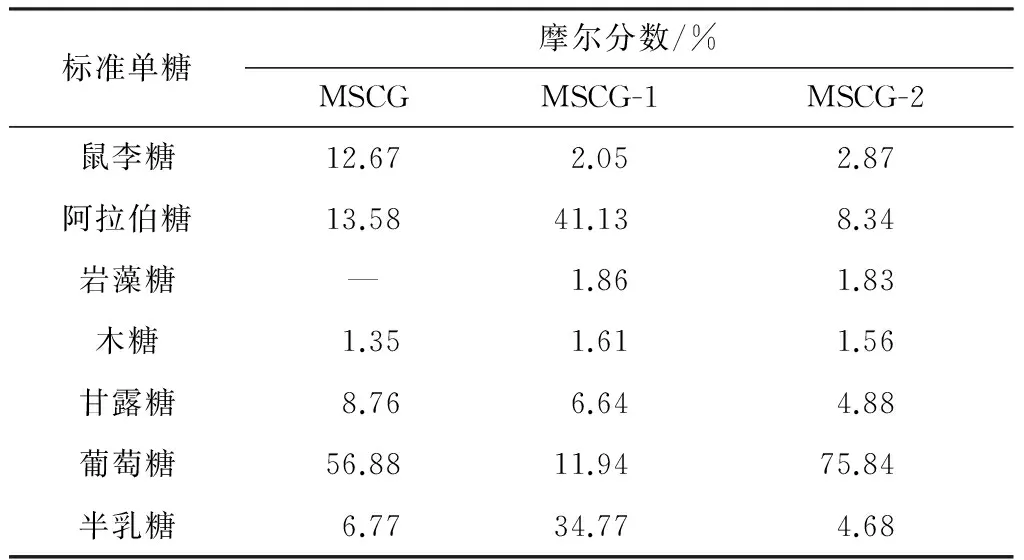
标准单糖摩尔分数/%MSCGMSCG-1MSCG-2鼠李糖12.672.052.87阿拉伯糖13.5841.138.34岩藻糖—1.861.83木糖1.351.611.56甘露糖8.766.644.88葡萄糖56.8811.9475.84半乳糖6.7734.774.68
2.6 糖苷键连接方式分析
由表4结果可知,MSCG-1中主要糖苷键类型是→4,6)-Galp-(1→和Araf-(1→,主要的结构单元是Galp(占42.4%)和Araf(占31.3%)残基.1→4,6连接的半乳糖占比高达33.9%,说明MSCG-1可能是以半乳糖为主链,并且支链较多.末端残基阿拉伯糖含量高达25.2%,说明支链可能主要由阿拉伯糖构成.此外,葡萄糖和甘露糖残基含量也较高.综上所述,MSCG-1中的糖链由1→4,6连接的半乳糖构成主要骨架,大量阿拉伯糖分布在支链中,并含有一定比例的→6)-Manp-(1→和→6)-Glcp-(1→.
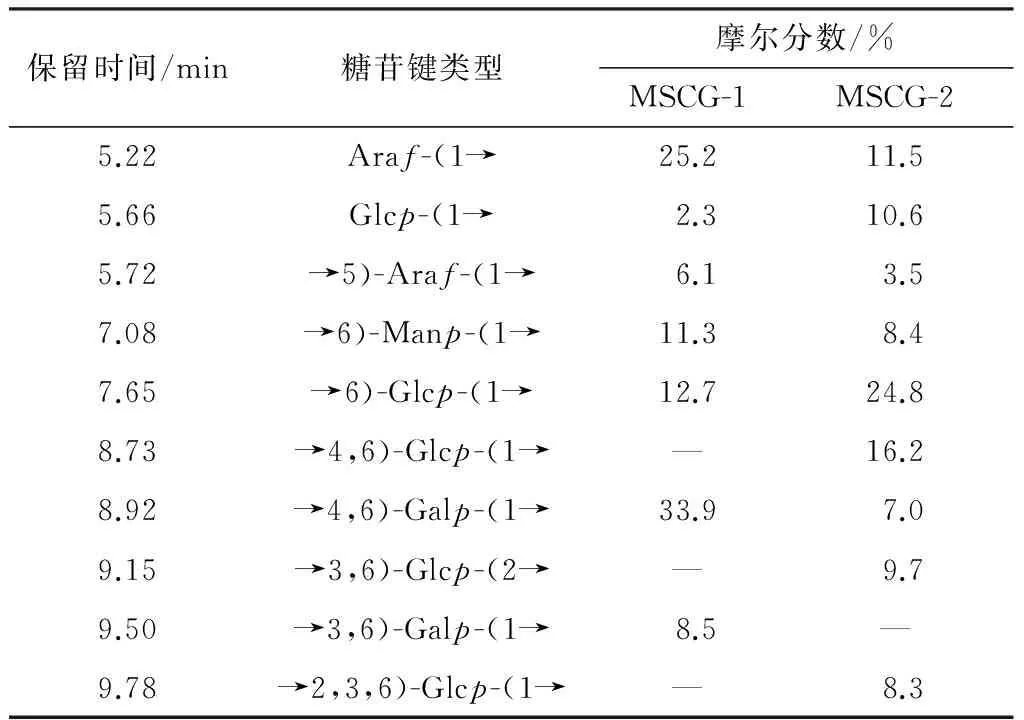
表4 MSCG-1和MSCG-2的甲基化分析
不同于MSCG-1,MSCG-2中最主要的结构单元是Glcp残基,总含量高达69.6%,远高于其他结构单元.主要的糖苷键类型为→6)-Glcp-(1→和→4,6)-Glcp-(1→.葡萄糖连接方式多样,并且从键型来看,糖链分支度很高.综合分析,MSCG-2中的糖链很有可能是由1→6连接的葡萄糖构成主链,分支度高,且含有一定的Araf、Manp与Galp结构单元.
2.7 糖肽键分析
当糖链以O-糖肽键的形式与丝氨酸和苏氨酸结合时,经稀碱处理(β-消去反应)后,糖肽键发生解离,解离后的丝氨酸和苏氨酸会形成α-氨基丙烯酸和α-氨基丁烯酸,这两种氨基酸在紫外240 nm处有特征吸收.因此测定样品在稀碱处理前后240 nm处吸收的变化就可判断该样品中是否含有O-糖肽键.
图6为MSCG、MSCG-1和MSCG-2稀碱处理前后的紫外扫描光谱,碱处理后3个样品在240 nm处都有明显的吸收,说明3个样品中都含有O-糖肽键.
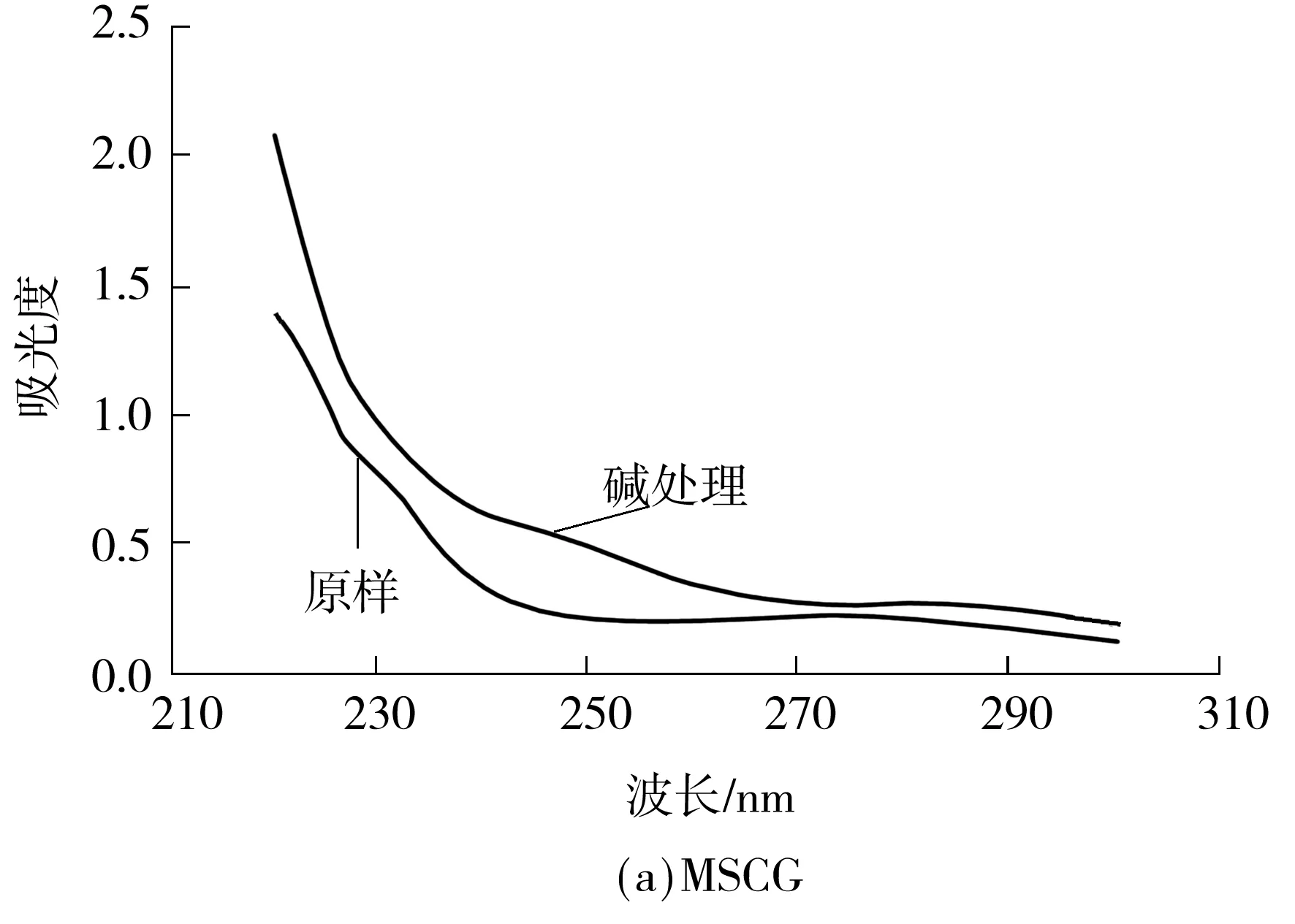

图6 碱处理前后的紫外扫描光谱
Fig.6 Ultraviolet scanning spectrograms before and after alkali treatment
2.8 红外光谱分析
图7显示,MSCG在4 000~400 cm-1区间有糖类物质和蛋白类物质的特征吸收峰.其中:1 643 cm-1处是乙酰基中羰基的伸缩振动和非对称伸缩振动峰,以及N—H的变角振动峰,1 552 cm-1处是肽链上酰胺基NH2的特征吸收峰,这两处吸收峰是蛋白类物质的典型吸收峰;3 360 cm-1处的宽峰为O—H的伸缩振动峰,属于分子内氢键的吸收,2 962 cm-1处是甲基、亚甲基等烷基C—H的伸缩振动峰,这两处吸收峰则是糖类物质的典型吸收峰;1 412 cm-1处是甲基、亚甲基的面内变角振动峰;1 107 cm-1附近相对较强的吸收峰表明了吡喃型糖环的存在;881 cm-1处较弱的吸收峰是β-型糖苷键的特征吸收峰.

图7 MSCG、MSCG-1和MSCG-2的红外光谱
MSCG-1也含有糖类和蛋白质类的特征吸收峰.其中:1 650 cm-1处是乙酰基中羰基的伸缩振动和非对称伸缩振动峰,以及N—H的变角振动;1 538 cm-1处是肽链上酰胺基NH2的特征吸收峰;3 291 cm-1处的宽峰为O—H的伸缩振动峰;2 962 cm-1处是甲基、亚甲基等烷基C—H的伸缩振动峰;1 408 cm-1处是甲基、亚甲基的面内变角振动峰.与MSCG的红外光谱不同,MSCG-1在1 029、1 079 cm-1处有两个明显而尖锐的吸收峰,这是吡喃环的特征峰;881 cm-1处较弱的吸收峰是β-型糖苷键的特征吸收峰.
MSCG-2也含有糖类和蛋白质类的特征吸收峰.其中:1 650 cm-1处是乙酰基中羰基的伸缩振动和非对称伸缩振动峰,以及N—H的变角振动;1 540 cm-1处是肽链上酰胺基NH2的特征吸收峰;3 352 cm-1处的宽峰为O—H的伸缩振动峰;2 938 cm-1处是甲基、亚甲基等烷基C—H的伸缩振动峰;1 407 cm-1处是甲基、亚甲基的面内变角振动峰;1 107 cm-1附近相对较强的吸收峰表明了吡喃型糖环的存在.不同的是,MSCG-2除在907 cm-1有β-型糖苷键的特征吸收峰外,在828 cm-1处还有α-型糖苷键的特征峰,说明MSCG-2富集了含有α-型糖苷键的糖链.
综上所述,MSCG、MSCG-1和MSCG-2的红外光谱都表现出糖类和蛋白质类的特征吸收,三者的官能团种类基本类似,但是含量有所不同.
2.9 氧自由基清除能力
由图8可知,经分离纯化后得到的两个牛大力纯化糖蛋白MSCG-1和MSCG-2的ORAC值(以μmol Trolox/g计)差异很大.MSCG-2的ORAC值为(1 077.19±60.82),而MSCG-1的ORAC值仅为(56.10±18.49),前者约为后者的19倍.MSCG的ORAC值在MSCG-1和MSCG-2的之间,为(364.93±21.27).MSCG-1与MSCG-2 ORAC值的差异可能主要与其组成及结构的差异有关.
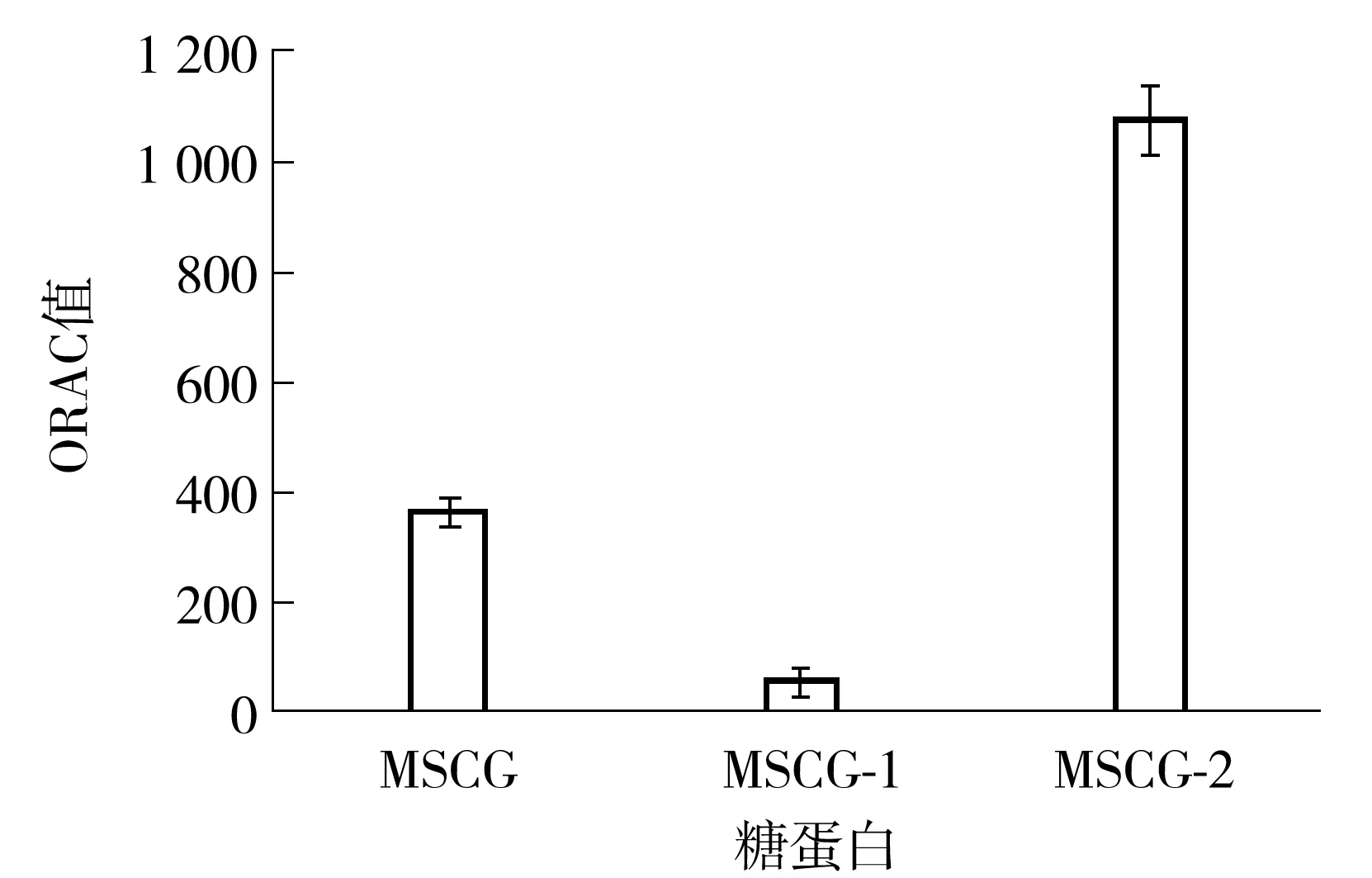
图8 MSCG、MSCG-1和MSCG-2的ORAC值
根据前文所述,无论在肽链方面还是在糖链方面,MSCG-1和MSCG-2的结构都有明显差异.首先,从氨基酸组成来看,MSCG-2的抗氧化氨基酸含量(199.2 mg/g)明显高于MSCG-1(80.1 mg/g),这可能是造成MSCG-2抗氧化能力更高的原因之一.其次,MSCG-2的分子质量(1.94 ku)也明显小于MSCG-1(62.0 ku).肽的分子质量会影响肽的活性,同样,多糖分子质量也会影响多糖的活性.Liu等[17]研究了不同水解度的乳清蛋白对小鼠的抗疲劳活性,发现分子质量低于10 ku的组分具有更高的抗疲劳活性、自由基清除能力以及亚铁离子螯合能力;Qi等[18]研究了不同分子质量的海藻多糖与抗氧化活性的关系,发现低分子质量的多糖组分具有更高的抗氧化活性;Kao等[19]的研究也表明,一种低分子质量的灵芝多糖(3.979 ku)具有较好的抗氧化活性.MSCG-2具有比MSCG-1更低的分子质量,这可能也是其抗氧化能力更高的原因之一.最后,MSCG-1与MSCG-2中糖链的单糖组成与糖苷键连接方式也很不相同.上述因素可能共同导致了二者抗氧化活性的不同.
3 结论
通过对牛大力糖蛋白分离纯化方法、结构组成及抗氧化活性的研究,文中得到以下结论:
(1)牛大力粗糖蛋白MSCG经分离纯化,得到分子质量约为62.0 ku的MSCG-1和分子质量约为1.94 ku的MSCG-2,两种组分都是比较纯的糖蛋白.
(2)MSCG-1和MSCG-2的蛋白含量分别为50.22%和69.37%;MSCG-1中天冬氨酸含量最高,MSCG-2中脯氨酸含量最高;MSCG-2中含有的可能对抗氧化有贡献的氨基酸总量比MSCG-1中高31.3%.
(3)MSCG-1和MSCG-2的总糖含量分别为38.07%和6.70%;MSCG-1和MSCG-2中均含有鼠李糖、阿拉伯糖、岩藻糖、木糖、甘露糖、葡萄糖和半乳糖,MSCG-1中上述7种单糖的摩尔比为1.27 ∶25.55 ∶1.16 ∶1.00 ∶4.12 ∶7.42 ∶21.60,而MSCG-2中为1.84 ∶5.35 ∶1.17 ∶1.00 ∶3.13 ∶48.62 ∶3.00;MSCG-1中的糖链由1→4,6连接的半乳糖构成主要骨架,大量阿拉伯糖分布在支链中,并含有一定比例的→6)-Manp-(1→和→6)-Glcp-(1→;MSCG-2中的糖链很有可能是由1→6连接的葡萄糖构成主链,分支度高,且含有一定的Araf、Manp与Galp结构单元;MSCG-1和MSCG-2中都存在吡喃环,并且都存在β-型糖苷键,另外,MSCG-2中还发现了α-型糖苷键.
(4)MSCG-1和MSCG-2中都含有O-糖肽键.
(5)MSCG-2的ORAC值显著高于MSCG-1,前者为1 077.19±60.82,后者仅位56.10±18.49,说明糖蛋白的组成及结构特性对于其抗氧化活性有重要的影响.
参考文献:
[1] 韦玉燕,巫繁菁,曾海生,等.牛大力研究概况 [J].广西科学院学报,2010,26(3):380- 382. Wei Yu-yan,Wu Fan-jing,Zeng Hai-sheng,et al.The overview on the research ofRadixMillettiaSpeciosae[J].Journal of Guangxi Academy of Sciences,2010,26(3):380- 382.
[2] 黎瑞汝,陈占科,高珊,等.中药牛大力的研究进展 [J].亚太传统医药,2010,6(12):165- 166. Li Rui-ru,Chen Zhan-ke,Gao Shan,et al.Study progress ofMillettiaSpeciosae[J].Asia-Pacific Traditional Medicine,2010,6(12):165- 166.
[3] 李婷婷.油茶籽糖蛋白的分离纯化及其功能活性研究 [D].无锡:江南大学食品学院,2014.
[4] 杨慧芬,李明元,沈文.食品卫生理化检测标准手册 [M].北京:中国标准出版社,1998:149- 173.
[5] 张惟杰.糖复合物生化研究技术 [M].2版.杭州: 浙江大学出版社,1994:11- 12.
[6] Matsuda T,Kato Y,Nakamura R.Lysine loss and polymerization of bovine beta-lactoglobulin by amino carbonyl reaction with lactulose(4-O-beta-D-galactopyranosyl-D-fructose) [J].Journal of Agricultural and Food Chemistry,1991,39(7):1201- 1204.
[7] Guerrant G O,Moss C W.Determination of monosaccharides as aldononitrile,O-methyloxime,alditol and cyclitol acetate derivatives by gas chromatography [J].Analytical Chemistry,1984,56(4):633- 638.
[8] Dong Qun,Zhang Zhi-yi,Lin Ying,et al.Studies on two polysaccharides fromStephaniatetrandra[J].Acta Biochimica et Biophysica Sinica,1995,3(27):261- 265.
[9] Albert S B E,Robert G S.Structure of the O-linked oligosaccharides from a major thyroid cell surface glycoprotein [J].Archives of Biochemistry and Biophysics,1997,343(1):73- 80.
[10] Kumar C G,Joo H S,Choi J W,et al.Purification and characterization of extracellular polysaccharide from haloalkalophilicBacillussp I-450 [J].Enzyme and Microbial Technology,2004,34(7):673- 681.
[11] 续洁琨,姚新生,栗原博.抗氧化能力指数(ORAC)测定原理及应用 [J].中国药理学通报,2006,22(8):1015- 1021. Xu Jie-kun,Yao Xin-sheng,Kurihara Hiroshi.Oxygen radical absorbance capacity assay and its application [J].Chinese Phamacological Bulletin,2006,22(8):1015- 1021.
[12] Park P J,Jung W K,Nam K S,et al.Purification and cha-racterization of antioxidative peptides from protein hydrolysate of lecithin-free egg yolk [J].Journal of the American Oil Chemists’ Society,2001,78(6):651- 656.
[13] Chen Hua-ming,Muramoto K,Yamauchi F.Structural ana-lysis of antioxidative peptides from soybeanβ-conglycinin [J].Journal of Agricultural and Food Chemistry,1995,43(3):574- 578.
[14] Saiga A,Tanabe S,Nishimura T.Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment [J].Journal of Agricultural and Food Chemistry,2003,51(12):3661- 3667.
[15] 郑元升.牛大力多糖的提取及其药理活性研究 [D].广州:暨南大学生命科学技术学院,2009.
[16] 陈蓉蓉,蒲含林,姜华,等.牛大力多糖的分离纯化及抗氧化活性研究 [J].食品研究与开发,2014,35(3):31- 34. Chen Rong-rong,Pu Han-lin,Jiang Hua,et al.Purified and antioxidant activity of water-soluble polysaccharide fromMillettiaSpeciosaChamp[J].Food Research and Development,2014,35(3):31- 34.
[17] Liu Jing,Wang Xia-xia,Zhao Zheng.Effect of whey protein hydrolysates with different molecular weight on fatigue induced by swimming exercise in mice [J].Journal of the Science of Food and Agriculture,2013,94(1):126- 130.
[18] Qi Hui-min,Zhao Ting-ting,Zhang Quan-bin,et al.Antioxidant activity of different molecular weight sulfated polysaccharides fromUlvapertusaKjellm(Chlorophyta) [J].Journal of Applied Phycology,2005,17(6):527- 534.
[19] Kao P F,Wang S H Hung,Huang W T,et al.Structural characterization and antioxidative activity of low-molecular-weights Beta-1,3-glucan from the residue of extractedGanodermalucidumfruiting bodies [J].Journal of Biomedicine and Biotechnology,2012,2012(1):1- 8.
Separation,Identification and Antioxidant Activity of Glycoproteins fromMillettiaSpeciosaChamp.
ZhaoQiang-zhongFengMeng-yingLinLian-zhuZhaoMou-ming
(School of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,Guangdong,China)
In order to understand well the structural characteristics,physical and chemical properties and biological activities of glycoprotein fromMillettiaSpeciosaChamp.(MSCG),MSCG was purified by means of ultrafiltration,chromatography Sephadex G-75 and ODS according to its molecular mass distribution,and thus two purified fractions MSCG-1 and MSCG-2 were obtained.Then,the structures of the two fractions were identified by means of HPLC,GC,GC-MS and FT-IR.The results show that (1) the molecular masses of MSCG-1 and MSCG-2 are 62.00 ku and 1.94 ku respectively; (2) MSCG-1 contains 50.22% protein and 38.07% sugar,and it is mainly composed of →4,6)-Galp-(1→ and Araf-(1→;(3) MSCG-2 contains 69.37% protein and 6.70% sugar,and its main chain is composed of →6)-Glcp-(1→ and has a high branch degree; (4) MSCG-1 and MSCG-2 both contain O-link bonds; (5) for the amino acid which may be of antioxidant activities,its content in MSCG-2 is 31.3% higher than that in MSCG-1; (6) the oxygen radical absorbance capacities (ORAC) of MSCG-1 and MSCG-2 are (56.10±18.49) and (1 077.19±60.82) μmol/g; and (7) the antioxidant activity of MSCG-2 is significantly higher than those of MSCG and MSCG-1,which means that the molecular composition,molecular mass and structural characteristics of glycoprotein determine their antioxidant activities.Key words:MillettiaSpeciosaChamp.;glycoprotein;separation;purification;structure identification;antioxidants
2015- 04- 10
广东省教育部产学研结合项目(2012B090600025) Foundation item: Supported by the Production,Education and Research Cooperative Project of Guangdong Province and the Ministry of Education(2012B090600025)
赵强忠(1976-),男,博士,教授,博士生导师,主要从事食品生物技术研究.E-mail: qzzhao@scut.edu.cn
† 通信作者: 赵谋明(1964-),男,博士,教授,博士生导师,主要从事食品生物技术研究.E-mail: femmzhao@scut.edu.cn
1000- 565X(2015)11- 0008- 08
Q 513+.2
10.3969/j.issn.1000-565X.2015.11.002

