金黄杆菌感染棘腹蛙的分离鉴定
吴宝红,樊汶樵,姜玉松,张 婷,孙翰昌,徐敬明
(重庆文理学院林学与生命科学学院重庆珍稀濒危水产资源保护与开发研究中心,重庆永川402168)
金黄杆菌感染棘腹蛙的分离鉴定
吴宝红,樊汶樵,姜玉松,张 婷,孙翰昌,徐敬明
(重庆文理学院林学与生命科学学院重庆珍稀濒危水产资源保护与开发研究中心,重庆永川402168)
棘腹蛙又名石坑、石蛙等,隶属无尾目、蛙科、棘蛙属,是我国特有的珍稀两栖动物[1],主要分布在湖南、湖北、四川以及甘肃等省[2]。由于环境污染严重、野生栖息地遭受破坏、人类大肆捕杀,棘腹蛙野生种群数量大量减少[3]。为保护其野生资源,同时满足市场需求,棘腹蛙的人工养殖逐渐受到重视。2014年以来,重庆地区部分养殖场出现大量棘腹蛙出血死亡的病例,给棘腹蛙养殖带来巨大经济损失。本研究拟从患病棘腹蛙体内部分器官分离病原菌,对其进行生物学特性研究和药敏试验,为该病的诊断与防治提供参考。
1 材料与方法
1.1 病料及供试材料来源患病棘腹蛙为重庆市某养殖场送检样品,平均体重100.0±2.0 g,平均体长40.0±2.0mm。患病棘腹蛙食量减少、动作迟缓,严重患蛙死亡。剖检可见眼球化脓,上颌、食道表面、腹腔皮下、输卵管均严重出血,肝脏暗黑色并有多处出血点,脾脏和肺部发黑,十二指肠充血、出血。
健康棘腹蛙,购自重庆某棘腹蛙养殖场,共80只,规格为每只体重100 g左右,平均体长45mm左右。
1.2 试剂、药物、培养基及器材酵母提取物、胰蛋白胨等试剂,购自OXOID公司;水解酪蛋白(M-H)琼脂/肉汤,购自广东环凯微生物科技有限公司;兔血在无菌条件下采自健康家兔;细菌微量生化管(批号:140123)和药敏试纸(批号:140227),购自杭州天和微生物试剂有限公司;细菌基因组DNA抽提试剂盒、DNA分子量标准、2× Taq PCR Master Mix等,购自天根生化科技(北京)有限公司;其他常规试剂由实验室自行配置。
1.3 病原菌的分离无菌接种病蛙眼部病灶、上颌、腹腔皮下及心脏、脾脏等器官于LB固体培养基和液体培养基,28℃培养24 h;同时做厌氧培养,观察细菌生长情况。对优势菌进行纯化并革兰染色镜检观察,同时用5%兔全血平板鉴定其溶血性。纯化后的候选菌株加入25%甘油置-20℃保存。1.4致病性试验挑取单个菌落于LB液体培养基中,120 r/min(28℃)震荡培养12 h。用平板菌落计数法调整菌悬液浓度至1.1×107、1.1×106、1.1× 105、1.1×104、1.1×103、1.1×102、1.1×101CFU/mL。将健康棘腹蛙随机分成8组,每组10只,暂养1周后对其中7组腹腔注射不同浓度菌液,每只0.2mL;最后1组注射生理盐水0.2mL作为对照。随时观察并记录感染情况,同时取人工感染后死亡棘腹蛙内脏组织进行细菌的再分离培养。
1.5 生理生化特性鉴定取纯化后的单个菌落,接种于细菌微量生化反应管进行生理生化特性测定,参照《伯杰氏细菌手册》进行判定结果。
1.6 16S rDNA基因序列分析选取纯化后单个菌落,接种于LB液体培养基中以获得细菌悬液并提取细菌基因组DNA,采用扩增细菌16S rDNA的通用引物(fD1/rD1)进行PCR扩增(上、下游引物分别为:5′-AGAGTTTGATCCTGGCTCAG-3′和5′-TACGGCTACCTTGTTACGACTT-3′),经琼脂糖凝胶电泳鉴定后的阳性产物送上海英骏生物技术有限公司进行序列测定。
将阳性产物序列与GenBank中的已知序列进行Blast对比,筛选出相似性较高的序列,利用Mega6.0软件进行多序列匹配分析,邻接法构建系统发育树[4]。
1.7 药敏试验挑取纯化后的候选菌株单个菌落于M-H肉汤中,28℃恒温震荡培养12 h。将菌悬液用生理盐水稀释为0.5倍麦氏浓度后,用棉拭子蘸取菌液均匀涂布在M-H培养基表面,然后用镊子将药敏纸片紧贴在琼脂平板表面。每张纸片间距≥24mm,纸片中心距平皿边缘≥15 mm。28℃恒温培养12~18 h后观察细菌生长情况,测量抑菌圈大小,并参照药敏试验判断标准来判定结果。
2 结果
2.1 细菌分离结果及培养特性在患病棘腹蛙眼球、脾脏、食道和肺均分离到一株相同的优势菌。该候选菌株好氧,在LB固体培养基上呈表面光滑、突起的圆形菌落,具有金黄色色素。生长12 h后,菌落互相粘连,培养基表面完全被粘连的菌丝覆盖;在兔全血平板上无溶血环出现。革兰染色可观察到短杆状、无鞭毛、无芽孢的革兰阴性菌;将该纯化菌株命名为CQWU201410。
2.2 致病性试验结果候选菌株CQWU201410人工感染4 d后棘腹蛙开始死亡,眼观可见1.1× 104及以上感染组棘腹蛙出现眼球化脓,腹部严重收缩等症状,剖检症状与自然发病一致;对照组无任何异常。从感染病蛙的眼球、食道、脾脏和肺仍能分离出与自然发病相同的优势菌。根据改良寇氏法[5]可计算出候选菌株CQWU201410感染棘腹蛙的半致死剂量LD50为1.743×104CFU/只,结果见表1。

表1 菌株CQWU 201410对棘腹蛙的致病性(死亡数/试验数)
2.3 生理生化特性鉴定结果对菌株CQWU201410进行生理生化特性检测,发现该菌能利用赖氨酸脱羧酶、精氨酸双水解酶和DNA酶,在无盐胨水和6% NaCl胨水中均能生长,不发酵乳糖、麦芽糖、阿拉伯糖、棉子糖和木糖等,见表2。
2.4 16S rDNA序列分析结果成功扩增到菌株CQWU201410的部分16S rDNA基因序列,长度为1 402 bp。将该序列提交至NCBI进行Blast比对,发现与金黄杆菌亲缘关系最为接近,相似性达99.0%。结合比对结果调出与候选菌株序列相关性较高的核酸序列,构建系统发育树,结果见图1。
2.5 耐药性试验结果菌株CQWU201410对哌拉西林、环丙沙星等2种抗生素表现出较为明显的敏感性,对阿米卡星、庆大霉素、妥布霉素、头孢他啶、替卡西林、复方新诺明等6种抗生素耐药。见表3。
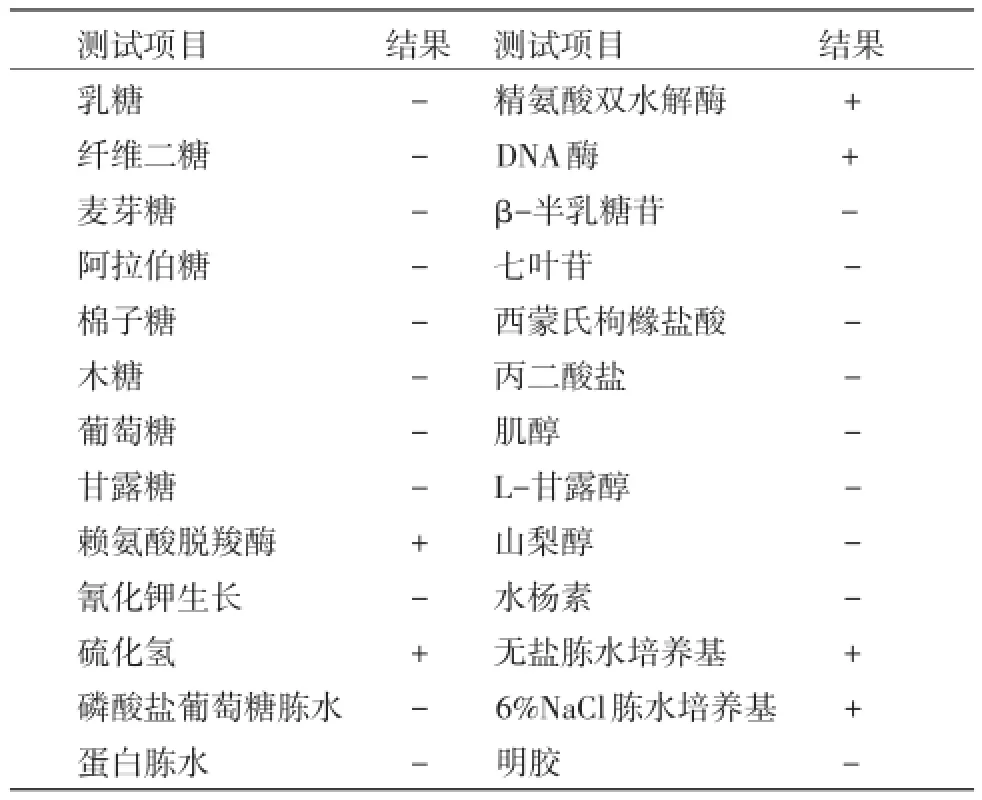
表2 候选菌株的生理生化特性鉴定

图1 16S rDNA序列系统发育树
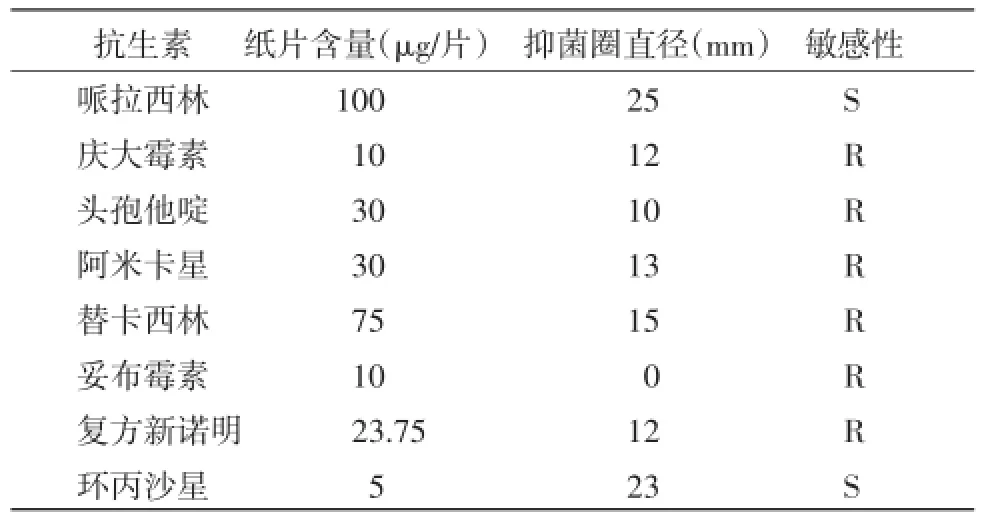
表3 菌株CQWU201410的药敏试验
3 结论与讨论
金黄杆菌(Chryseobacterium)是常见条件致病菌[6],广泛存在于自然界中。目前国内对于金黄杆菌属细菌的研究,主要集中在脑膜脓毒金黄杆菌感染人体的临床治疗等方面[7],而感染水生生物的报道较少。王继元[8]等在无指盘臭蛙(Odor⁃rana grahami)皮肤表面分离到一株具有胞外蛋白水解酶活性的菌株,鉴定为金黄杆菌属中的一个未定种。Zamora[9]等从虹鳟腮部分离到一种具有过氧化氢酶和氧化酶活性的金黄杆菌,该分离株的16S rRNA基因序列与本实验室分离的候选菌株CQWU201410同源性高达99.0%,进一步证实了金黄杆菌对水生动物的感染性。
本试验中所鉴定的金黄杆菌是首次从棘腹蛙体内分离证实;棘腹蛙感染该菌后病死率高,发病初期棘腹蛙行动迟缓、停止进食,随后发生的肝坏死、主要消化器官的出血、坏死导致了较高的死亡率。在分离培养中发现,该菌在28℃下生长速度较快,菌丝蔓延程度大,不利于细菌形态的观察;因此,培养该菌时不宜置于28℃时间过长,8 h后就可从培养箱中取出,在20℃下待其缓慢生长可获得较佳单个菌落。
本研究选取8种抗生素进行了药敏试验,发现菌株CQWU201410对哌拉西林、环丙沙星等2种药物敏感,对庆大霉素、阿米卡星、妥布霉素等氨基糖苷类抗生素耐药明显,对头孢他啶、替卡西林、复方新诺明也有较高耐药性。有报道称[10-11]金黄杆菌对多种抗菌药物如氨基糖苷类、β-内酰胺类[12]、四环素类、氯霉素天然耐药,对复方新诺明、妥布霉素、利福平等复合抗菌药物也有较高的耐药性,与本研究结果一致。由于该菌对大多数常用抗菌药物具有耐药性,给治疗该菌引起的感染带来很大困难。在临床防治上应特别注意针对该菌的耐药性分析,以便选用合适的药物进行治疗。
[1]李益得,廖长乐,毛寿林,等.我国珍惜两栖动物-棘腹蛙[J].经济动物学报,2012,16(2):119-122.
[2]费梁,叶昌媛,黄永昭,等.中国两栖动物检索及图解[M].成都:四川科学技术出版社,2005:137-139.
[3]赵尔宓.中国濒危动物红皮书:两栖类和爬行类[M].北京:科学出版社,1998:80-83.
[4]谭瑶,赵清,舒为群,等.K-B纸片扩散法药敏试验[J].检验医学与临床,2010,7(20):2290-2291.
[5]邹玉霞,张培军,莫照兰,等.大菱鲆出血症病原菌的分离和鉴定[J].高技术通讯,2004,14(4):89-93.
[6]Holt JG,Krieg N R,Sneath pH A,et al.Bergey’s Manual of Determinative Bacteriology[M].Ninth Edition.London:Baitimore,Williams and Wilkins,1994:178:204-225.
[7]陈晓蓓.医院金黄杆菌属分布变迁与耐药性研究[J].中华医院感染学杂志,2011,21(4):772-774.
[8]吴泉,沈翠芬,张晓祥,等.黄杆菌属细菌的分离与药敏分析[J].江西医学检验,2006,24(5):471.
[9]Kirby JT,Sader H S,Walsh TR,etal.Antimicrobial susceptibil⁃ity and epidemiology of a worldwide collection of Chryseobacteri⁃um spp:report from the SENTRY antimicrobial surveillance pro⁃gram[J].JClin Microbiol,2004,42(1):445.
[10]董蘅,贺凤凤,王名贵.黄杆菌属细菌感染52例抗菌治疗分析[J].中国实用内科杂志,1999,19(7):435-436.
[11]Bellais S,Poirel L,Leotard S,et al.Genetic diversity of car⁃barpennem-hydrolyzingmetallo-β-lactamase from Chryseobacte⁃rium(Flavobacterium)indologenes[J].Antimicrob Agents Ch,2000,44(11):3028-3034.
[12]林永恩.脑膜脓毒金黄杆菌研究进展[J].内科,2010,5(4):408-410.
S852.61+8
B
0529-6005(2015)12-0097-03
2015-03-04
重庆市科技计划项目(cstc2014jcyjA80042);重庆市科技攻关计划(cstc2012gg-yyjs80004);重庆市教委科学技术研究项目(KJ1401105);重庆文理学院人才引进项目(R2013LS13)
吴宝红(1994-),女,本科生,学习方向为生物技术(检验检疫),E-mail:309289786@qq.com
樊汶樵,E-mail:wonderbreeze@126.com

