气驱动仿食道蠕动软驱动器的结构设计与实验研究
, , Peter Xu(.南京理工大学 机械工程学院, 江苏 南京 0094; .奥克兰大学 工程学院, 奥克兰 新西兰 00)
引言
日常进食是保证人体新陈代谢,维持各项功能的一项必要过程[1]。一般的,吞咽过程被分解成口腔准备期、口腔期、咽期、以及食道期四个阶段。经咀嚼后的食物从口腔开始,通过咽喉和食道,最终被运送至胃部。整个咽食过程需依靠舌、咽和食道的骨骼肌/平滑肌在神经系统控制下协调完成[1, 2]。
吞咽困难是消化道疾病、神经肌肉疾病的常见并发症,特别在老年人群体和消化道手术后人群中占很大比例[3]。吞咽困难使得患者不能安全有效地进行咽食,易造成窒息、咳嗽、营养不良、脱水等症状。
食物的材质特性,包括大小、黏度、硬度等,影响参与吞咽的各组织结构的生理行为[4, 5]。针对不同患者吞咽困难的严重程度,通过改善食品的材质特性,施以相对安全的食品,是一种治疗吞咽困难的手段。然而,由于人体吞咽系统结构的复杂性,不易获得吞咽时食物流动和吞咽系统的体内测量数据,阻碍了食品材质特性对吞咽过程影响的研究以及安全食品的开发。
为提高吞咽困难医疗诊断水平,提出了仿生吞咽机器人,提供体外试验环境,用于研究食物被吞咽后的流动特性。本研究设计和制造了仿食道蠕动软体驱动器,模仿人类吞咽过程中食道的蠕动运动。
1 仿食道蠕动驱动器的设计
1.1 人体食道蠕动运动参数
人体的食道是一根肌肉管道,主要由外层环形肌,中层纵向肌和内层粘膜构成[6]。成人食道长20~25 cm,内径大约2 cm[6]。食道的环形肌和纵形肌有序收缩和放松,产生了类似波浪的蠕动运动。食道收缩时,挤压食团,推动食团进入胃部。
临床上通过造影、测压法等手段,测量了大量吞咽中食道期的物理参数,包括食道蠕动传播速度,食道内壁挤压力,以及食物内部压力等。受食物硬度、黏度等影响,一次完整的蠕动过程大约持续5~10 s[7]。有研究数据表明,当人站立时,流质食物更多受到重力影响进入胃,而不是通过食道蠕动前行。
测压法常被用来测定食道蠕动时产生的压力。通过分析压力波的产生时间、最大压力等特征值,可以直接反映食道的蠕动能力,也可以间接得到蠕动波的速度特点。一般的,在一次吞咽过程中,蠕动在食道不同位置的速度是不一样的。其中一个重要原因是食道上下两段的组成肌肉不同,上段是横纹肌,下段是平滑肌。因肌肉收缩能力不同,导致蠕动速度和最大挤压力沿食道变化。食道吞咽的平均速度是2~4 cm/s[8]。上端最大压力值(53.4±9.0) mmHg,下端最大压力值(69.5±12.1) mmHg[8]。
1.2 多腔室蠕动驱动器结构设计
如图1所示是仿食道蠕动驱动器的结构构成。驱动器由柔软的硅橡胶制备,模拟人体肌肉性食道。驱动器中部沿轴向方向,是贯穿驱动器两段的圆柱形通道,直径20 mm(图2),模拟人体食道。驱动器总长为215 mm,类似于成人食道。十二层腔室围绕着食物通道,嵌在硅橡胶材料内。每层四个腔室均布在通道四周,如图2所示。
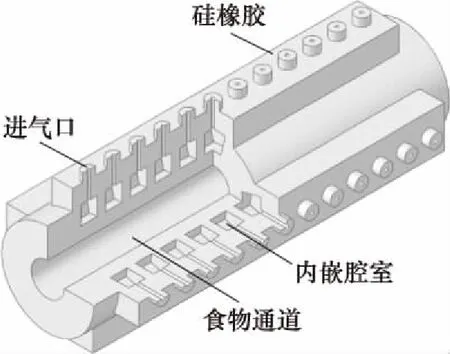
图1 仿食道蠕动驱动器结构
2 仿食道蠕动驱动器的制备
仿食道软体蠕动驱动器由双组份室温硫化硅橡胶(Ecoflex 0030, Smoot-on, US)制成。制备驱动器的大致步骤是:
(1) 设计用于装载硅橡胶凝固成型的模具,并使用3D打印技术制备模具;

图2 仿食道蠕动驱动器横截面结构
(2) 将硅橡胶的两种成分以1∶1比例均匀混合,除去搅拌时混入的气泡后,浇筑在定制的模具中;
(3) 在室温下,经大约4 h自然凝固;
(4) 拆卸模具,取出软体驱动器中心部分——十二层腔室未封闭;
(5) 采用同种橡胶材料,封闭驱动器四周的腔室;
(6) 将驱动器放置在烤箱中,恒温60 ℃加热约3 h,用于加固腔室处硅橡胶的粘接;
(7) 重复利用模具,安装在橡胶体外部,限制驱动器充气时向外的变形。图3所示是蠕动驱动器的原型,内嵌48个可充气腔室,总长215 mm,总重约690 g。

图3 仿食道蠕动驱动器原型
3 蠕动驱动器变形测量实验
本实验的目的是研究驱动器管道内壁变形与充气腔内气压力间的力学关系。
3.1 驱动器变形测量实验装置
图4是实验装置和主要组成部分简图,包括用于生成气动控制指令的GUI,微控制器,D/A转换电路,气动控制回路,蠕动驱动器和用于记录驱动器管道内壁变形的动态言语动作观测仪。
GUI生成的控制信号经串口输入并保存在微控制器(PIC24FJ128GA010)内,继而由D/A转换电路转换成模拟电压信号,控制比例电磁阀的输出气压。D/A转换电路的输出频率被设置为10 Hz。气动控制回路中每一个比例电磁阀控制一层4个腔室,响应时间为0.1 s,接受0~10 V电压信号,其供气压力维持在0.4 MPa。

1.计算机及GUI 2.微控制器 3.D/A转换电路 4a.气源 4b.减压阀 4c.比例电磁阀 5.蠕动驱动器 6.动态言语动作观测仪
实验中采用动态言语动作观测仪来记录驱动器内壁的变形。观测仪能够在立方体空间创建磁场,并记录球形电磁式传感器在磁场内的动态位置。本实验选用了7个电磁式传感器,将其均匀粘贴在内壁壁面。随着驱动器内壁变形,观测仪可以记录传感器所在点位置的变化。传感器直径大约为2 mm,互相间隔7.5 mm。其中3个传感器被安置在对应腔室中间的位置,其余4个被安置在对应腔室隔离材料的位置(如图5所示)。
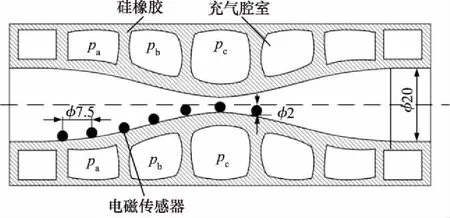
图5 动态言语动作观测仪传感器安装示意图
3.2 驱动器变形测量实验气驱动模式
由于每层腔室都配备了1个比例电磁阀,每层的充、放气过程互相独立,理论上可以形成多种不同的驱动模式。例如,可以调节每层的气压变化,也可以调节相邻层间相位差,来实现多种驱动模式。
本实验研究蠕动驱动器的径向收缩性能,选择3个比例电磁阀同时控制相邻的三层腔室,控制气压分别为pa、pb和pc(图 5),其余层腔室与大气联通。气压力pa、pb和pc遵循同一个规律,从0 kPa开始阶梯式增长,直至压力足够大使得驱动器管道闭合。同时,三个压力还遵循pa≤pb≤pc规则。以pc为例,气压力模型可以表述为:
pc=3.57n,n=0,1,2,…
(1)
图6是气压力的增长模型。实验中,每一组压力组合维持1 s时间,以保证驱动器变形进入稳定状态。

图6 驱动气压pa、pb、pc增长模型
3.3 驱动器变形测量实验结果
图7和图8是提取出的驱动器变形测量部分结果。在图7中,气驱动方案是:pa=pb=0 kPa,pc分别是35.71 kPa、46.43 kPa、57.14 kPa和67.86 kPa。总体上,与压力pc对应的腔室膨胀程度大于其余2个腔室。驱动器内壁形状从pa腔室到pc腔室呈递增趋势。当pc为67.86 kPa时,驱动器内壁最大位移大约为8.5 mm。考虑到电磁传感器内径为1 mm,此时驱动器管道已经基本闭合。

图7 驱动方案一
在图8中,气驱动方案是:pa=0 kPa;pb=pc,按公式(1)变化。提取pb和pc值和图 7中相同时,驱动器变形测量数据。经比较,当气压力较低,如35.71 kPa,驱动器内壁最大位移约为1.2 mm,与方案一中最大位移相近。而当气压增大时,如当气压力为57.14 kPa,方案二中最大位移达到约5.4 mm,明显大于方案一中最大位移,3.5 mm。并且,驱动器内壁整体偏向管道中轴。当气压增大至67.86 kPa时,驱动器管道接近闭合。

图8 驱动方案二
4 结论
为提高吞咽困难诊断水平和研究食品与吞咽系统交互关系提供体外环境,提出了吞咽机器人,设计并制造了仿人体食道软体蠕动驱动器原型。该驱动器使用室温硫化硅橡胶制成,内嵌十二层可充气腔室。驱动器成型模具通过3D打印技术生成。驱动器变形测量实验中,采用了动态言语动作观测仪,记录充气膨胀时驱动器内壁的变形。
为实时控制驱动器生成蠕动运动,需研究该软体驱动器的力学模型。软体结构的力学模型研究是仿食道软体蠕动驱动器的下一步研究方向,也是软体机器人领域尚未解决的研究难题。
参考文献:
[1]F J Chen,S Dirven,W L Xu,J Bronlund,X N Li, A Pullan.Review of the Swallowing System and Process for A Biologically Mimicking Swallowing Robot [J].Mechatronics,2012,22(5):556-567.
[2]J Chen,Food Oral Processing-A Review [J].Food Hydrocolloids,2009,23(1):1-25.
[3]J Robbins,S Langmore,J A Hind,M Erlichman,Dysphagia Research in the 21stCentury and Beyond[J].Journal of Rehabilitation Research & Development,2002,39(4):543-548.
[4]V V Raut,G J McKee,B T Johnston,Effect of Bolus Consistency on Swallowing-does Altering Consistency Help[J].European Archives of Oto-rhino-laryngology,2001,258(1):49-53.
[5]F Gumbley,M Huckabee,S Doeltgen,U Witte,C Moran,Effects of Bolus Volume on Pharyngeal Contact Pressure during Normal Swallowing[J].Dysphagia,2008,23(3):280-285.
[6]B Kuo,D Urma,Esophagus-anatomy and Development.Gastrointestinal Motility[Z],2006.
[7]W Yang,T C Fung,K S Chian,C K Chong,Finite Element Simulation of Food Transport through the Esophageal Body[J].World J.Gastroentero,2007,(13):1352-1359.
[8]T J Humphries, D O Castell.Pressure Profile of Esophageal Peristalsis in Normal Humans as Measured by Direct Intraesophageal Transducers[J].Am.J.Dig.Dis.,1997,(22):641-645.

