力竭运动对大鼠心脏传导系统ICAM-1的影响
常芸 杨红霞 王菲
1 国家体育总局体育科学研究所(北京100061)
2 上海体育学院
运动性心律失常一直是体育科学领域十分关注的问题,由于其影响到运动员的身体健康、系统训练以及比赛成绩, 尤其耐力项目运动员和从事过大强度与大运动量训练的运动员可出现严重的心律失常, 甚至发生运动性猝死。 由于运动性心律失常的发生机制极其复杂,涉及因素众多,多年来运动医学界对此进行了广泛的临床观察与实验研究[1-3]。 目前运动性心律失常的发生机制仍未完全阐明, 以往实验性研究大多集中于心肌组织,很难完全概括心律失常发生的病理机制。 心脏传导系统是心电活动的控制中心和冲动传导的重要部位, 特殊的组织结构和细胞类型决定其具有不同于普通心肌的心电起搏和传导功能, 且临床研究已证实心脏传导系统改变与各种类型心律失常的发生和发展有密切关系。
研究发现急性心肌梗死(AMI)后炎症指标明显升高,且炎症指征越明显,微循环障碍越严重[4]。 糖尿病、高血压心肌中细胞间粘附分子-1 (intercellular cell adhesion molecule-1,ICAM-1)mRNA和蛋白表达水平及巨噬细胞浸润显著增加,提示心肌ICAM-1过度表达及其介导的炎性细胞浸润可能参与了糖尿病、 高血压以及心肌缺血再灌注的发病过程[5,6]。 在多种炎性介质(如TNF-α、IL-1等)的诱导下,通过激活核因子kappaB(nuclear factor kappa B,NF-kB), 活 化 蛋 白-1(actor protein-1,AP-1)、 信号转导子和转录激活子(signal transducers and activators of transcription,STAT) 等,促进ICAM-1基因表达上调[7-9],并参与多种细胞信号传导,引起细胞骨架蛋白结构及功能改变; 参与调节机体免疫细胞的分化和细胞因子产生, 促进细胞间粘附及细胞活化[10]。 最近,研究也发现力竭运动可以引起心脏传导系统肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)和ADAMTS-1的异常表达,提示运动性心肌损伤与心律失常发生中有炎症因子参与[11-15]。
为此, 本研究采用力竭运动制备心肌损伤与心律失常实验动物模型,对心脏传导系统的ICAM-1的表达变化进行研究,探讨力竭运动后不同时相心脏窦房结、房室结和浦肯野氏纤维中重要炎症反应因子ICAM-1在基因和蛋白水平的表达特点, 为运动性心肌损伤和心律失常发生机制的阐明提供实验依据。
1 材料与方法
1.1 实验对象
健康雄性8周龄成年SD大鼠100只,体重22.0±8 g,购自北京维通利华实验动物中心[SCXK(京)2011-0001]。国家体育总局体育科学研究所SPF动物实验室[SyXK(京)2011-0030]标准啮齿动物饲料喂养,自由饮食。 饲养环境为室温20 ±2℃,光照时间12 h,相对湿度40%~55%。
1.2 分组及运动负荷
将100只实验大鼠随机分为一次力竭运动组 (n=40),2周反复力竭运动组(n=40),一次力竭运动安静对照组(n=10)和反复力竭运动安静对照组(n=10)。 其中一次力竭运动组和2周反复力竭运动组又分别按照取材时间不同 (最后一次力竭运动后即刻、4小时、12小时、24小时)随机分为4组,每组10只。 力竭运动大鼠尾部负重体重的3%进行游泳训练,力竭标准[6]:经过10s后动物仍不能返回水面, 并且捞出后置于平面不能完成翻正反射。 一次力竭各组进行上述力竭游泳运动1次;反复力竭组重复进行上述力竭游泳运动, 每天1次,每周6天,持续2周。 安静对照组不运动。
1.3 取材
最后一次力竭运动后即刻、4小时、12小时及24小时不同时相取材,迅速取出心脏,沿心脏矢状面的方向将整个心脏用OCT包埋, 液氮骤冷, 全心连续冰冻切片,光镜定位心脏传导系统。 运用激光显微切割仪(德国LEICA公司生产,型号为Leica6500),分别切割和收集窦房结细胞或细胞团[7]。
1.4 实时荧光定量PCR检测ICAM-1基因表达
采用Trizol法提取总RNA,并逆转录cDNA,存于-20℃备用。 通过互联网搜索Genbank查找目标因子ICAM-1和内参照β-actin的引物基因序列,应用Primer5软件进行引物设计, 引物扩增目标基因片断长度均小于150 bp, 其PCR产物用2%琼脂糖凝胶电泳检测验证引物可用后,再进行荧光定量PCR。 取定量PCR用96孔板, 加入cDNA和引物配制25 μL反应体系。 实时定量RT-PCR主要过程:预变性95℃30 s,PCR反应95℃10 s,60℃30 s,40个循环。 检测CT值。 设计的引物由上海生工生物技术有限公司合成。
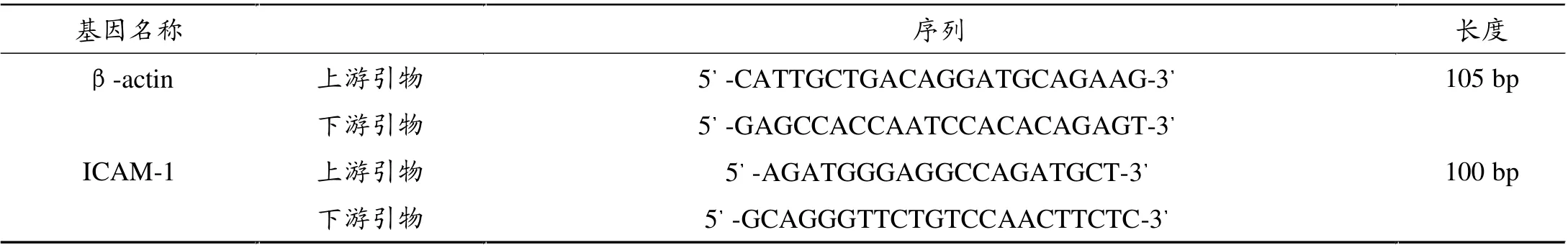
表1 基因名称及引物序列
1.5 免疫荧光检测ICAM-1蛋白表达
心脏传导系统冰冻切片进行免疫荧光组织化学染色, 采用LeicaADMDW活细胞多维图成像工作站和LeicaQwin图像分析系统对目标因子ICAM-1蛋白荧光强度进行定量, 荧光强度用积分灰度表示(Integrated Optical Density,IOD), 参考阴性对照标本中荧光强度,灰度值在40~130之间为蛋白阳性表达。
1.6 统计学分析
利用SDS2.2软件对实时定量PCR数据进行分析处理,并导出文件及图像。利用管家基因对目的基因的表达进行校正,得到相对定量结果(相对数值)。 结果用平均数±标准差表示, 组间比较采用多因素方差分析,显著性水平为P < 0.05。
2 结果
2.1 心脏传导系统ICAM-1 mRNA表达
2.1.1 一次力竭运动后心脏传导系统ICAM-1 mRNA表达特点
如表2所示, 经一次力竭运动后12小时心脏传导系统窦房结ICAM-1 mRNA表达显著高于对照组(P <0.05);房室结ICAM-1 mRNA表达各时相组间差异无显著性;24小时浦肯野氏纤维ICAM-1 mRNA表达显著高于对照组(P < 0.01)和其它时相组(P < 0.01)。
心脏传导系统不同部位ICAM-1 mRNA表达在一次力竭运动后存有差异。 一次力竭运动后4小时,房室结和浦肯野氏纤维ICAM-1 mRNA表达显著低于窦房结(P < 0.01);24小时,浦肯野氏纤维ICAM-1 mRNA表达显著高于窦房结和房室结(P < 0.01)。
2.1.2 反复力竭运动后心脏传导系统ICAM-1 mRNA表达特点
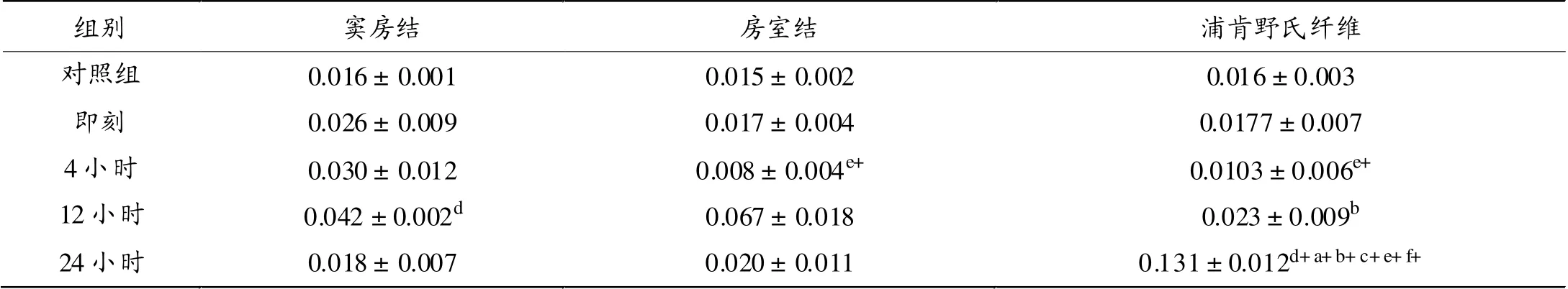
表2 一次力竭运动后大鼠心脏传导系统ICAM-1 mRNA相对表达量
如表3所示, 反复力竭运动后即刻、12小时心脏窦房结ICAM-1 mRNA表达显著高于对照组(P < 0.01),4小时和24小时显著低于即刻组(P < 0.05)、12小时组(P< 0.01);反复力竭运动后12小时浦肯野氏纤维ICAM-1 mRNA表达显著高于对照组和其他时相组(P<0.01)。
心脏传导系统不同部位ICAM-1 mRNA表达在反复力竭游泳运动后存有差异。 反复力竭运动后即刻房室结和浦肯野氏纤维ICAM-1 mRNA表达显著低于窦房结(P < 0.01);反复力竭运动后4小时浦肯野氏纤维ICAM-1 mRNA表达明显低于房室结(P < 0.05);反复力竭运动后24小时浦肯野氏纤维ICAM-1 mRNA相对表达显著低于房室结(P < 0.01)。
2.1.3 不同力竭运动后心脏传导系统ICAM-1 mRNA表达特点
2.1.3.1 窦房结ICAM-1 mRNA表达特点
如表2、表3、图1所示,两种力竭运动后心脏传导系统窦房结ICAM-1 mRNA相对表达各时相组间无显著差异。
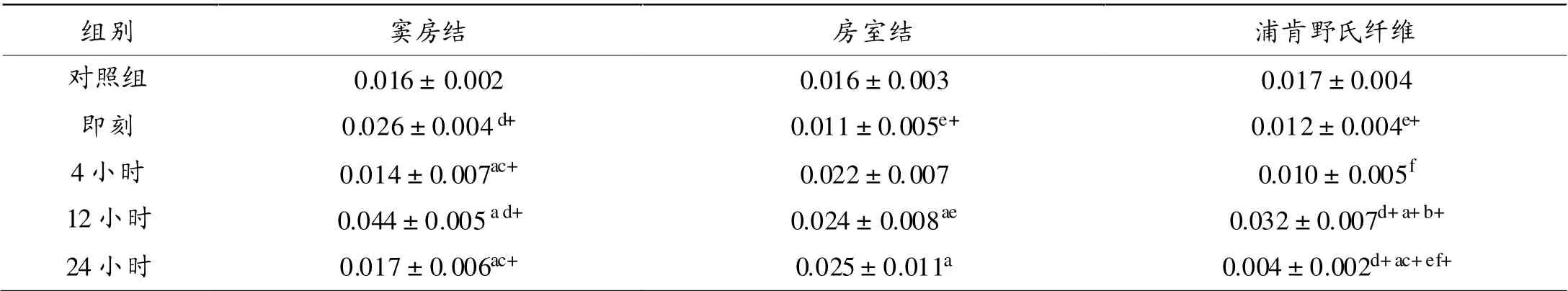
表3 反复力竭运动后大鼠心脏传导系统ICAM-1 mRNA相对表达量
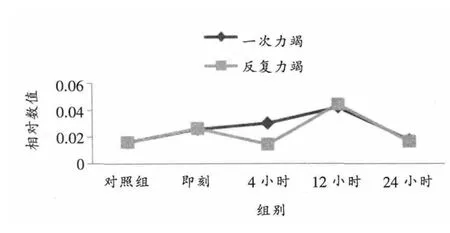
图1 不同力竭运动后大鼠窦房结ICAM-1 mRNA相对表达量
2.1.3.2 房室结ICAM-1 mRNA表达特点
如表2、 表3、 图2所示, 反复力竭后4小时房室结ICAM-1 mRNA相对表达显著高于一次力竭 (P < 0.05), 反复力竭后12小时房室结ICAM-1 mRNA表达显著低于一次力竭后(P < 0.01),其它时相组间无明显差异。
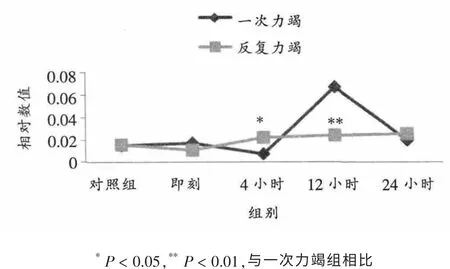
图2 不同力竭运动后大鼠房室结ICAM-1 mRNA相对表达量
2.1.3.3 浦肯野氏纤维ICAM-1 mRNA表达特点
如表2、表3、图3所示,反复力竭后24小时浦肯野氏纤维ICAM-1 mRNA相对表达显著低于一次力竭组(P< 0.05)。 其它时相组间无明显差异。
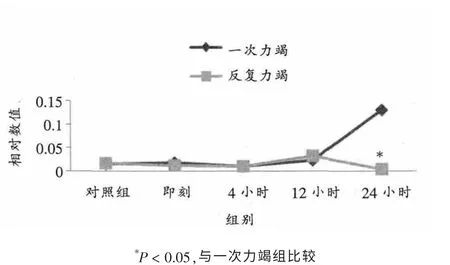
图3 不同力竭运动后大鼠浦肯野氏纤维ICAM-1 mRNA相对表达量
2.2 心脏传导系统ICAM-1蛋白表达结果
2.2.1 一次力竭运动后心脏传导系统ICAM-1蛋白表达特点
如表4所示, 一次力竭运动后4小时心脏窦房结ICAM-1蛋白表达显著高于对照组 (P < 0.01),12小时显著高于对照组和其它各运动组 (P < 0.01)。 房室结ICAM-1蛋白表达在一次力竭运动后12小时显著高于对照组和其它各运动组 (P < 0.01)。 浦肯野氏纤维ICAM-1蛋白表达在一次力竭运动后24小时显著高于对照组和其它各运动组(P < 0.01)。
心脏传导系统不同部位在一次力竭游泳运动后存有差异。其中,一次力竭运动后即刻窦房结ICAM-1蛋白表达显著高于房室结(P < 0.01),浦肯野氏纤维ICAM-1蛋白表达明显高于房室结(P<0.05)。 一次力竭运动后4小时房室结和浦肯野氏纤维ICAM-1蛋白表达显著低于于窦房结 (P < 0.01)。 一次力竭运动后12小时房室结ICAM-1蛋白表达显著高于窦房结(P < 0.01),浦肯野氏纤维ICAM-1蛋白表达又显著低于窦房结(P<0.01)。 一次力竭运动后24小时浦肯野氏纤维ICAM-1蛋白表达显著高于窦房结和房室结(P<0.01)。

表4 一次力竭运动后大鼠ICAM-1蛋白表达总灰度值
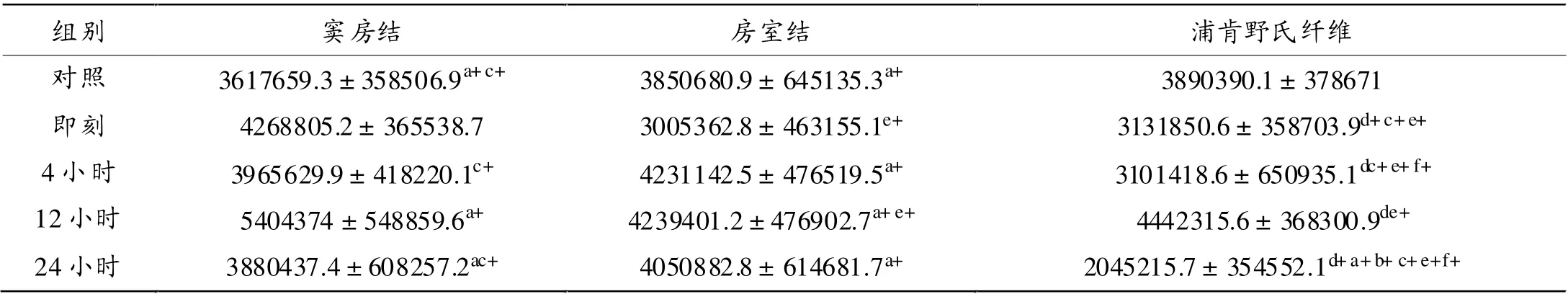
表5 反复力竭运动后大鼠ICAM-1蛋白表达总灰度值
2.2.2 反复力竭运动后心脏传导系统ICAM-1蛋白表达特点
如表5所示,与对照组相比,反复力竭运动后即刻、4小时和24小时浦肯野氏纤维ICAM-1蛋白表达明显降低(P<0.01,P<0.05)。与即刻组相比,运动后12小时窦房结ICAM-1蛋白表达明显升高(P<0.01),而24小时组和对照组明显较低(P<0.05,P<0.01)。同时,反复力竭对照组、4小时、12小时及24小时房室结ICAM-1蛋白表达均高于即刻组(P<0.01),与12小时组相比,对照组、运动后4小时和24小时窦房结ICAM-1蛋白表达明显较低(P<0.01), 同时运动后即刻、4小时和24小时浦肯野氏纤维也显著低于12小时组(P<0.01)。
心脏传导系统不同部位在反复力竭游泳运动后存有差异。 其中反复力竭运动后即刻和12小时房室结和浦肯野氏纤维ICAM-1蛋白表达显著低于窦房结(P<0.01)。
2.2.3 不同力竭运动后心脏传导系统ICAM-1蛋白表达特点
2.2.3.1 窦房结ICAM-1蛋白表达特点
如表4、表5、图4所示,一次力竭运动后心脏窦房结ICAM-1蛋白表达与反复力竭运动一致,各组间无明显差异。
2.2.3.2 心脏房室结ICAM-1蛋白表达特点
如表4、表5、图5所示,心脏传导系统房室结ICAM-1蛋白表达在反复力竭后即刻和12小时均显著低于一次力竭(P < 0.01),反复力竭后4小时显著高于一次力竭(P < 0.01)。 其它时相组间比较无明显差异。
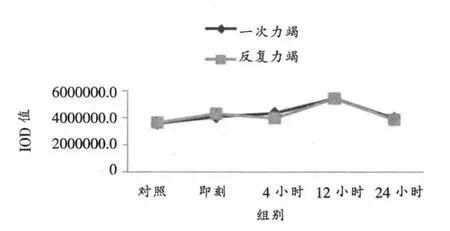
图4 不同力竭运动后大鼠窦房结ICAM-1蛋白表达总灰度值
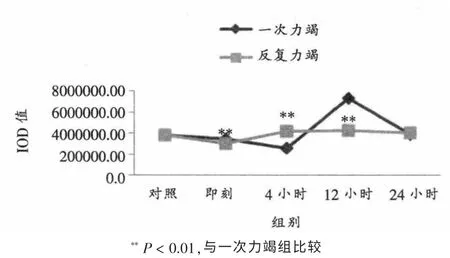
图5 两种不同力竭运动后大鼠房室结ICAM-1蛋白表达总灰度值变化情况
2.2.3.3 浦肯野氏纤维ICAM-1蛋白表达特点
如表4、表5、图6所示,心脏传导系统浦肯野氏纤维ICAM-1蛋白表达在反复力竭后24小时显著低于一次力竭(P < 0.01)。 其它时相组间比较无明显差异。
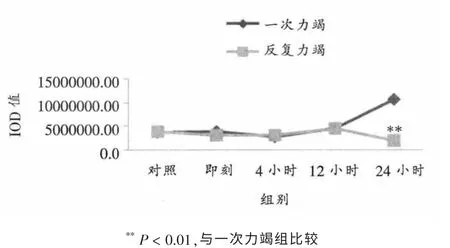
图6 不同力竭运动后大鼠浦肯野氏纤维ICAM-1蛋白表达总灰度值变化情况
3 讨论
ICAM-1是一种淋巴细胞功能相关抗原(LFA-1)的配体(克隆号CD54),属粘附分子免疫球蛋白超家族类单链糖蛋白。 ICAM-1在体内分布广泛,包括心肌细胞、各种上皮细胞、血管内皮细胞、成纤维细胞、单核巨噬细胞和淋巴细胞等。而ICAM-1的配体为LFA-1,属于整合素家族的跨膜糖蛋白, 主要分布于中性粒细胞(PMN)、自然杀伤细胞(NK)及T淋巴细胞等细胞表面。ICAM-1通过与LFA-1结合参与炎症反应、细胞免疫、微血管损害、血栓形成及缺血再灌注损伤等病理过程。 在缺氧/复氧对心肌细胞与PMN粘附效应的影响及ICAM-1和LFA-1在PMN介导的心肌细胞损伤中作用研究中发现,缺氧/复氧使心肌细胞与PMN粘附效应增加,心肌细胞损伤加重,ICAM-1和LFA-1参与这一过程[7]。 研究表明,ICAM-1的异常表达与心肌损伤、心功能衰竭、心脏移植排斥等多种心血管疾病的发病及治疗有关[10]。高血压左室肥厚时心肌中ICAM-1 mRNA和蛋白表达水平及巨噬细胞浸润显著增加,提示心肌ICAM-1过度表达及其介导的炎性细胞浸润参与了高血压左室肥厚的发病过程[4,5]。 用ICAM-1基因敲除鼠心肌缺血再灌注时心肌损伤程度明显减轻;ICAM-1基因阴性鼠重新转染ICAM-1基因后再进行缺血再灌注实验,其心肌损伤程度明显加重,用ICAM-1单克隆抗体则可以减轻缺血再灌注造成的心肌损害[16]。
本研究发现,一次力竭运动后心脏窦房结、房室结ICAM-1蛋白表达在运动后12小时达峰值, 随后下降;浦肯野氏纤维在运动后24小时达峰值, 而反复力竭运动后传导系统窦房结ICAM-1蛋白表达在运动后即刻和12小时出现两次波峰,房室结ICAM-1蛋白表达运动后即刻有所下降, 之后呈上升趋势; 浦肯野氏纤维ICAM-1蛋白表达4小时后开始上升,12小时达峰值,之后呈下降趋势。其中,心脏窦房结炎症因子增高幅度大且持续时间长,可能导致的细胞损伤更加严重,易诱发病态窦房结综合征[11]。 研究表明在正常情况下,心肌细胞表面的ICAM-1表达量较低; 但在某些病理情况下,TNF、IL-1等[14,15]细胞因子和脂多糖等可介导心肌细胞ICAM-1表达增强, 血管内PMN通过其LFA-1与VEC上的ICAM-1结合,从而相互粘附。 粘附一旦发生,即可通过多种机制损伤组织。 一次力竭运动后房室结ICAM-1 mRNA和蛋白表达出现两个峰值,且逐渐升高。 分析与力竭运动后TNF、IL-1等细胞因子和脂多糖等介导心肌细胞ICAM-1表达增强有关[11],ICAM-1升高,通过与LFA-1结合,粘附一旦发生,即可通过多种机制损伤房室结细胞。反复力竭后运动后,可能由于房室结细胞对反复力竭运动的适应, 房室结产生的炎症反应相对较轻。 本研究发现,一次力竭运动后,心脏传导系统浦肯野氏纤维ICAM-1 mRNA和蛋白表达呈上升趋势,可能与一次力竭运动后TNF、IL-1等细胞因子介导心肌细胞ICAM-1表达增强有关[11]。 ICAM-1升高,且运动后24小时ICAM-1表达显著高于对照组和其它各运动组,一旦发生粘附反应, 即可通过多种机制损伤心脏浦肯野氏纤维。 反复力竭运动后浦肯野氏纤维ICAM-1蛋白表达4小时开始上升,12小时达峰值, 且运动后12小时显著高于对照组和其他各运动组, 使浦肯野氏纤维损伤更严重,室性心律失常的发生率可能会更高,因而,力竭运动后心脏浦肯野氏纤维ICAM-1 mRNA和蛋白表达的升高,使浦肯野氏纤维结构和功能受损,影响正常心律的室内传导,形成运动性室性心律失常发生的基础。
总之, 力竭运动后心脏传导系统各部位炎性因子ICAM-1在mRNA和蛋白水平大量表达, 很可能继发传导系统炎性细胞浸润,细胞间质增殖乃至纤维化,成为运动性心律失常发生的重要机制之一。
4 小结
4.1 心脏传导系统不同部位ICAM-1 mRNA和蛋白表达的时相规律各异, 但心脏窦房结炎症因子增高幅度较大,持续时间较长。
4.2 力竭运动后心脏传导系统各部位炎性因子ICAM-1在mRNA和蛋白水平表达增加可能继发传导系统炎性反应, 是构成运动性心肌损伤与心律失常发生的机制之一。
[1] 曲绵域. 实用运动医学[M]. 北京: 北京科学技术出版社,1996. 311-318.
[2] 常芸. 运动心脏理论与实践[M]. 北京: 人民体育出版社,2008.106-132.
[3] 常芸. 运动员心脏的医务监督[M]. 北京:北京体育大学出版社,2010.203-207.
[4] 王岚峰,修春红,李丹,等. 急性心肌梗死后心肌微循环障碍与炎症反应的关系 [J]. 中华超声影像学杂志,2008,17(8):106.
[5] 占成业,潘李莉,等. 高血压左室肥厚时细胞间黏附分子-1在心肌中的表达及其作用[J]. 中华急诊医学杂志,2005,14(1):47-50.
[6] Sebastian S,Sebastian B,Matthias B,et al. Long- but not short-term multifactorial intervention with focus on exercise trainingimproves coronary endothelial dysfunctionin diabetes mellitus type 2 and coronaryartery disease[J]. European Heart J,2010,31:112-119.
[7] Kukielka GL,Hawkins HK,Michael L,et al. Regulation of intercellular adhesion molecule -1 (ICAM -1) in ischemicandreperfused canine myocardium [J]. J Clin Invest,2003,92(3):1504-16.
[8] Fan H,Sun B,Gu Q,et al. Oxygen radical strigge reactivation of NF-kappaB and AP-1 and up-regulation of ICAM-1 inreperfused canine heart [J]. Am J Physiol Heart Circ Physiol,2002,282(5):H1778-1786.
[9] 杜书朋,田惠玉. 心脏X综合征患者血清细胞间黏附分子-1和C-反应蛋白水平变化及意义[J]. 河北医药,2010,32(7):814-815.
[10] Davani EY,Dorscheid DR,Lee CH,et a1.Novel regulatory mechanism of cardiomyocyte contractility involving ICAM-1 and the cytoskeleton [J]. Am J Physiol Heart Circ Physiol,2004,287(3):H1013-1022.
[11] 常芸, 杨红霞. 不同力竭运动后大鼠心脏传导系统TNFαmRNA和蛋白表达的变化及其在运动性心律失常发生中的作用[J]. 体育科学,2012,32(7):32-38.
[12] 杨红霞,常芸. 力竭运动后不同时相心脏窦房结ADAMTS-1的变化[J]. 中国运动医学杂志,2011,30(5):437-441
[14] Green DJ,O’Driscoll G,Joyner MJ,et al. Exercise and cardiovascular risk reduction:Time to update the rationale for exercise[J]. J Appl Physiol,2008,105(2):766-768.
[15] Chaar V,Romana M,Tripette J,et al. Effect of strenuous physical exercise on circulating cell-derived microparticles[J].Clin Hemorheol Microcirc,2011,47(1):15-25.
[16] Palazzo AJ,Jones SP,Girod WG,et al. Myocardial ischemiareperfusion injury in CD-18 and ICAM-1-deficient mice[J].Am J Physiol,1998,275(62):2300-2307.

