雌性大鼠血浆游离DNA水平:过度训练的新监测指标?
郭志成 杨宏芳 王晓慧
上海体育学院运动科学学院(上海200438)
过度训练是指长时间训练导致的身体疲劳和机能下降在短时间内不能恢复, 疲劳不断增加或累积且运动能力下降。过度训练在竞技体育中并不少见,特别是备战比赛前的集训期。 过度训练不仅降低运动能力,还可能使运动员出现呼吸道感染等运动性免疫抑制症状,影响训练和比赛。目前,除运动员的主观感觉外,多应用7大类生理指标(血睾酮水平、皮质醇水平,睾酮/皮质醇比值,晨脉,Hb水平,血尿素、血清肌酸激酶)的综合评定来反映运动员是否出现过度训练及过度训练的程度和原因,但这些指标均没有特异性,且个体差异较大,不能准确地反映过度训练。 因此,需要有某种分子能准确地反映过度训练,并且检测方法简便、快速。近年来的研究显示, 血浆游离DNA (cell free DNA,cfDNA)的水平很可能是一个很好的候选分子。
cfDNA是指血浆或血清中未与细胞结合的双链DNA片段。 正常人体中血浆cfDNA的水平很低,当各种原因如肿瘤、过度训练等使组织、细胞过氧化,或使组织、细胞损伤、坏死而发生炎症时可使血浆cfDNA水平显著增加。 因此,血浆cfDNA水平也成为部分肿瘤如结肠癌[1]、乳腺癌[2]和前列腺癌[3]发生的敏感监测指标。 自1982年首次报道了运动通过增多的自由基损伤组织,引起DNA断裂,使血中出现较多的cfDNA[4]之后,近几年来关于运动对血浆cfDNA的影响及意义越来越受到研究者的关注。已发现多种运动方式,如马拉松[5-7]、举重[8]等耐力或抗阻的力竭运动会使cfDNA水平增加。且血中cfDNA的水平与过度运动所致无菌性炎症的严重程度[9]或运动强度[10]成正比。 血浆cfDNA的水平被认为是目前最有希望成为反映过度训练的特异指标[11]。
目前,用real time PCR方法研究血浆cfDNA水平的几乎都是针对人的研究,尚缺乏针对大、小鼠的研究。本课题组前期的研究建立了检测大鼠血浆cfDNA水平的real time PCR的方法,并研究了大强度训练所致的过度训练对雄性大鼠血浆cfDNA水平的影响,结果发现过度训练雄性大鼠的血浆cfDNA水平显著升高(约增加4.53倍), 血浆cfDNA水平能成为雄性大鼠过度训练的新监测指标[12]。 本研究在此基础上,检测由大负荷训练所致的过度训练对雌性大鼠血浆cfDNA水平的影响,研究其能否成为反映雌性大鼠过度训练的指标。 这不仅为过度训练提供新监测指标, 而且可利用过度训练大鼠模型进行过度训练机制的研究。
1 材料和方法
1.1 实验动物与分组
30只2月龄健康雌性SD大鼠购自上海第二军医大学实验动物中心, 生产许可证号:SCXK (沪)2013-0018,动物批号:2013001804004,使用许可证号:SYXK(沪)2014-0002。 随机分为3组:安静对照组、大强度训练组和过度训练组,每组10只。 自由摄食、饮水。
1.2 运动方案
安静对照组大鼠不进行跑台运动。 大强度训练组和过度训练组大鼠在跑台上适应性运动3天后进行9周的跑台训练,每周训练6天,休息1天。 运动方案参照文献[13-15]进行了部分修改。 两组大鼠的训练方案前6周相同,后3周大强度训练组大鼠每天训练30 min,而过度训练组大鼠训练到力竭。力竭标准为连续给予电刺激,大鼠不继续跑动,停跑后呼吸急促、神情倦怠,腹卧位,捕捉时逃避反应明显减弱。 具体训练方案见表1。
1.3 取材
每周六上午用天平称量各组大鼠体重。 第9周末训练结束后36小时,各组大鼠麻醉后进行腹腔静脉采血,EDTA抗凝,离心(3000 r/min,10 min)后取上清即血浆,保存于-80℃低温冰箱内待测。
1.4 测试方法
1.4.1 大鼠血浆游离DNA水平检测
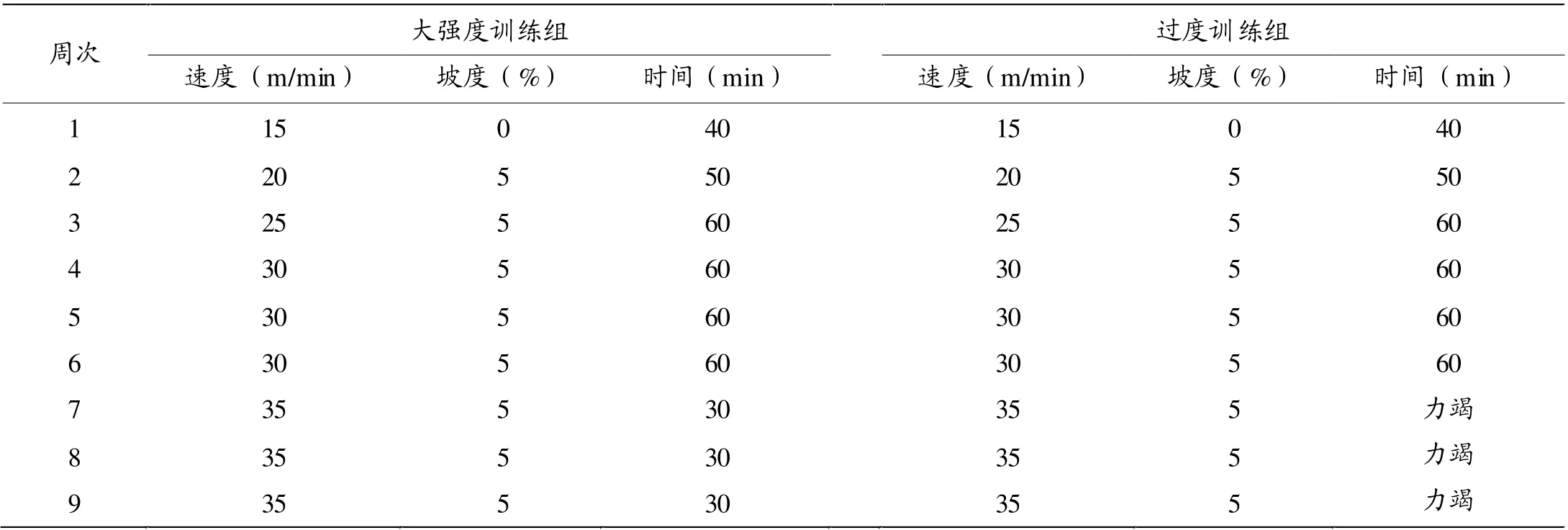
表1 大鼠训练方案
实时荧光定量PCR(美国ABI公司的Step One Plus)检测大鼠血浆游离DNA水平。 扩增基因为大鼠基因含量最丰富的B1重复序列,它与人类Alu基因同源。 扩增引 物 的 序 列 为:5’-CCA GGA CAC CAG GGC TAC AGA G-3’(正向)和5’-CCC GAG TGC TGG GAT TAA AG-3’(反向),扩增产物109 bp。 25 μl的PCR反应体系为:2 μl 的10 倍 稀 释 的 大 鼠 血 浆,2×Maxima SYBR Green/ROX qPCR Master Mix (Thermo scientific公司)12.5 μl,25 μM的上下游引物各0.3 μl, 不含DNA和RNA的去离子水9.9 μl。 95°C预变性8 min后,95°C变性30 s,55°C退火40 s,72°C延伸1 min,50个循环。 不同浓度的大鼠DNA标准品在同一条件下进行扩增, 做出标准曲线。所有标准品和血浆样品都做复孔。根据溶解曲线判断扩增的特异性, 再根据扩增曲线设定基线和阈值,利用标准曲线获得各样本的Ct值及DNA浓度。
1.4.2 大鼠血浆睾酮(T)、皮质酮(Cort)水平和T/C比值
睾酮和皮质酮ELISA试剂盒分别购于美国R&D和美国CUSABIO公司,按试剂盒说明书进行操作。睾酮的值除以皮质酮的值即为T/C比值。
1.4.3 大鼠血浆肌酸激酶和氧化、抗氧化指标检测
各检测指标试剂盒购自南京建成生物工程研究所。 比色法检测大鼠血浆肌酸激酶(CK)水平和超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活性。 将0.1 ml血浆在37°C反应5 min使GSH浓度降低1 μmol/L定义为谷胱甘肽过氧化物酶的一个酶活力单位。 TBA法检测大鼠血浆丙二醛(MDA)含量。
1.5 统计学分析
实验数据用SPSS 20.0软件包处理分析, 所有数据均以± s 表示。 体重采用重复测量方差分析;其余各指标采用单因素方差分析,组间比较采用LSD法。 皮尔森相关系数分析过度训练组cfDNA与其他指标的相关性。 P < 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体重变化
本研究中过度训练组有2只大鼠在第8周因肺炎死亡,可能与过度训练致大鼠抵抗力降低有关。实验前和6周递增负荷训练后3组大鼠体重无显著性差异,而9周后大强度训练组和过度训练组大鼠的体重与安静对照组相比均显著降低,且过度训练组降低得更明显。过度训练组大鼠体重从第7周力竭运动开始增长缓慢, 第8周停止增长,第9周下降;而大强度训练组大鼠体重在第7、8周还持续增长,到第9周停止增长(表2)。
2.2 各组大鼠血浆T、Cort水平和T/C比值
与安静对照组相比,过度训练组大鼠血浆T水平显著降低(P < 0.05),而大强度训练组大鼠血浆T水平无变化;大强度训练和过度训练组大鼠血浆Cort水平均显著升高(P < 0.05,P < 0.01)、T/C比值均显著降低(P <0.01)。 与大强度训练组相比,过度训练组大鼠血浆Cort显著增加(P < 0.01), 而血浆T水平和T/C比值无差异(表3)。
表2 各组大鼠体重变化(± s)
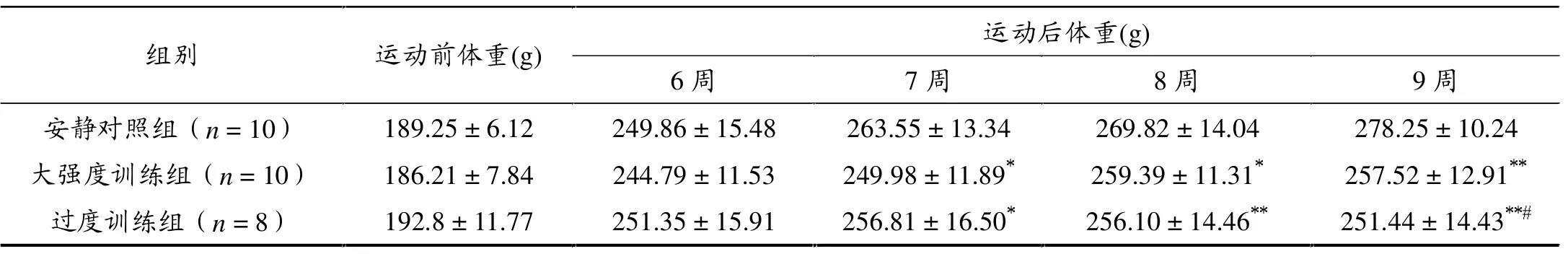
表2 各组大鼠体重变化(± s)
*P < 0.05,**P < 0.01,与安静对照组相比;#P < 0.05,与大强度训练组相比。
�����(g) �� �����(g) 6 � 7 � 8 � 9 � ������n = 10� 189.25���6.12� 249.86���15.48� 263.55���13.34� 269.82���14.04� 278.25���10.24��������n�=�10�� 186.21���7.84� 244.79���11.53� 249.98���11.89�� 259.39���11.31�� 257.52���12.91���������n�=�8�� 192.8���11.77� 251.35���15.91� 256.81���16.50�� 256.10���14.46��� 251.44���14.43����
与安静对照组相比, 大强度训练组和过度训练组大鼠血浆cfDNA水平均显著增加(P < 0.05,P < 0.01),均值分别是对照组的2.04倍和4.46倍左右;与大强度训练组相比,过度训练组大鼠血浆cfDNA水平显著升高(P< 0.05),均值约是大强度训练组的2.19倍(表3)。
表3 各组大鼠血浆T、Cort、T/C比值以及血浆cfDNA水平比较(± s)
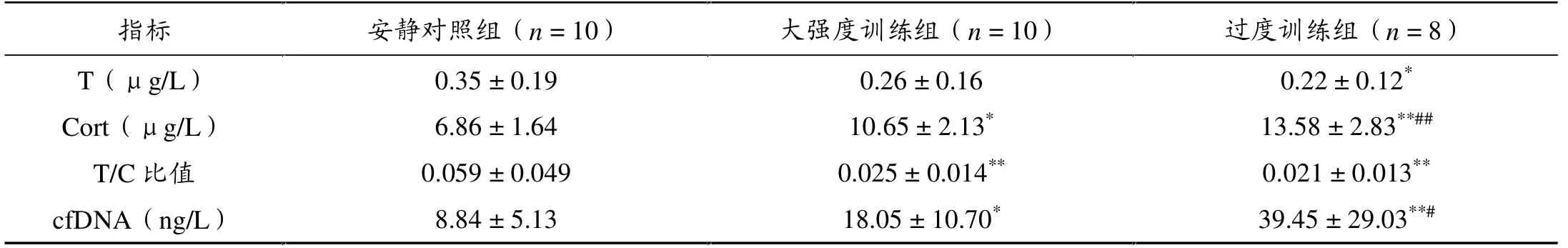
表3 各组大鼠血浆T、Cort、T/C比值以及血浆cfDNA水平比较(± s)
*P < 0.05,**P < 0.01,与安静对照组相比;#P < 0.05,##P < 0.01,与大强度训练组相比。
�� ������n = 10� �������n = 10� ������n = 8� T��g/L� 0.35���0.19� 0.26���0.16� 0.22���0.12*�Cort��g/L�� 6.86���1.64� 10.65���2.13*� 13.58���2.83**##�T/C ��� 0.059���0.049� 0.025���0.014**� 0.021���0.013**�cfDNA�ng/L�� 8.84���5.13� 18.05���10.70*� 39.45���29.03**#�
2.3 各组大鼠血浆CK、MDA水平及血浆SOD、GSH-Px活性比较
过度训练组大鼠血浆CK和MDA水平均较安静组和大强度训练组显著升高(P < 0.05),大强度训练组大鼠上述指标与安静对照组相比无显著差异(P > 0.05)。血浆SOD和GSH-Px的活性3组间无显著差异(表4)。
表4 各组大鼠血浆CK、MDA水平和SOD、GSH-Px活性比较(± s)
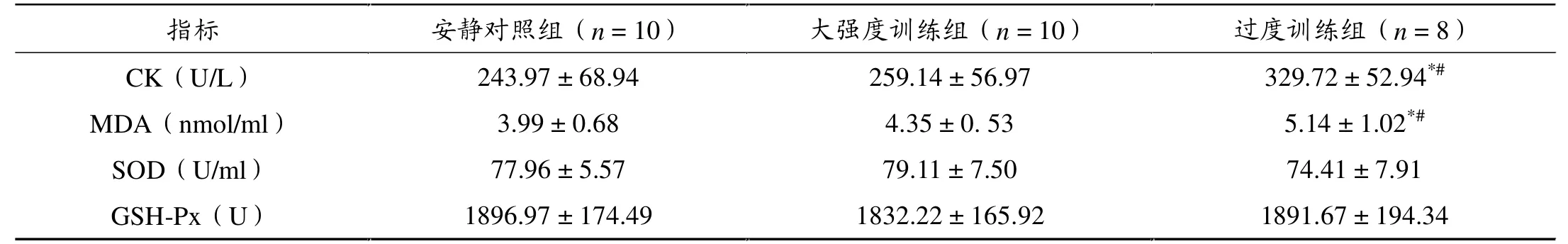
表4 各组大鼠血浆CK、MDA水平和SOD、GSH-Px活性比较(± s)
*P < 0.05,与安静对照组相比;#P < 0.05,与大强度训练组相比。
�� ������n = 10� �������n = 10� ������n = 8� CK�U/L� 243.97���68.94� 259.14���56.97� 329.72���52.94*#�MDA�nmol/ml�� 3.99���0.68� 4.35���0.�53� 5.14���1.02*#�SOD�U/ml�� 77.96���5.57� 79.11���7.50� 74.41���7.91�GSH-Px�U�� 1896.97���174.49� 1832.22���165.92� 1891.67���194.34�
2.4 过度训练组大鼠血浆cfDNA水平与其他指标的相关性
如表5所示, 血浆cfDNA水平与血浆Cort、T/C比值的相关系数具有统计学意义,分别为0.834(P < 0.01)、-0.459 (P < 0.05)。 血 浆cfDNA 水 平 与T、CK、MDA、GSH-Px和SOD的相关系数均没有统计学意义 (P >0.05)。

表5 血浆cfDNA水平与其他指标的相关性
3 讨论
3.1 血浆cfDNA是否能成为过度训练的监测指标?
对过度训练动物模型的判断主要是通过训练史、动物的形态指标和生理生化指标来确定。 体重下降常常提示有过度训练的可能, 运动能力下降在过度训练中也较突出。 此外,7大类生理指标在判断过度训练中起着非常重要的作用。 以往的过度训练动物模型中常见的是血睾酮水平、 血皮质酮水平、T/C比值和Hb水平显著下降,血清CK和尿素显著升高[15]等。本研究采用的过度训练模型 (6周递增训练+3周大强度力竭训练)已被证实是一成功的过度训练模型[13,14]。 同时,本研究还设一大强度运动对照组,即前6周的递增训练方案完全一样,后3周的运动强度也相同,但训练时间为30 min,而不是运动到力竭。 结果发现,过度训练雌性大鼠有2只大鼠因肺炎死亡;其余过度训练大鼠皮毛枯槁、眼神倦怠无光、体重降低;在造模后期大鼠力竭运动时间减少,提示运动能力降低。 运动后36 h过度训练大鼠血浆T水平、T/C比值显著下降, 血浆Cort和CK显著升高,表明过度训练组的雌性大鼠存在过度训练。 而大强度训练组大鼠则一般情况尚可,体重没有出现负增长;运动能力也没有显著变化; 运动后36 h的血浆T、CK水平没有改变,但T/C比值因Cort的显著增加而显著下降,表明大强度训练组大鼠未达到过度训练的程度。
定量PCR扩增血浆cfDNA的特异性、敏感度主要取决于选择的保守基因、扩增引物及扩增片段的长度。 人血浆cfDNA检测中常选择的保守基因是β-球蛋白、肌肉生长抑制素[11]和L1PA2[16],扩增片段的长度分别为189 bp、88 bp和双片段(90 bp和220 bp)。 本研究参考文献报道的实验室扩增小鼠B1基因的方法[17],扩增了与小鼠B1基因序列基本相同的大鼠B1基因。 由于cfDNA可能是全长的, 也可能是被随机剪切的双链DNA,为提高检出的敏感性和准确性,需选择拷贝数多的保守基因。 大、小鼠中的B1基因(与人的Alu基因同源)最保守,含量最丰富,约5万个拷贝,重复单位长130 bp,所以不论是全长的cfDNA,还是切断的cfDNA都能检测出来。根据溶解曲线,本研究证实该引物能特异地扩增大鼠B1基因; 测得的雌性安静对照组大鼠血浆cfDNA为8.84 ± 5.13 ng/L,之前测得的雄性安静对照组大鼠血浆cfDNA为2.46 ± 2.43 ng/L,推测这种差别可能来源于性别差异,也可能来源于年龄的不同(雌性大鼠17周龄,雄性大鼠13周龄)。 由于没有正常安静大、小鼠的血浆cfDNA范围,缺乏大、小鼠血浆cfDNA水平的研究,所以无法比较本方法与其他方法的优劣。
研究认为,不论是一次大强度过度训练[5-8,18],还是持续一段时间(慢性)的大强度或大负荷过度训练[9,11],都可使血浆cfDNA的水平迅速升高, 且增加幅度明显(从几倍到几十倍不等); 血浆cfDNA水平增加得越显著, 则越可能出现过度训练以及过度训练的程度越严重[9]。本研究结果显示大强度训练组和过度训练组大鼠血浆cfDNA水平均升高;且过度训练组大鼠血浆cfDNA水平比大强度训练组大鼠高,约是后者的2.19倍(39.45± 29.03 vs 18.05 ± 10.70 ng/L)。 相关性分析显示,雌性大鼠血浆cfDNA水平与血浆Cort水平正相关, 与T/C比值、运动能力显著负相关。 以上结果提示,与雄性大鼠一样,雌性大鼠血浆cfDNA水平也可以成为过度训练的监控指标。在耐力性运动持续一段时间后,若大鼠血浆cfDNA水平比安静时增加了4、5倍以上时, 提示可能存在过度训练。 而大强度训练未达到过度训练时, 血浆cfDNA水平也会增加,但增加幅度较低。当然,上述结果需更多的实验去证实。
如果是单次大强度运动, 则血浆cfDNA清除较快,通常在2~12小时内恢复正常[5-8,18],而慢性的大强度和大负荷过度训练不仅使血浆cfDNA快速升高,而且升高的cfDNA水平维持较久,从1天到十几天不等,与运动强度、运动负荷和运动项目有关[9,11]。 因此,本研究中连续力竭运动所致的过度训练大鼠在训练停止后36 h (以避免运动对血浆激素水平的影响) 仍能检测出高水平的血浆cfDNA水平。 根据血浆cfDNA在慢性过度训练中快速、明显地增加以及清除较慢的特点,可以推测:若想监测过度训练的出现和恢复过程, 或许可通过动态观察血浆cfDNA水平在训练后多个时间点的水平来实现。 此外,用血浆cfDNA水平反映过度训练还有一个优点,就是检测方便。 只需一滴血,就可快速(耗时3小时左右)、简便(只需分离血浆和PCR扩增)地获得血浆cfDNA的值。鉴于过度训练的危害,以及体重、运动能力和七大类生理指标检测的繁琐、耗时和缺乏特异性,能够简便、快速地检测血浆cfDNA水平来反映过度训练具有重要的实际应用价值。
3.2 过度训练导致血浆cfDNA增加的可能机制
1982年首次报道运动使血中出现cfDNA时,研究者就认为其可能机制是运动通过增多的自由基引起DNA断裂[4]。而部分研究也支持自由基增多或过氧化增强在运动使血浆cfDNA增多中的重要作用[9,10,19]。 本研究发现,过度训练的雌性大鼠血浆cfDNA水平显著升高的同时,血浆氧化反应产物MDA显著增加;但相关性分析中没有发现血浆cfDNA水平与MDA的相关性, 提示氧化增强可能与本研究由大负荷训练所致的过度训练雌性大鼠的血浆cfDNA水平的增加无关,这与我们关于大强度训练所致的雄性过度训练大鼠的研究结果不同,具体机制有待进一步研究。
除了氧化增强在运动增加血浆cfDNA水平中发挥作用之外,目前还得到较多认可的是:血浆cfDNA水平的来源是组织、细胞(包括肌肉细胞、免疫细胞和肿瘤细胞等)受损后损伤DNA的释放入血[9,11,20]。 血浆CK水平是最常用的反映骨骼肌细胞损伤及其适应与恢复的一个敏感指标。当大强度或大负荷运动,特别是大强度运动时,由于肌肉细胞膜的通透性增加、肌肉的损伤,肌细胞内的CK释放入血,导致血浆CK水平增加,因此血浆CK水平反映是否存在过度训练。 本研究发现,过度训练大鼠血浆CK水平显著增加,但相关性分析中未发现其与血浆cfDNA水平的相关性,提示本研究的过度训练大鼠模型中血浆cfDNA水平的增加可能与骨骼肌损伤无关。 这个结果与我们对雄性过度训练大鼠的研究结果相同,也与Fatouros等的研究类似。 他们发现尽管中等训练程度的运动员在跑台运动后反映骨骼肌损伤的多个指标包括血浆CK增加,但CK增加的动力学变化和cfDNA的不同,提示运动后cfDNA的释放机制可能与肌肉损伤无关[21]。
过度训练或大强度/大负荷的训练使血浆cfDNA增加的机制,除了上述的氧化增强和骨骼肌损伤机制外,目前还认为与血浆DNase活性增强[18]、骨骼肌细胞炎症反应、免疫细胞释放cfDNA、运动中乳酸的堆积和能量消耗等有关[11,16]。
4 总结
4.1 大强度训练和过度训练雌性大鼠血浆cfDNA水平均显著增加,且后者增加得更明显,提示血浆cfDNA水平增加得越显著,越可能出现过度训练。
4.2 雌性大鼠血浆cfDNA水平与反映过度训练的多个指标如T/C比值和血浆Cort有相关性, 提示雌性大鼠血浆cfDNA水平能成为过度训练的监测指标。
4.3 过度训练雌性大鼠血浆cfDNA水平的增加可能与氧化增强、骨骼肌损伤无关。
[1] Schwarzenbach H,Stoehlmacher J,Pantel K,et al. Detection and monitoring of cell-free DNA in blood of patients with colorectal cancer. Ann N Y Acad Sci,2008,1137:190-196.
[2] Catarino R,Ferreira MM,Rodrigues H,et al. Quantification of free circulating tumor DNA as a diagnostic marker for breast cancer. DNA Cell Biol,2008,27(8):415-421.
[3] Ellinger J,Müller SC,Stadler TC,et al. The role of cell-free circulating DNA in the diagnosis and prognosis of prostate cancer. Urol Oncol,2011,29(2):124-129.
[4] Davies KJ,Quintanilha AT,Brooks GA,et al. Free radicals and tissue damage produced by exercise. Biochem Biophys Res Commun,1982,107(4):1198-1205.
[5] Atamaniuk J,Vidotto C,Tschan H,et al. Increased concentrations of cell-free plasma DNA after exhaustive exercise.Clin Chem,2004,50(9):1668-1670.
[6] Atamaniuk J,Stuhlmeier KM,Vidotto C,et al. Effects of ultra-marathon on circulating DNA and mRNA expression of pro- and anti-apoptotic genes in mononuclear cells. Eur J Appl Physiol,2008,104(4):711-717.
[7] Beiter T,Fragasso A,Hudemann J,et al. Short-term treadmill running as a model for studying cell-free DNA kinetics in vivo. Clin Chem,2011,57(4):633-636.
[8] Atamaniuk J,Vidotto C,Kinzlbauer M,et al. Cell-free plasma DNA and purine nucleotide degradation markers following weightlifting exercise. Eur J Appl Physiol,2010,110 (4):695-701.
[9] Fatouros IG,Destouni A,Margonis K,et al. Cell-free plasma DNA as a novel marker of aseptic inflammation severity related to exercise overtraining. Clin Chem,2006,52 (9):1820-1824.
[10] Fogarty MC1,Hughes CM,Burke G,et al. Exercise-induced lipid peroxidation:Implications for deoxyribonucleic acid damage and systemic free radical generation. Environ Mol Mutagen,2011,52(1):35-42.
[11] Breitbach S,Tug S,Simon P. Circulating cell-free DNA:an up-coming molecular marker in exercise physiology. Sports Med,2012,42(7):565-586.
[12] 郭志成,殷亮,王晓慧. 检测大鼠血浆游离DNA的定量PCR方法的建立及意义. 中国应用生理学杂志,2015,31(2):186-190.
[13] 刘无逸,钱鹤,王磊,等. 过度训练对大鼠骨骼肌糖代谢的影响. 上海体育学院学报,2013,7(3):60-63.
[14] 杨晓红,王震,徐国琴. 过度训练动物模型分析. 广州体育学院学报,2010,30(3):88-91.
[15] 李丽,常波. 过度训练动物模型制备的研究进展. 沈阳体育学院学报,2011,30(5):77-82.
[16] Breitbach S,Sterzing B,Magallanes C,et al. Direct measurement of cell-free DNA from serially collected capillary plasma during incremental exercise. J Appl Physiol(1985),2014,117(2):119-130.
[17] Zhang H,Zhang SB,Sun W,et al. B1 sequence-based realtime quantitative PCR:a sensitive method for direct measurement of mouse plasma DNA levels after gamma irradiation.Int J Radiat Oncol Biol Phys,2009,74(5):1592-1599.
[18] Velders M1,Treff G1,Machus K1,et al. Exercise is a potent stimulus for enhancing circulating DNase activity. Clin Biochem,2014,47(6):471-474.
[19] Di Giacomo C,Acquaviva R,Sorrenti V,et al. Oxidative and antioxidant status in plasma of runners:effect of oral supplementation with natural antioxidants. J Med Food,2009,12(1):145-150.
[20] Brancaccio P,Lippi G,Maffulli N. Biochemical markers of muscular damage. Clin Chem Lab Med,2010,48 (6):757-767.
[21] Fatouros IG,Jamurtas AZ,Nikolaidis MG,et al. Time of sampling is crucial for measurement of cell-free plasma DNA following acute aseptic inflammation induced by exercise. Clin Biochem,2010,43(16-17):1368-1370.

