甘草酸对大鼠骨髓间充质干细胞体外成骨分化的影响
陈秋生,李 近,周满如,严文健,刘钰瑜,许卫铭
(广东医学院生理科学实验室1、药理学教研室2,广东 湛江524023)
甘草酸对大鼠骨髓间充质干细胞体外成骨分化的影响
陈秋生1,李 近2,周满如2,严文健2,刘钰瑜2,许卫铭2
(广东医学院生理科学实验室1、药理学教研室2,广东 湛江524023)
目的观察甘草酸对体外培养大鼠骨髓间充质干细胞成骨分化的影响。方法用传代贴壁筛选的方法分离纯化大鼠骨髓间充质干细胞。加药后5 d、7 d、9 d用PNPP法观察甘草酸对骨髓间充质干细胞(BMSCs)向成骨细胞方向分化的影响。用双抗体两步夹心酶联免疫吸附法检测甘草酸对细胞骨钙素(OCN)含量的影响。结果传代贴壁筛选的方法可得到骨髓基质细胞,其间存在有间质干细胞,经诱导后可向成骨细胞方向分化。甘草酸可以增加大鼠骨髓间充质干细胞成骨诱导后细胞碱性磷酸酶和骨钙素的含量,其中1×10-6mol/L浓度组作用7 d时效果明显。结论甘草酸能促进大鼠骨髓间充质干细胞向成骨细胞方向分化。
甘草酸;骨髓间充质干细胞;成骨细胞;分化
甘草(Glycyrrhiza)为豆科植物甘草、胀果甘草和光果甘草的根及根茎,最早见于《神农本草经》,我国中医因其具有补脾益气,清热祛痰等功效而誉为上品。甘草中的甘草酸(Glycyrrhizic acid,GA)是其最为重要的活性成分,有文献报道它具有对抗炎症、抗过敏、抗病毒、参与免疫调节作用、护肝、辅助促进吸收等功能[1]。研究表明,甘草的干燥根及根茎以及其提取物甘草酸以及其他甘草提取物都有较好的防治骨质疏松症的作用[2-3]。我们课题组前期的预试也发现GA和雌激素联合应用可增加骨羟脯氨酸的含量,增大骨断裂载荷和最大载荷,改善去卵巢小鼠骨的结构,提升松质骨结构力学。但目前甘草酸对骨髓间充质干细胞成骨分化作用的研究较少,本实验观察甘草酸对大鼠骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)的增殖、成骨分化的影响,为研究利用甘草酸防治骨质疏松提供更多的科学实验依据。本实验时间为2013年1月至2014年7月。
1 材料与方法
1.1 材料 低糖培养基DMEM和高糖培养基、胎牛血清(购自Gibco公司);四硝基苯基磷酸二钠盐(PNPP)、L抗坏血酸、β甘油磷酸钠、地塞米松和甘草酸标准品(购自Sigma公司);骨钙素检测的ELISA试剂盒和碱性磷酸酶染色试剂盒(均购自南京建成生物有限公司);NAPCO二氧化碳恒温培养箱(5420-1,Precision Scientific,USA);XD-101倒置相差显微镜(江南光电股份有限公司);酶标仪:Bio-ELX-800型,美国。
1.2 方法
1.2.1 BMSCs的分离和培养1个月龄SD大鼠10只,雌雄各半,体重(70±10)g。颈部脱臼后,浸泡于75%酒精,超净工作台上无菌分离两侧的股骨,75%酒精浸泡,无菌磷酸盐缓冲液(PBS)中浸泡,去除软组织后浸泡于低糖的DMEM中,用低糖DMEM冲洗股骨的骨髓腔,将收集冲洗出的细胞液1000 r/min离心10min后,弃上清液后,用含10%胎牛血清(FBS)的低糖DMEM培养液以1×107/cm2密度接种到25cm2培养瓶中,24 h后首次半量更换培养液以去除悬浮细胞,以后每3~4 d全量换液1次,细胞70%~80%融合后采用胰酶消化传代。取传至第3代的间充质干细胞(Mesenchymal stem cells,MSCs)进行诱导分化实验,每项实验2次重复。
1.2.2 成骨诱导方法 成骨诱导组加入成骨诱导液。成骨诱导液包含β磷酸甘油10mmol/L、抗坏血酸50mg/L、地塞米松1×10-8mol/L。
1.2.3 碱性磷酸酶活性测定(PNPP法) 取96孔板,每孔2×104/cm2密度接种经传3代的MSCs,每孔100 μl。培养48 h后诱导组加入成骨条件培养基,加药组加入不同浓度的甘草酸,甘草酸终浓度分别为1×10-8mol/L、1×10-7mol/L、1×10-6mol/L、1×10-5mol/L、1×10-4mol/L。分别于药物作用第5天、第7天、第9天测定细胞碱性磷酸酶含量。测定时,去掉培养液,PBS冲3遍,按试剂盒说明书操作,用酶标仪测定各孔405 nm波长下的吸光度值(OD405)。
1.2.4 ELISA法检测骨钙素(OCN)含量 将经传3代的MSCs消化后,以1×104/cm2细胞数加入48孔板,次日加药,分为空白对照组、成骨诱导组、不同浓度的甘草酸组。每3 d更换一次新鲜的培养液和药物,收集7 d内的细胞培养液,按ELISA试剂盒说明检测OCN的含量。
1.3 统计学方法 采用SPSS15.0统计软件,计量资料以均数±标准差(±s)表示,各组间资料比较采用t检验。SPSS11.0软件行方差分析并行Bonferroni组间比较,双侧P<0.05为差异具有统计学意义。
2 结 果
2.1 骨髓间充质干细胞的鉴定 原代细胞在镜下观察,可看到多种细胞形态。24 h后原代取材的细胞开始贴壁。48 h后,大部分细胞已经贴壁展开,出现团簇集落。经传代换液的方式纯化后的BMSCs细胞呈均一的长梭形贴底部,局部呈漩涡形整齐排列(图1)。成骨诱导后用碱性磷酸酶染色后有阳性细胞,证实所收集培养的细胞具有成骨分化能力(图2)。

图1 大鼠骨髓间充质干细胞一般形态(10×10)

图2 大鼠骨髓间充质干细胞体外培养成骨诱导后经碱性磷酸酶染色的形态(10×4)
2.2 甘草酸对大鼠骨髓间充质干细胞增殖的影响 各组间细胞抑制率差异有统计学意义(F=4.047,P=0.0075)。1×10-4mol/L的甘草酸抑制了大鼠骨髓间充质干细胞的增殖,该浓度组大鼠骨髓间充质干细胞增殖抑制率在培养24 h、48 h和72 h后都显著增高,与空白对照组和成骨诱导组比较,差异具有统计学意义(F=47.01,P=0.0101;F=17.83,P=0.0409),见表1。
表1 甘草酸对大鼠骨髓间充质干细胞增殖的影响(±s,%)
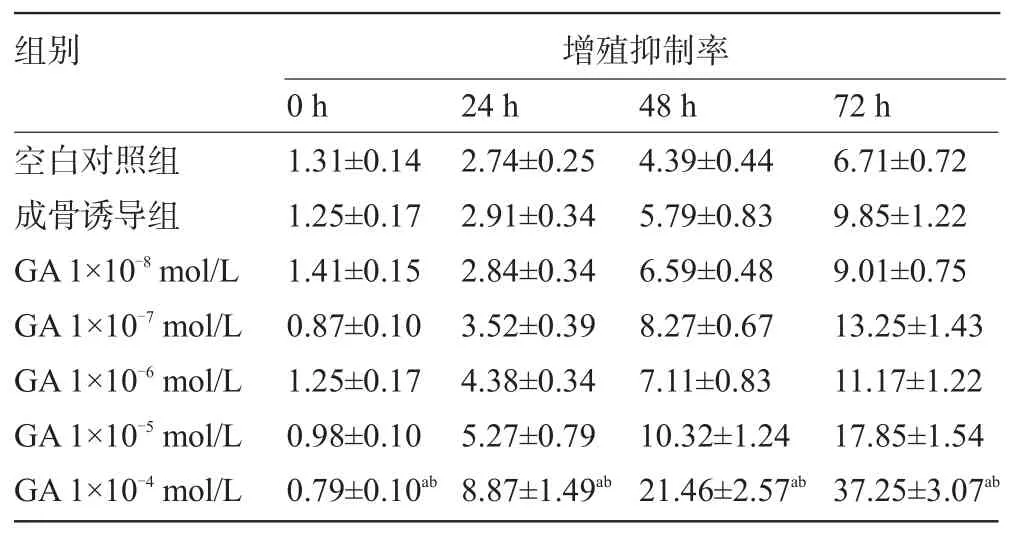
表1 甘草酸对大鼠骨髓间充质干细胞增殖的影响(±s,%)
注:与对照组比较,aP<0.05;与成骨诱导组比较,bP<0.05。
组别 增殖抑制率0 h24 h48 h72 h空白对照组成骨诱导组GA1×10-8mol/L GA1×10-7mol/L GA1×10-6mol/L GA1×10-5mol/L GA1×10-4mol/L1.31±0.141.25±0.171.41±0.150.87±0.101.25±0.170.98±0.100.79±0.10ab2.74±0.252.91±0.342.84±0.343.52±0.394.38±0.345.27±0.798.87±1.49ab4.39±0.445.79±0.836.59±0.488.27±0.677.11±0.8310.32±1.2421.46±2.57ab6.71±0.729.85±1.229.01±0.7513.25±1.4311.17±1.2217.85±1.5437.25±3.07ab
2.3 甘草酸对大鼠骨髓间充质干细胞成骨诱导后碱性磷酸酶含量的影响 成骨诱导组的碱性磷酸酶含量升高,3 d时与对照组比较有极显著的升高(P<0.01),在第7天达到高峰,第9天时开始回落。与对照组比较,1×10-8mol/L、1×10-7mol/L、1×10-5mol/L、和1×10-4mol/L浓度甘草酸无促进碱性磷酸酶表达的作用。1×10-6mol/L浓度的甘草酸可促进碱性磷酸酶表达,作用与成骨诱导组相当。碱性磷酸酶含量随着培养天数的延长而逐渐升高,在第7天达到高峰,第9天开始回落。其中1×10-6mol/L浓度的甘草酸作用7 d,药物促进碱性磷酸酶表达的作用最明显(F=4.311,P=0.0083),见表2。
表2 甘草酸对大鼠骨髓间充质干细胞碱性磷酸酶含量的影响(±s,mol/L)
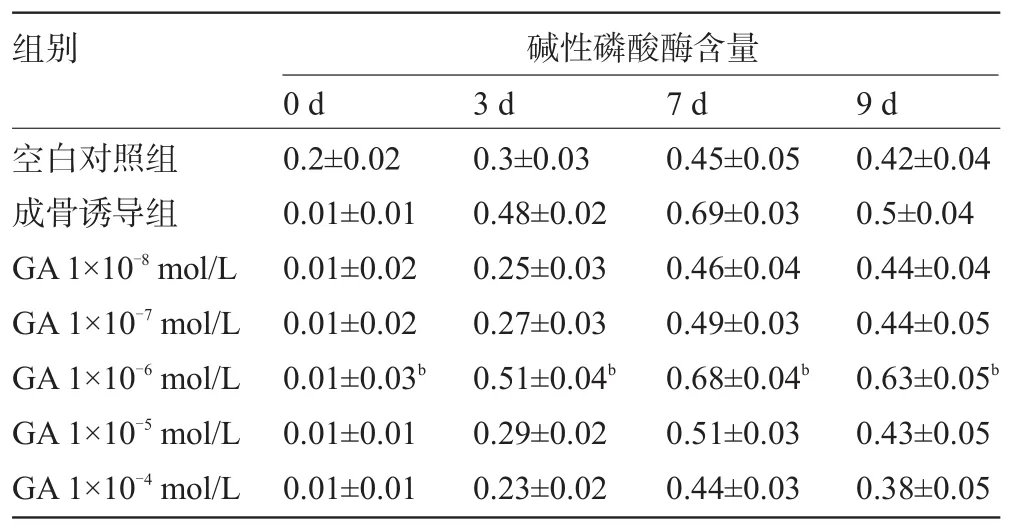
表2 甘草酸对大鼠骨髓间充质干细胞碱性磷酸酶含量的影响(±s,mol/L)
注:与对照组比较,aP<0.01。
组别 碱性磷酸酶含量0 d3 d7 d9 d空白对照组成骨诱导组GA1×10-8mol/L GA1×10-7mol/L GA1×10-6mol/L GA1×10-5mol/L GA1×10-4mol/L0.2±0.020.01±0.010.01±0.020.01±0.020.01±0.03b0.01±0.010.01±0.010.3±0.030.48±0.020.25±0.030.27±0.030.51±0.04b0.29±0.020.23±0.020.45±0.050.69±0.030.46±0.040.49±0.030.68±0.04b0.51±0.030.44±0.030.42±0.040.5±0.040.44±0.040.44±0.050.63±0.05b0.43±0.050.38±0.05
2.4 甘草酸对大鼠骨髓间充质干细胞骨钙素含量的影响 和对照组比较,成骨诱导组的骨钙素含量升高(P<0.01)而且呈持续增高。与空白对照组比较,1×10-8mol/L、1×10-7mol/L和1×10-4mol/L浓度甘草酸没有促进骨钙素浓度增高。1×10-6mol/L和1×10-5mol/L浓度的甘草酸可促进骨钙素表达,作用与成骨诱导组相当。随着培养天数的延长,骨钙素含量逐渐升高。其中1×10-5mol/L浓度的甘草酸作用最明显(F=2.900,P=0.043),见表3。
表3 甘草酸对大鼠骨髓间充质干细胞骨钙素含量的影响(±s,mol/L)
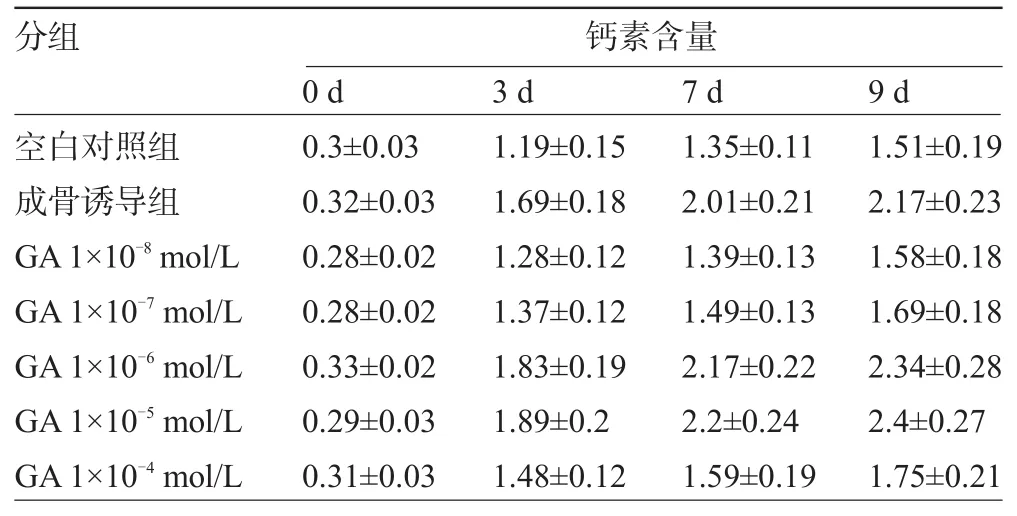
表3 甘草酸对大鼠骨髓间充质干细胞骨钙素含量的影响(±s,mol/L)
分组 钙素含量0 d3 d7 d9 d空白对照组成骨诱导组GA1×10-8mol/L GA1×10-7mol/L GA1×10-6mol/L GA1×10-5mol/L GA1×10-4mol/L0.3±0.030.32±0.030.28±0.020.28±0.020.33±0.020.29±0.030.31±0.031.19±0.151.69±0.181.28±0.121.37±0.121.83±0.191.89±0.21.48±0.121.35±0.112.01±0.211.39±0.131.49±0.132.17±0.222.2±0.241.59±0.191.51±0.192.17±0.231.58±0.181.69±0.182.34±0.282.4±0.271.75±0.21
3 讨论
骨质疏松(Osteoporosis,OP)是一种主要特征为骨量减少、骨的微观结构退化,从而导致骨强度降低、骨脆性增加而易发生骨折的全身性代谢骨病。随着医学技术高速发展,人民预期寿命获得大幅延长。但也因此,骨质疏松症也日渐成为常见病种而引起临床重视[4],如何预防和治疗也成为骨相关学科的研究重点。能否从细胞水平研发药物,促进干细胞向成骨细胞分化,从而逆转骨质疏松过程,成为了防治骨质疏松症的较有前途的方法之一。
骨髓间充质干细胞(MSC)是成人体内具有多向分化潜能的干细胞,它位于骨髓结缔组织中。MSC可在不同诱导条件下分化为成骨细胞或脂肪细胞[5]。如果MSC向成骨分化减弱或者向成脂分化增强都会导致人体内骨量的减低,从而诱导产生骨质疏松症。因此,如何逆转这一过程,研发增强MSC向成骨转化的药物,已成为干细胞骨转化相关的骨质疏松症治疗领域的目标。
如前言所述,甘草酸作为甘草重要成份,对骨代谢的影响及治疗作用日益受到重视。本课题组发现,在甘草酸对抗小鼠肝纤维化及骨丢失的实验中,一定剂量的甘草酸可增加四氯化碳小鼠模型的骨量和骨钙,骨羟脯氨酸含量也同时增高3倍以上[6-7]。这说明甘草酸具有促成骨细胞生长以及分泌的功能,调控骨组织中的微量元素的含量,从而发挥抗肝纤维所致的骨质丢失。相关文献也报道,甘草酸具有改善关节、修复骨膜损伤的功能[8]。此外,它还协助癸酸钠促进细胞吸收降钙素,从而抑制骨吸收[9]。其作用机制是降低上皮细胞膜两侧的电阻,增强结肠吸收降钙素能力,从而提高药物的生物利用度,使骨吸收和骨重建达到平衡状态。去卵巢小鼠以甘草酸联合雌激素处理后其第四腰椎最大载荷显著增强[10]。此外,也有文献报道老年性骨质疏松可以甘草附子汤等中医治疗[11-12]。这些均表明单独使用甘草酸或与雌激素联用可能有助于治疗骨质疏松症。但是甘草酸在成骨分化方面的详细作用及机制、以及其在骨质疏松模型动物的详细作用机制仍待阐明。
本研究聚焦于在细胞以及分子水平方面,甘草酸促成骨的详细作用。实验结果提示甘草酸具有促进MSCs向成骨细胞方向分化的作用。1×10-6mol/L的浓度可提高碱性磷酸酶活性。同时该浓度既可促进碱性磷酸酶表达,也可促进骨钙素的分泌。成骨细胞早期发育阶段特异性标志物就是碱性磷酸酶。它可抑制骨矿化过程中的无机焦磷酸盐向无机磷水解,在细胞外基质矿化中起关键作用。它的活性高低可反映成骨细胞的成熟状态。而成骨细胞晚期发育阶段的标志物则是骨钙素,同时它也是骨中最丰富的非胶原蛋白[13]。我们的研究结果说明,加入甘草酸后,MSC的碱性磷酸酶和骨钙素的表达出现显著提高。这说明甘草酸在MSC的成骨分化过程的早期和晚期,也就是骨分化的全过程均有一定的促进作用。而这也是甘草酸拮抗骨质疏松的可能作用机制。
甘草及甘草甜素的一系列风险及安全评估结果均表明甘草并无潜在的致畸、致突变等遗传毒性。美国FDA、国际卫生和粮农组织食品添加剂法规委员会等机构也均认为甘草和甘草提取物、如甘草甜素等属于安全无毒物质。鉴于甘草酸几乎没有毒副作用,而我们的研究结果也表明其具有抗骨质疏松作用,它有望开发为高效低毒的抗骨质疏松药物,将造福广大骨质疏松患者。
[1]陈 真,陈国庆,杜海波,等.盐胁迫对甘草中甘草酸含量的影响[J].生物技术世界,2014,12:30.
[2]刘彩云.HPLC法测定内蒙古不同产地甘草中甘草酸的含量[J].内蒙古医学杂志,2014,46(3):337-338.
[3]国家药典委员会.中华人民共和国药典(2010年版一部)[M].北京:中国医药科技出版社,2010:80-81.
[4]张 江,关雪峰.中医药防治原发性骨质疏松症研究进展[J].辽宁中医药大学学报,2015,17(2):96-98.
[5]张密霞,王秀云,石田寅夫,等.甘草酸对骨髓间充质细胞诱导为多潜能干细胞重编程关键基因表达的影响[J].吉林中医药,2012,32(7):705-709.
[6]邹丽宜,吴 铁,崔燎.甘草酸对四氯化碳致小鼠肝纤维化及骨丢失的防治作用[J].中国药理学通报,2002,18(4):437-441.
[7]吕小华,陈 科,刘枉瑜,等.甘草酸对慢性哮喘小鼠骨代谢的影响[J].时珍国医国药,2013,24(1):110-111.
[8]张皖东.雷公藤甲素配伍甘草酸对胶原诱导性关节炎大鼠的影响[D].北京:中国中医科学院,2007.
[9]lmai T,Sakai M,Ohtake H,et al.Absorption-enhancing effect of glycyrrhizin induced in the presence of capric acid[J].Int J Pharm,2005,294(1-2):11-21.
[10]曾晓东,欧定强,刘月红,等.雌激素联合甘草酸对去卵巢小鼠骨代谢及生物力学指标的影响[J].山东医药,2011,51(47):9-11.
[11]Li YB,Xie LM,Li M,et al.Effect of jianpi bushen fermula medicated serum on the directed differentiation of rabbit mesenchymal stem cellsin vitro[J].Chinese J Trad Med Traum&Orthop,2010,18(5):13-15.
[12]宋 囡,何文智,王智民,等.骨髓间充质干细胞在骨向分化的作用及中医药研究进展[J].中国骨质疏松杂志,2014,20(1):95-99.
[13]刘 红,廖二元,伍贤平.骨钙素与代谢性骨病[J].国外医学:内分泌学分册,2004,24(4):239-240.
Effect of glycyrrhizic acid on differentiation of rat bone marrow mesenchymal stem cells in vitro.
CHEN Qiu-sheng1,LI Jin2,ZHOU Man-ru2,YAN Wen-jian2,LIU Yu-yu2,XU Wei-ming2.Laboratory of Physiological Science1,Department of Pharmacology2,Guangdong Medical College,Zhanjiang524023,Guangdong,CHINA
ObjectiveTo observe the effect of glycyrrhizic acid on proliferation and differentiation of cultured rat bone marrow mesenchymal stem cell.MethodsRat bone marrow mesenchymal stem cells were isolated and purified.On the5th,7th,9thday after medication,PNPP method was used to study the effects of glycyrrhizic acid on alkaline phosphatase,and ELISA was used to detect the effects of glycyrrhizic acid on osteocalcin secretion.ResultsBone marrow stromal cells were obtained through culture,in which the mesenchymal stem cells can be induced to differentiate into osteoblasts.Glycyrrhizic acid could increase the levels of alkaline phosphatase and osteocalcin in rat bone marrow mesenchymal stem cells after osteogenic induction,and the effect was the most significant in cells treated with1×10-6mol/L glycyrrhizic acid for7 days.ConclusionGlycyrrhizic acid can promote rat bone marrow mesenchymal stem cells to differentiate into osteoblasts.
Glycyrrhizic acid;Bone marrow mesenchymal stem cells;Osteoblasts;Differentiation
R-332
A
1003—6350(2015)22—3281—03
2015-04-14)
10.3969/j.issn.1003-6350.2015.22.1192
湛江市科技攻关项目(编号:2012C3106021);广东省大学生创新创业训练计划项目(编号:1057112016)
许卫铭。E-mail:642081529@qq.com

