砂粒粒径与砂层厚度对单体筐养养殖系统中三疣梭子蟹(Portunus trituberculatus)幼蟹摄食行为与生长特性的影响研究*
徐永健 申屠基康, 丁张妮
(1. 宁波大学海洋学院 应用海洋生物技术教育部重点实验室 宁波 315211; 2. 宁波市海洋与渔业研究院 宁波 315010)
三疣梭子蟹(Portunus trituberculatus)是重要的海洋经济动物, 隶属甲壳纲、十足目、梭子蟹科、梭子蟹属, 分布于中国、朝鲜、日本等海域, 是我国重要的渔业资源(乔振国等, 2012)。其肉肥鲜美, 是人们所喜爱的海产品。由于生活水平的提高, 对三疣梭子蟹的需求量增加, 养殖业得到了迅猛的发展, 但仍有一些问题有待研究解决, 例如养殖成活率低、产量不稳定等(乔振国等, 2012)。
当前, 国内外对梭子蟹的研究主要涉及: 养殖方式(郝志凯等, 2011; 张国喜等, 2012; 夏金树等,2012)、形态特征(高保全等, 2008)、生长发育(Romanoet al, 2006; 刘磊等, 2009; Cuiet al, 2012)、饲料营养(Wuet al, 2007; Juliana, 2009)、养殖条件(Bryarset al,2006; Stickleet al, 2007; 廖永岩等, 2008; 王冲等,2010; Liuet al, 2014)及病害防治(Wanet al, 2011; Muet al, 2012; Zhanget al, 2014)等。三疣梭子蟹生性好斗, 喜以大欺小, 以强欺弱, 互相残杀, 从而导致大量幼蟹附肢缺失, 甚至死亡或被同类捕食, 尤其是正在蜕皮的梭子蟹受攻击的概率较大(丁天宝等, 2009)。如何从养殖方法和技术上突破梭子蟹养殖过程中的自残问题, 提高梭子蟹的养殖成活率, 业界也开展过一些尝试, 如采用单个养殖方式(沈烈峰等, 2013)和投放保护掩体(伊祥华, 2004)等。作者在以上这些经验的基础上, 发展形成了梭子蟹单体筐养养殖技术(single-crab basket-culture, SCBC), 并开展了规模化生产试验, 较大地提高了梭子蟹的养殖成活率, 获得了较好的经济效益(王春琳等, 2013)。但在生产中也发现了一些新的问题, 如梭子蟹生长缓慢、性腺发育延后, 病害加剧等(与养殖户交流)。
行为是生物对环境的综合反映, 是动物福利(animal welfare)科学的主要评价指标(Ashley, 2007)。作者针对梭子蟹单体筐养养殖系统开展了系列试验,从行为(尤其是摄食行为)角度探讨三疣梭子蟹的养殖条件, 评估筐养养殖系统中各条件对梭子蟹摄食行为的胁迫, 进而对梭子蟹生长的影响, 对了解梭子蟹基本生物学特性, 以及更好地改进其养殖设施和养殖方法, 提高梭子蟹的养殖效益有指导意义。本文主要探讨筐养养殖系统的重要组成保护掩体砂盒中的不同砂粒粒径大小及砂层厚度对三疣梭子蟹幼蟹摄食行为以及生长的影响以及其机理, 分析在该系统中, 幼蟹饲养过程中所需的砂粒粒径组成与砂层厚度, 为健全梭子蟹的单体筐养养殖系统, 提升梭子蟹的设施养殖技术提供参考。
1 材料与方法
1.1 梭子蟹的来源与暂养
试验在宁波大学的水产养殖实验基地开展。所用三疣梭子蟹幼蟹(以下简称幼蟹)体重为(0.89±0.14)g(Mean±SD,n=325, 下同), 壳长(23.39±1.31)mm, 壳宽(11.07±0.82)mm, 壳高(4.81±0.35)mm, 来自宁波市象山县东陈乡水产育苗场人工育苗的幼蟹并经水泥池暂养。幼蟹于2013年6月份活体运输到试验的养殖基地, 暂养于15 m2、底铺沙(底沙先经高锰酸钾消毒, 再用清水将其漂洗干净晾干待用)的水泥池, 加海水至 15cm, 海水盐度 20±0.5, 水温(26±1)°C, 连续充气。每日更换新鲜海水, 早晨 9:00投喂食物(饵料为采购于市场的冰冻虾仁)。适应4d后, 随机选取四肢健全的健康幼蟹进行试验。
1.2 试验设计与日常管理
试验容器为市场采购的塑料箱, 规格为L63×W45×H40 cm。本试验包括两个部分, 一为砂粒粒径大小, 设4个处理: ① 大砂粒(LPS), 粒径>2mm; ②小砂粒(SPS), 粒径<0.2mm; ③ 混合砂粒(MPS): 50%LPS + 50% SPS; ④ 无砂(NS)。二为砂层厚度(砂市购,经消毒), 设 4个处理: ① 无砂(0 cm); ② 2 cm厚;③ 5 cm厚; ④ 8 cm厚。
每组设15个重复(其中5只用于酶活分析, 10只用于生长统计分析)。随机选取适宜的幼蟹, 分别称重后放入到各个试验容器中。除砂层厚度试验外, 各容器分别铺5cm底沙和放15cm海水。让幼蟹在容器中适应24h后, 次日上午9:00投饵, 开始试验。之后的5d内, 每天上午清除残饵, 并换50%海水后, 投喂新饵料。其它条件同暂养。
1.3 分析方法
试验期间, 每天采集一只幼蟹(全蟹匀浆取上清),用于各种酶活分析, 包括三种消化酶类(淀粉酶, 蛋白酶, 脂酶)和三种保护性酶类[超氧化歧化酶(SOD),多酚氧化酶(POD), 过氧化氢酶(CAT)], 分析酶活采用试验盒测定(南京建成生物工程公司, 中国南京)。其余 10只幼蟹用于生长统计分析, 包括每天的摄食量(g)、蜕皮率(%)、成活率(%), 试验结束时统计各处理的体重增长率(%)等。另外, 根据每只幼蟹每天的摄食量及其体重来计算各处理中梭子蟹的单位体重的食物摄入量(food ration, g/gBW)。另, 各处理中梭子蟹的行为特性采用SONY 2216E摄像机(SONY公司)进行拍摄, 通过反复观察视频来区分与描述各个行为, 各行为分类见表1。

表1 梭子蟹行为分类描述Tab.1 Ethogram of P. trituberculatus activity patterns
1.4 数据分析
采用单因素方差分析(ANOVA), 对各处理的摄食量、蜕皮率、死亡率及增重率等进行差异显著性分析, 如果P>0.05为差异不显著,P<0.05则为差异显著,P<0.01则为差异极显著。对各处理中的梭子蟹的行为特性及差异采用 Dunn检验比较分析(徐永健等,2011)。
2 结果
2.1 对摄食行为的影响
砂粒粒径对梭子蟹幼蟹行为的影响是明显的(表2)。在大粒径(LPS)砂中, 幼蟹一般休息在砂面上(Rs),且不停地改变位置, 其行为方式与无砂组(NS)相似(Q≤3.36,P>0.05)。24小时内, 有1—2次摄食行动,每次持续 30—40 min (32.7±1.77), 总进食时间为(43.0±15.79) min。在混合砂(MPS)中, 幼蟹挖砂洞休息(Rh), 饥饿时出来以游泳方式(As)寻找食物。该行为可驯化(3d), 可提前在投喂处等待投饵。1天内有2—3次进食, 每次40—60 min (46.6±6.36), 总进食时间有(116.4±12.45) min, 在摄食次数(P<0.05)、单次进食时间(P<0.01)及总进食时间(P<0.01)上都大大超过LPS和NS组; 在细砂(SPS)中, 幼蟹也挖洞休息(Rh), 砂洞约 1 cm 深, 蟹体与砂面呈 30—45°角潜入, 仅露眼睛及触角在外。一天有3—6次进食, 总进食时间为(142.7±22.52) min, 在摄食次数(P<0.05)与总进食时间(P<0.05)上都高于MPS组。
砂层厚度对幼蟹行为的影响也是明显的(表2)。在不铺砂容器中, 幼蟹停留在容器底面(Rs), 各行为方式与LPS组相似。2 cm组, 幼蟹有挖砂洞动作, 但最终休息在砂面上(Rs)或略埋砂中(整个背甲露于外)。1天内有 1—3次进食, 每次约 40 min (38.6±11.73), 总进食时间有(68.3±19.57) min。在摄食次数、单次进食时间与无砂组(NS)无差异(P>0.05), 仅在总进食时间上稍长于NS组(P<0.05); 5 cm组与8 cm组间, 幼蟹各方面的表现相似; 且各有关参数表现也相似于MPS组。
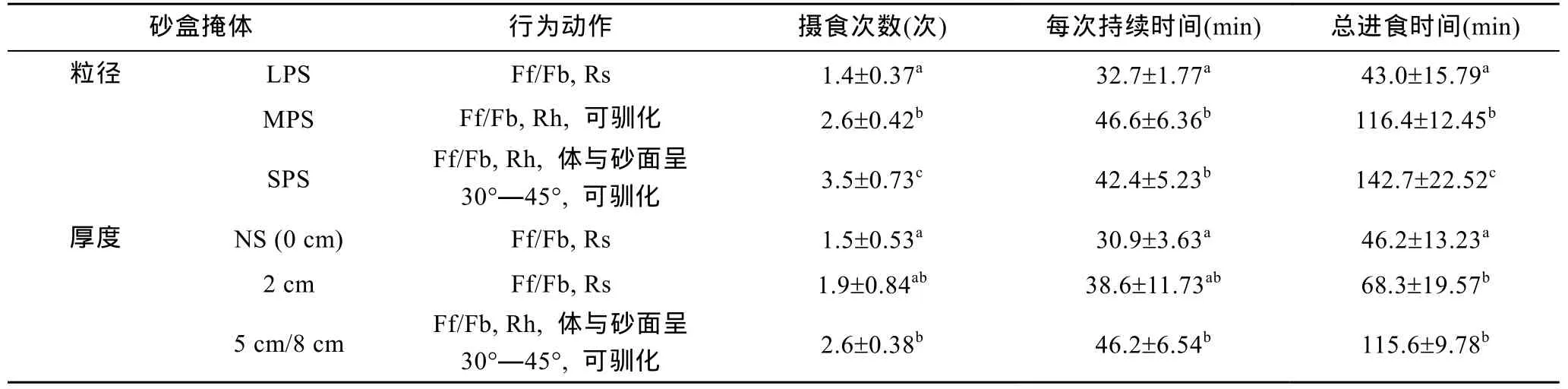
表2 砂粒粒径及砂层厚度对幼蟹摄食行为的影响Tab.2 Comparison in feeding behavior among different treatments
2.2 对幼蟹摄食量的影响
砂粒粒径大小对幼蟹摄食量的影响见图1。各组平均摄食量分别为: 无砂(NS)组, (0.1151±0.0143) g/gBW;粗砂(LPS)组, (0.1327±0.0185) g/gBW; 混合砂(MPS)组, (0.1974±0.0076) g/gBW; 细砂(SPS)组, (0.2427±0.0137) g/gBW。经分析, 前两者间差异不显著(P>0.05), 与后两者差异极显著(P<0.01), 而后两者间也存在显著差异(P<0.05)。
砂层厚度对幼蟹摄食量也有影响(图1)。各组平均摄食量分别为: 无砂组, (0.1151±0.0143) g/gBW;2 cm 组, (0.1494±0.0133) g/gBW; 5 cm 组, (0.2076±0.0105) g/gBW; 8 cm组, (0.2087±0.0046) g/gBW。经分析, 前两者间略有差异(P<0.05), 后两者间却无差异(P>0.05); 无砂组与后两组间有极显著差异(P<0.01), 而2 cm组与后两组间仅略有差异(P<0.05)。各项数据表明2 cm组是无砂组到高砂组的过渡。
2.3 对幼蟹蜕皮与成活率的影响
砂粒的粒径差异影响到幼蟹的蜕皮率及成活率(图2)。试验期间, NS组与LPS组, 分别有4只和3只幼蟹死亡, 而 MPS与 SPS组都没有死亡; 而蜕皮情况刚相反, NS、LPS分别有2只和3只蜕皮, 而MPS与SPS组几乎全都蜕皮。从4个处理看, MPS与SPS组中幼蟹的体重增长最快, 分别增加了(0.768±0.124)g和(0.814±0.113)g, 体重增长率分别为86.3%±4.88%和 91.5%±3.43%, 该两个组间无差异(P>0.05), 但比 NS [(0.198±0.312)g, 22.25%±35.38%]及 LPS [(0.227±0.299)g, 25.52%±27.97%]高出 2—4 倍(P<0.01)(图2)。饵料系数(FCR)在各处理中分别为:NS 11.33± 3.36; LPS 8.64±1.21; MPS 1.45±0.32; SPS 1.17±0.11。前两者间差异显著(P<0.05), 并与后两有极显著差异(P<0.01), 后两者间差异不显著(P>0.05)。

图1 砂粒粒径及砂层厚度对幼蟹平均摄食量的影响Fig.1 The average food ration of the juveniles in different treatments
砂层厚度也对幼蟹的蜕皮率和成活率有影响(图2)。0 cm(NS)组与2 cm组, 幼蟹死亡4只和3只, 而5 cm与8 cm组都无死亡; 蜕皮情况, 0 cm、2 cm、5 cm及8 cm各组分别有20%、40%、100%、100%蜕皮。此外, 有关幼蟹增重率, 与蜕皮有密切关系, 在5 cm及8 cm组中增重最多, 分别增加了(0.776±0.118) g和(0.791±0.121) g, 体重增长率分别为 87.3%±3.58%和88.9%±3.74%, 该两组间无差异(P>0.05), 但比 0 cm[(0.198±0.312) g, 22.25%±35.38%]及 2 cm [(0.426±0.217)g, 47.87%±18.27%]高出 2—4 倍(P<0.01)(图2)。饵料系数(FCR)在各处理中分别为 0 cm, 11.33±3.36;2 cm, 6.64±1.34; 5 cm, 1.44±0.34; 8 cm, 1.37±0.23。前两者间差异显著(P<0.01), 并与后两有极显著差异(P<0.01), 后两者间差异不显著(P>0.05)。
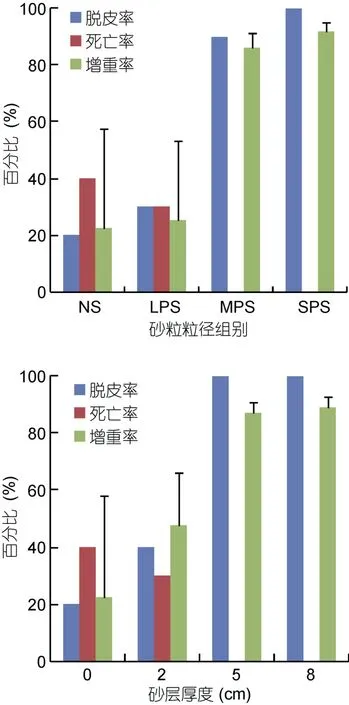
图2 各处理幼蟹脱皮率、死亡率及体重增长率Fig.2 The moulting and mortality rates and body weight gain in different treatments
2.4 对梭子蟹酶活的影响
砂粒粒径及砂层厚度对梭子蟹幼蟹体内的酶活都有影响(图3)。图中柱状显示值为每个处理中5天酶活测定的平均值。三种保护性酶类(SOD, POD,CAT)活性随着砂粒粒径变小和砂层厚度增加而降低。在粒径试验中, 细砂组(SPS)对幼蟹胁迫最少, SOD、CAT低于MPS组(P<0.05), SPS与MPS也低于LPS与NS, 而LPS与NS间差异不显著; POD在MPS、LPS及NS间无差异(P>0.05)。在厚度试验中, 5 cm与8 cm组间三种保护酶类活性差异不显著, 并低于2 cm及0 cm组(P<0.05), 除CAT外, 2 cm及0 cm组间该三酶活性差异不显著, 且变化幅度大。三种消化酶类(淀粉酶, 蛋白酶, 脂酶)活性则表现与保护性酶类相反特性。不同粒径组的活性表现为SPS>MPS>LPS=NS; 不同厚度组的活性表现为: 5 cm组与8 cm组无差异(P>0.05), 蛋白酶和淀粉酶活性大于2 cm组(P<0.05), 脂酶活性相似; 2 cm组中淀粉酶和脂酶的活性大于0 cm组(P<0.05), 但蛋白酶活性与0 cm组无差异(P>0.05)。
3 讨论
在试验及生产中都发现: 三疣梭子蟹具有潜砂的习性, 无砂层栖息的三疣梭子蟹, 不但互残现象严重而且死亡率高。潜沙(即有保护掩体)不仅可以躲避敌害,更是休息和减少能量消耗的最佳方式(叶佳琳, 2007)。三疣梭子蟹蜕壳时, 也需要躲藏起来(宋鹏东, 1982)。本试验从行为角度, 发现掩体砂的特性(粒径、厚度)能影响到梭子蟹幼蟹的摄食行为, 进而影响到其摄食量,以及用于生长的能量贮备。试验结果表明, 砂粒粒径以及砂层厚度都对梭子蟹幼蟹的养殖成活率产生影响。
图3 各处理中幼蟹体中消化酶及保护性酶类活性的变化Fig.3 Variations in enzyme activity of the juvenile crabs in different treatments
3.1 砂粒粒径对摄食行为与生长的影响
幼蟹在无砂及粗砂中, 其行为特性和活动方式有了较大的改变(以静息为主、外出活动减少), 导致摄食量下降; 表明无砂和粗砂的养殖方式对其行为的胁迫比较大, 进而会影响到了其正常生长。当在混合沙中, 幼蟹的行为恢复常态, 摄食量也相应增加了。而当在细沙中, 幼蟹的摄食量明显增加, 给予外界刺激, 反映敏感很快潜入砂中(在粗砂中也有类似潜砂动作, 或紧贴于砂面静止不动, 但相对的反应时间要长得多)。类似结果也有报道, 臧维玲等(2003)试验了粒径1—2 mm的粗砂和粒径70μm左右的细沙,发现幼虾更喜欢细沙; 林雄生(1996)也指出三疣梭子蟹养殖中底质为细砂最佳。这不但与甲壳类的摄食行为有关, 作者推测可能还与甲壳类蜕皮及表面防御污损生物附着有关。试验发现: 在粗砂与细砂中, 蜕皮后两者留下的砂坑深浅不同, 粗砂中较深而细砂中浅, 甲壳类蜕皮时动作激烈, 需要有一定的缓冲能力而又能着力的底质, 显然粗砂不如细砂着力效果好, 粗砂被弹飞多而坑更深, 也许在粗砂中蜕皮化费的能量也更多; 此外, 细砂对蜕皮间期的梭子蟹的体表抗污损效果更好(潜砂物理摩擦作用)。因此, 根据上述结果, 可以认为梭子蟹幼蟹养殖时采用细砂(粒径<200μm)的效果更好。
3.2 砂层厚度对生长的影响
沙层厚度也对幼蟹的行为特性和活动方式产生影响(如无砂组), 影响摄食量、影响生产, 以及造成死亡等。但是最少有效厚度(与甲壳高有关)如何, 没有检索到相关的文献报道。作者认为, 砂层厚度应该与上述提及的“甲壳类蜕皮及表面防御污损生物附着”作用有关。尤其是抗污损, 甲壳类抗污损需有硬质底(Wahl, 1989; Daviset al, 1994; Beckeret al, 1996),还有作者也推测, 潜埋是抗污损的最好方式(Svavarssonet al, 1994)之一, 蜕皮也是(Beckeret al, 1996)。蜕皮与潜埋都需要有一定厚度的砂层存在才能起作用,本试验发现, 2 cm厚度还是有效厚度(蟹壳高0.5 cm),而>5 cm的砂厚度就能很好地起作用。关于最少有效厚度问题以及成蟹的砂层厚度等问题, 还有待更深入开展研究。
3.3 摄食行为研究对养殖方式和养殖技术的影响
动物通过摄食获得能量物质, 是生长的基础。梭子蟹的生长是一个复杂的过程, 是不连续的生长(高保全等, 2008; 刘磊等, 2009)。其蜕皮成功一次, 就快速生长一次, 一次蜕皮体重可增长一倍(图2)。蜕皮(蜕壳)是一个复杂的生理过程, 需要消耗大量的能量,也需要大量能量维持旧壳中物质再吸收(Romanoet al, 2006; Stickleet al, 2007; 王冲等, 2010)。因此, 梭子蟹需要在蜕皮间期增加摄食量, 储存足够的营养物质, 从而满足其蜕皮生长的需要。环境胁迫导致幼蟹摄食能量不足及付出更多能量抵抗胁迫(Bryarset al, 2006; Stickleet al, 2007)。本试验把摄食量(摄食行为)与蜕皮率(生长速率)密切联系起来, 摄食行为正常时, 梭子蟹生长正常(蜕皮与增重); 而摄食行为异常, 梭子蟹死亡率高。因此, 在梭子蟹的养殖过程中,满足其生长条件, 维持正常的行为特性, 可促进梭子蟹的快速生长。这就需要不断地改进梭子蟹的养殖设施和条件, 提高养殖方法和技术。而对其适宜生长条件的了解与掌握, 可通过对梭子蟹的日常行为(如:摄食行为)方式的观察与分析, 并在此基础上不断地改进梭子蟹的养殖方式和逐步提高养殖技术而达到。这就是动物福利(animal welfare)科学, 可以从行为角度开展研究。
丁天宝, 刘振华, 2009. 影响梭子蟹池塘养殖成活率的因素及应对措施. 河北渔业, 8: 21—22
王冲, 姜令绪, 王仁杰等, 2010. 盐度骤变和渐变对三疣梭子蟹幼蟹发育和摄食的影响. 水产科学, (29): 510—514
王春琳, 母昌考, 李荣华等, 2013. 三疣梭子蟹单体筐养高产高效生产技术. 中国水产, 1: 72—76
叶佳琳, 2007. 三疣梭子蟹高密度越冬技术. 中国水产, 3:54—55
乔振国, 王春琳, 房文红等, 2012. 海水蟹类安全生产技术指南. 北京: 中国农业出版社, 152—153
伊祥华, 2004. 关于三疣梭子蟹养殖的几点思考. 中国水产, 6:61—63
刘磊, 李健, 高保全等, 2009. 三疣梭子蟹不同日龄生长性状相关性及其对体重的影响. 水产学报, 33(6): 964—971
宋鹏东, 1982. 三疣梭子蟹的形态和习性. 生物学通报, (5) :18—21
张国喜, 费忠智, 殷秋所等, 2012. 蟹池套养小龙虾高效生态养殖对比试验. 水产养殖, 6: 10—12
林雄生, 1996. 三疣梭子蟹池塘育苗初试成功. 水产养殖, 2:11—13
郝志凯, 郭建军, 孔祥青, 2011. 日照沿海虾蟹生态混养试验.河北渔业, (6): 30—31
夏金树, 周庆华, 倪红军等, 2012. 日本对虾、三疣梭子蟹混养存在的问题与对策. 河北渔业, (4): 19—20
徐永健, 戴广谱, 陆慧贤, 2011. 大海马昼夜活动节律与缠绕物偏好的观察. 宁波大学学报(理工版), 24(1): 1—4
高保全, 刘萍, 李健等, 2008. 三疣梭子蟹形态性状对体重影响的分析. 海洋水产研究, 29(1): 44—50
臧维玲, 戴习林, 姚庆祯等, 2003. 底质对日本对虾幼虾生长的影响. 上海水产大学学报, 12(1): 72—75
廖永岩, 肖展鹏, 袁耀阳, 2008. 三疣梭子蟹幼体和幼蟹的温度适应性. 水生生物学报, 32(4): 535—541
Ashley P J, 2007. Fish welfare: current issues in aquaculture.Applied Animal Behavior Science, 104(3): 199—235
Becker K, Wahl M, 1996. Behavior patterns as natural antifouling mechanisms of tropical marine crabs. J Exp Mar Biol Ecol,203: 245—258
Bryars S R, Havenhand J N, 2006. Effects of constant and varying temperatures on the development of blue swimmer crab (Portunus pelagicus) larvae: Laboratory observations and field predictions for temperate coastal waters. Journal of Experimental Marine Biology and Ecology, 329(2): 218—229
Cui Z, Song C, Liu Yet al, 2012. Crustins from eyestalk cDNA library of swimming crabPortunus trituberculatus: molecular characterization, genomic organization and expression analysis.Fish Shellfish Immunol, 33(4): 937—945
Davis A R, White G A, 1994. Epibiosis in a guide of sessile subtidal invertebrates in south-eastern Australia: a quantitative survey. J Exp Mar Biol Ecol, 177: 1—14
Juliana C B, 2009. Appropriate food type, feeding schedule and Artemia density for the zoea larvae of the mud crabScylla tranquebarica(Crustacea: Decapoda: Portunidae). Aquaculture, 288: 190—198
Liu Y, Shi G, Cui Z, 2014. PtSerpin from the swimming crabPortunustrituberculatus,aputativeregulatorof prophenoloxidase activation with antibacterial activity. Fish Shellfish Immunol, 35(1): 167—173
Mu C K, Liu S, Song Wet al, 2012. Enhanced resistance ofPortunus trituberculatustoVibrio alginolyticusby selective breeding. Chinese Journal of Oceanology and Limnology,30(4): 638—643
Romano N, Zeng C S, 2006. The effects of salinity on the survival growth and haemolymph osmolality of earlyjuvenile blue swimmer crabs,Portunus pelagicus. Aquacul ture, 260: 151—162
Stickle W B, Wyler H J, Dietz T H, 2007. Effects of salinity on the juvenile crab physiology and agonistic interactions between two species of blue crabs,Callinectes sapidusandC. similesfrom coastal Louisiana. Journal of Experimental Marine Biology and Ecology, 352: 361—370
Svavarsson J, Davidsdottir B, 1994. Foraminiferan epizoites on arctic isopods as indicators of isopod behavior. Mar Biol,118: 239—246
Wahl, 1989. Marine epibiosis. I. Fouling and antifouling some basic aspects. Marine Ecology Progress Series, 58: 175—189
Wan X H, Shen H, Wang L Bet al, 2011. Isolation and characterization ofVibrio metschnikoviicausing infection in farmedPortunus trituberculatusin China. Aquaculture International, 19(2): 351—359
Wu X G, Cheng Y X, Sui L Y, 2007. Effect of dietary supplementation of phospholipids and highly unsaturated fatty acids on reproductive performance and offspring quality of Chinese mitten crab,Eriocheir sinensis, female broodstock. Aquaculture, 273: 602—613
Zhang X J, Bai X S, Yan B Let al, 2014.Vibrio harveyias a causative agent of mass mortalities of megalopa in the seed production of swimming crabPortunus trituberculatus.Aquaculture International, 22(2): 661—672

