16S rDNA克隆文库解析仿刺参(Apostichopus japonicus)苗种培育池中生物絮团的细菌群落结构*
任利华 李 斌 孙国华 张秀珍① 杨建敏 姜 芳 刘丽娟 刘兆存
(1. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验 烟台 264006; 2. 山东华春渔业有限公司 东营 257236)
生物絮团(biofloc)是异养微生物、藻类、原生动物及其胞外物等在水体中形成的絮状悬浮物, 作为海洋微生物的集合体, 在海水生态系统中具有重要的地位(Simonet al, 2002; 包卫洋等, 2010)。生物絮团技术在水产养殖中有净化水质和为养殖动物提供饵料等作用, 能够明显降低养殖成本, 提高成活率和生长率(Burfordet al, 2004; Hariet al, 2004; Kuhnet al,2010)。仿刺参(Apostichopus japonicus)又称刺参, 是我国北方重要的养殖种类, 但随集约化养殖的迅猛发展, 养殖水体中无机氮、有机物积累, 造成养殖环境污染病害流行, 制约了刺参养殖产业的健康可持续发展(乔聚海等, 2009)。将生物絮团技术应用于刺参苗种培育, 可以有效提高其生长率、成活率及免疫酶活性(张秀珍等, 2014), 利用生物絮团技术解决当前刺参养殖过程中潜在的环境问题, 保持刺参养殖业的健康持续发展具有十分重要的意义。生物絮团中主要活性功能成分——微生物群落结构组成对生物絮团特定功能的行使起着重要作用, 进行细菌群落结构特征和多样性研究是解析生物絮团功能作用并有效利用的基础。
评价环境样本中的微生物多样性最精确的方法就是获得其克隆的序列信息, 克隆文库的构建是环境微生物分子生态学中用来研究微生物组成的常用方法之一(Pace, 1997), 目前细菌菌群分析中应用最多的是16S rDNA克隆文库方法。它通过对16S rDNA序列进行扩增、分析和鉴定, 达到研究和监测样品与环境中细菌多样性、种群结构和区系变化的目的(Bakeret al, 2001; Brambillaet al, 2001)。由于这一方法不需要得到环境中微生物的纯培养, 突破了用传统的微生物分离纯化的方法调查环境中微生物多样性时很多微生物无法得到纯培养的限制, 因此这一方法目前已经广泛运用于土壤、水体、沉积物、肠道等多种生态系统中微生物多样性的调查(Giovalmonietalet al, 1990; Saleenaet al, 2002; Zhanget al,2007), 并且揭示了环境中前所未知的微生物多样性。本研究利用16S rDNA基因建库法对刺参苗种培育池中生物絮团的细菌群落结构进行分析鉴定, 旨在为评价生物絮团中功能微生物的组成提供依据, 并能进一步揭示生物絮团的作用机制。
1 材料与方法
1.1 试验设计与样品采集
以采用生物絮团技术的刺参养殖实验分别在东营和蓬莱刺参育苗池进行调控。利用枯草芽孢杆菌(Bacillus subtilis)与蔗糖一同加入聚乙烯水槽中, 自然海水中连续发酵4d制备生物絮团, 过滤浓缩后备用。蔗糖与芽孢杆菌添加量分别为0.1 g/L和1.5×105cell/mL, 水温为22—25°C。持续充氧, 每天充分搅拌2次。
幼参苗种培育池为水泥池, 池中水体体积为10 m3,每池幼参苗种密度为1.0 kg/m3水体; 刺参平均体重(1.6±0.8) g/头。处理组每4天倒池、换水1次, 每次换水量为1/2—2/3; 处理组倒池后补充 100×10–6的生物絮团浓缩液, 每 2天向池中加入蔗糖 1次, 蔗糖添加量按C/N20计; 对照组每2天倒池并全量换水1次, 不添加蔗糖和生物絮团浓缩液。在第 30天时取 500 mL海水抽滤收集微生物样, 进行DNA的提取。
1.2 宏基因组DNA的提取
本研究中宏基因组 DNA的提取参照 Zhou等(1996)的SDS-based DNA方法, 并对其进行了适当修改。称取 0.1g样品, 加入 0.6mL清洗液, 振荡混匀,55°C 水浴 5min后, 离心去上清, 重复 2次; 加入0.4mL DNA 抽提缓冲液, 震荡混合后 37°C 水浴30min, 然后加入 80μL 10% SDS, 4μL蛋白酶 K, 55°C水浴2h; 加入1/2体积4.5mol/L的NaCl, 混合均匀后,再加入等体积的氯仿-异戊醇(24︰1), 轻微震荡15min后, 12000r/min离心5min, 取上清; 加入0.6倍体积的异丙醇, 混匀, 室温静置15min后, 12000r/min离心15min, 超纯水溶解沉淀。溶解的DNA经1.0%琼脂糖电泳检测。
1.3 PCR扩增16S rDNA片段
细菌16S rDNA扩增采用通用引物341F: 5’-CCT ACG GGA GGC AGC AG-3’, 907R: 5’-CCG TCA ATT CMT TTR AGT TT-3’。PCR 反应体系(50μL): 10×PCR Buffer (Mg2+Plus) 5μL, dNTP (10mmol/L) 4μL,341F (10nmol/L) 1μL, 907R (10nmol/L) 1μL, DNATaq(5U/μL) 0.5μL, DNA 模板(100 ng/μL) 2μL, 超纯水补至 50μL。PCR 反应程序为: 94°C5min; 94°C45s,55°C45s, 72°C45s, 30cycles; 72°C10min, 4°C 保温。PCR产物用1%的琼脂糖凝胶进行电泳检测。
1.4 16S rDNA文库构建
产物经琼脂糖凝胶回收试剂盒(TaKaRa)纯化,连接至pMD18-T载体(TaKaRa), 连接体系: PCR产物4.5μL, pMD18-T simple vector 0.5μL, SolutionΙ5μL,总体积20μL。将连接混合液轻轻混匀, 于16°C连接5h。连接产物与100μL DH5α感受态细胞, 42°C热激转化,涂布于含有氨苄青霉素平板, 置 37°C培养箱中培养12h。挑取阳性克隆, 以pMD18-T载体引物RV- M和M13-47作为菌落PCR的引物, 用于检测挑取的克隆是否为阳性克隆以及插入片段大小, 插入片段大小合适的克隆送上海生工生物技术有限公司进行测序。
1.5 数据统计分析
采用DNAMAN、Gene Tool等软件对测序结果进行编辑、分析; 利用RDP在线程序Classifier及NCBI数据库的Blastn程序对所得到的16S rDNA序列进行分析; 利用Mothur软件进行OTU分类, 估算每个克隆文库文库覆盖百分率(Coverage)、文库丰富度指数(Chao), 基因多样性指数Shannon (H)、Pielou均匀度指数J(Schlosset al, 2009)。下载RDP数据库相关门属代表序列作为参考序列, 使用Mega5.0软件包, 以邻接法(Neighbor Joining Analysis)构建系统进化树。
2 结果
2.1 基因组提取与16S rDNA目的片段PCR扩增结果
东营和蓬莱刺参育苗池的四个样品宏基因组提取电泳结果显示: 基因组条带清晰无明显降解, OD260/OD280的比值范围为 1.6—1.9, 基本上没有蛋白质和RNA污染, 提取的基因组质量较好, 适于PCR反应。细菌16S rDNA通用扩增引物341F和907R扩增得到550bp左右长度序列, PCR产物经琼脂糖电泳结果如图1所示, 四个絮团样品基因组均扩增出清晰明亮条带, 产物长度符合预期。
图1 样品宏基因组16S rDNA PCR扩增结果电泳图Fig.1 Electrophoretogram of 16S rDNA PCR products of metagenomes
2.2 16S rDNA文库构建结果
对东营和蓬莱处理池的生物絮团及其对照分别构建16S rDNA克隆文库, 分别记作DYt、DYc、PLt、PLc。每个文库随机挑取阳性克隆 120个左右, 测序除去空载及不正确插入, 共获得16S rDNA序列420条, 文库 DYt、DYc、PLc、PLt分别为 93、91、115、121条。测序结果去除载体序列, 通过Mothur软件分析, 把相似性≥97%的序列定义为同一个可操作分类单元(operational taxonomic unit, OTU), 文库 DYt、DYc、PLt、PLc分别含有42、55、62 和79 个OTU(表1)。下载RDP数据库放线菌纲(Actinobacteria) S000000827、拟杆菌纲(Bacteroidetes) S000001704、黄杆菌纲(Flavobacteria) S000115513、鞘脂杆菌纲(Sphingobacteria)S000008354、α-变形菌纲(Alphaproteobacteria) S000001467、δ-变形菌纲(Deltaproteobacteria) S000001126、ε-变形菌纲(Epsilonproteobacteria) S000004853、γ-变形菌纲(Gammaproteobacteria) S000021184、螺旋体纲(Spirochaetes) S000001187、芽孢杆菌纲(Bacilli)S0000 00169、梭菌纲(Clostridia) S000000413和uncultured bacterium S000016962代表序列12条, 与各样品OTU代表序列构建聚类树如图2。四个文库样品 OTU序列形成明显聚群, 其中与拟杆菌门(Bacteroidetes)中三个菌纲序列所形成聚群为主要优势聚群, 变形细菌门(Proteobacteria)次之; 蓬莱地区两样品文库中拟杆菌门 OTU数量明显多于东营地区样品。四个文库Coverage在34.7%—54.8%之间, 文库丰富度指数(Chao)66.2—314.1, Shannon多样性指数从3.01—4.07变动,Pielou均匀度指数0.68—0.85 (表1)。

表1 16S rDNA文库序列数量及多样性参数Tab.1 Number of 16S rDNA library sequence and diversity parameters
2.3 生物絮团样品细菌种类分析
通过NCBI数据库和RDP数据库比对, 对所有有效序列进行分类, 获得的420个序列可以划分为拟杆菌门(Bacteroidetes)、变形细菌门(Proteobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、蓝细菌门(Cyanobacteria)、螺旋体门(Spirochaetes)。此外, 分析结果发现存在一些无法确定其分类位置的序列, 这些序列多与来自环境样品的未培养细菌具有更高相似性, 可见刺参育苗池的生物絮团中存在大量未被认知的微生物类群。各样品文库细菌种类分类及所占数量百分比见表2, 不同类型菌群在DYc、DYt、PLc、PLt四个样品文库中的数量有所不同, 拟杆菌门(Bacteroidetes)、变形细菌门(Proteobacteria)、厚壁菌门(Firmicutes)为三大主要细菌门, 其中拟杆菌门(Bacteroidetes)细菌数量最多, 其数量百分比在每个文库中均超过40%; 变形菌门数量百分比其次。疣微菌门(Verrucomicrobia)和螺旋体门(Spirochaetes)存在于蓬莱生物絮团样品文库, 而蓝细菌门和酸杆菌门则少量存在于东营地区。
统计三大主要细菌门中主要菌纲序列数量占总文库数量及其本门的百分比(图3, 表3)。黄杆菌群(Flavobacteria)为拟杆菌门(Bacteroidetes)中的优势菌群, 占文库总数量的30%以上, 经过生物絮团技术处理后 DYt(47.13%)和 PLt(35.07%)均高于对照组文库DYc(36.68%)和 PLc(31.30%), 且其门内百分比也有所增加; 在东营地区样品文库DYc和DYt中, 黄杆菌群(Flavobacteria)占总文库数量及其本门百分比均高于蓬莱地区样品文库 PLc和 PLt。α-变形菌群(Alphaproteobacteria)为变形菌门的优势菌群, 经过生物絮团处理后 DYt(23.45%)和 PLt(20.42%)均低于对照组文库 DYc(34.50%)和 PLc(26.75%), 其数量占本门百分比亦有所减少; 东营地区样品文库均高于蓬莱地区, 其中东营对照样品DYc文库中α-变形菌群占本门百分比高达93.5%。ε-变形菌纲(Epsilonproteobacteria)仅出现在经过生物絮团技术调控处理后文库, 在DYt和PLt文库中门内百分比分别为12.5%和4.5%。厚壁菌门中主要为芽孢杆菌纲(Bacilli)和梭菌纲(Clostridia)菌群, 作为添加有益菌, 优势菌纲芽孢杆菌(Bacilli)数量比例在生物絮团培养后进一步加大,在蓬莱地区样品中调控效果明显, 总文库数量比由2.94%升至11.21%, 门内数量比相应增加。
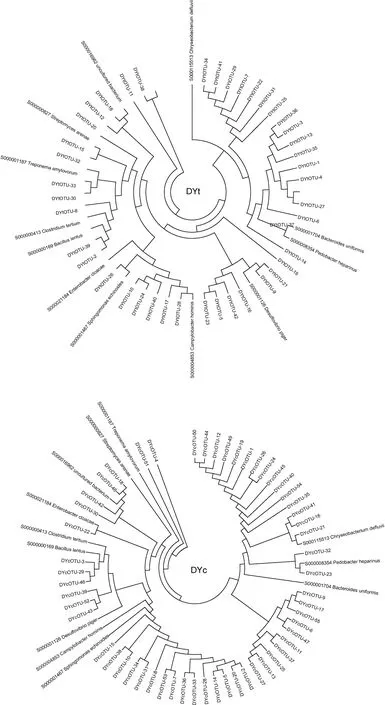
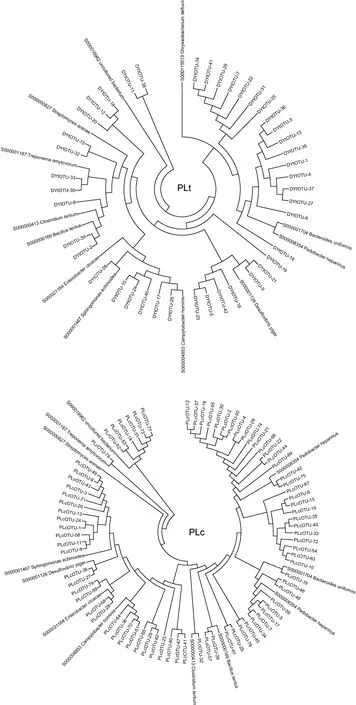
图2 四个样品文库OTU代表序列聚类系统树Fig.2 Dendrograms of OTU sequences in four libraries
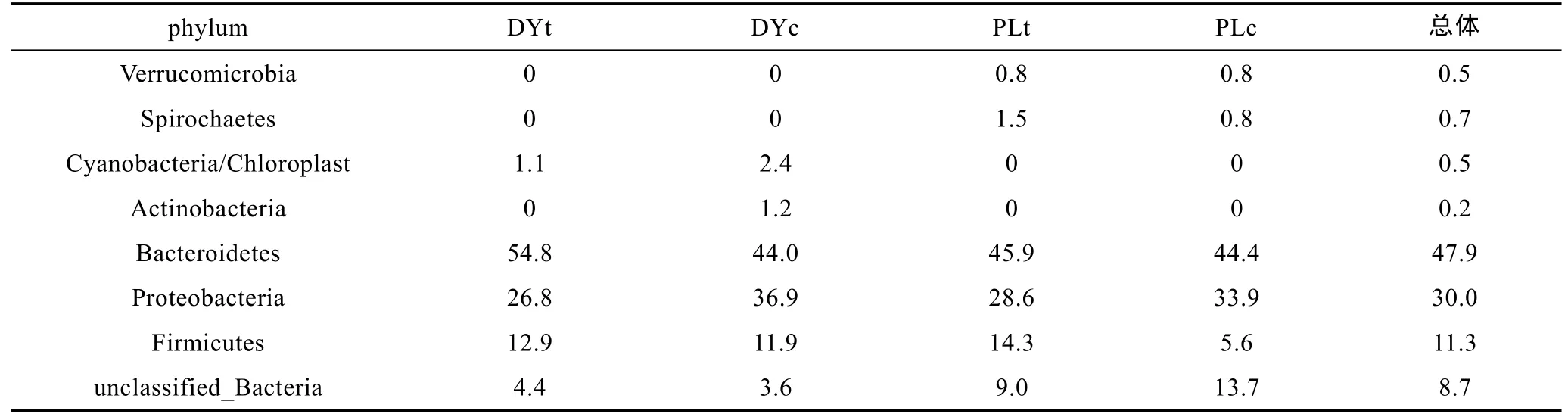
表2 16S rDNA文库中主要细菌门及数量百分比Tab.2 Main bacterial phyla and percentages in 16S rDNA libraries
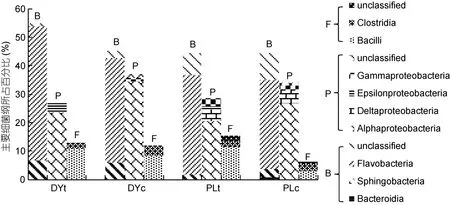
图3 主要细菌纲占总文库数量百分比Fig.3 Percentage of main bacterial classes in the libraries

表3 三大主要细菌门内各菌纲百分比Tab.3 Percentage of main bacterial classes within three major phyla
3 讨论
3.1 生物絮团细菌多样性
本研究东营和蓬莱地区四个样品16S rDNA文库分别含有 42、55、62和79个OTU, 通过Mothur软件分析获得文库 Coverage值在 34.7%—54.8%之间,文库序列样品具有一定的代表性但未穷尽环境中细菌种类, 结合文库稀释度曲线从侧面表现出刺参池塘养殖环境细菌多样性丰富。四个文库样品Shannon多样性指数从 3.01—4.07变动, 特别是 PLc文库4.07达到一个相当高水平; Chao物种丰富度指数和Pielou均匀度指数也表明本研究的 4个样本文库细菌多样性程度较高, 且PLt和PLc文库明显高于DYt和DYc样品文库, 蓬莱地区刺参育苗池中细菌多样性均高于东营地区。东营刺参育苗池塘位于黄河三角洲地区, 与蓬莱近海刺参养殖池塘的温度、盐度等生境环境因子有许多差异之处, 微生物群落功能特征与环境理化性质紧密相关并相互限制影响(Gomezet al, 2006; 米亮等, 2010)。刺参育苗池细菌多样性的变化对刺参养殖微生态调控及健康养殖模式的实施具有重要的指导意义, 微生物群落结构是反映海水养殖生态系统状态的重要指标(Paerlet al,2003; Honget al, 2011), 蓬莱地区细菌多样性均高于东营, 养殖地区环境微生物的差异性提示在水产养殖中应用生物絮团技术需因地制宜, 对培养调控条件进行微调。
3.2 生物絮团细菌群落中优势菌群
黄杆菌纲(Flavobacteria)、α-变形菌纲(Alphaproteobacteria)和芽孢杆菌纲(Bacillus)是刺参苗种培育池中生物絮团的主要优势菌群。黄杆菌纲细菌在东营和蓬莱地区四个样本的克隆文库中都有发现, 且占比最大, 是刺参育苗水体中的绝对优势菌群。黄杆菌纲在刺参海水养殖环境中常被作为优势菌群检出, 推测黄杆菌纲细菌可能为刺参养殖环境和肠道中的有益菌群(闫法军, 2013)。α-变形菌群(Alphaproteobacteria)是第二大优势菌群, 其中α-变形菌亚纲是整个生物絮团形成过程中特优势种类,夏耘等(2012)利用RF-DGGE技术和Zhao等(2012)利用bioflocs技术分析生物絮团细菌群落结构同样获得α-变形菌亚纲细菌是优势菌群的结果。α-变形菌纲细菌的丰度与初级生产力呈 U型相关, 一般在富营养化海水环境中α-变形菌纲数量多意味着研究海域的初级生产力较高(Horner- Devineet al, 2003)。厚壁菌门中芽孢杆菌(Bacillus)为刺参养殖环境另一重要菌群, 芽孢杆菌是一类好氧或兼性厌氧的革兰氏阳性细菌, 在养殖生态系统中可加速有机物的降解和转化, 抑制弧菌的生长, 减少氨氮、亚硝基氮、硫化氢等有毒有害物质, 改善水质, 起到优化养殖环境的作用, 已成为水产养殖中广泛认可的一类有益微生物(林亮等, 2005; 杨莺莺等, 2009)。刺参苗种培育池中生物絮团的功能作用与其微生物群落结构特征及优势菌群种类密切相关。
3.3 生物絮团调控处理对微生物群落结构的影响
生物絮团的积极作用通过水体中细菌群落结构的改变来体现。对比经过生物絮团培育的处理组和对照组16S rDNA文库, 蓬莱和东营地区对照组样品的细菌多样性均高于经特殊生物絮团调控的处理组样品, 说明经过生物絮团调控技术改变了原有养殖环境生物群落结构, 优势细菌群落的生长抑制了一些其它种类, 细菌多样性相对变小, 使微生物群落结构趋向于稳态, 有利于控制细菌性疾病的爆发。利用DGGE技术研究日本囊对虾(Marsupeneus japonicus)养殖过程中利用蔗糖作为碳源培养的生物絮团细菌群落和对照组的差别, 研究者分析认为生物絮团调控技术改变了细菌群落结构, 养殖水体内因Bacillussp.的存在而有效抑制了病原菌(Zhaoet al, 2012)。优势菌群黄杆菌纲(Flavobacteria)和α-变形菌纲(Alphaproteobacteria)细菌经调控处理后其数量百分比分别有所增加和减少, 并且调控后样品文库出现了特有菌群ε-变形菌纲(Epsilonproteobacteria), 这种菌落组分的变化, 推测与碳源成分的添加使异养微生物数量变化有关(Crabet al, 2009)。经添加枯草芽孢杆菌进行生物絮团培养后, DYt和PLt文库芽孢杆菌数量达到较稳定比例, 相关序列均占总文库序列的11%左右, 其中蓬莱地区PLt组较PLc组文库数量变化大, 调控效果明显。
4 结语
生物絮团作为微生物的集合体, 在生态系统的微生物循环和生态调控中起着重要作用, 目前微生物的宏基因组学成为研究微生物群落多样性和动态变化的有效手段, 本研究利用16S rDNA文库技术解析了不同地区生物絮团的主要细菌群落组成, 对生物絮团功能细菌种群组成、水质改善、疾病控制和饲料价值的探讨研究提供科学理论依据。在本研究对生物絮团中细菌群落结构和优势菌群及特异菌群的认知基础上, 可结合目前对环境功能细菌特殊生理活性及细菌的群体行为调控机制研究, 进而实现对生物絮团微生物群落结构和生物絮团功能定向调节,最终建立完善科学的生物絮团技术体系, 广泛推广于水产养殖应用领域, 推动水产养殖发展。
包卫洋, 马甡, 单洪伟等, 2010. 生物絮团在海水养殖中的应用及其前景. 北京: 海洋出版社, 522—524
乔聚海, 程波, 2009. 刺参人工池塘养殖现状及展望. 海洋科学, 29(9): 80—82
闫法军, 2013. 刺参(Apostichopus japonicusSelenka)养殖池塘生态系统微生物结构与功能研究. 青岛: 中国海洋大学博士学位论文, 54—59
米亮, 王光华, 金剑等, 2010. 黑土微生物呼吸及群落功能多样性对温度的响应. 应用生态学报, 21: 1485—1491
杨莺莺, 李卓佳, 梁晓华等, 2009. 芽孢杆菌对鱼池微生物群落代谢功能的影响. 微生物学杂志, 29(5): 11—17
张秀珍, 李斌, 白艳艳等, 2014. 生物絮团对仿刺参幼参生长与酶活性的影响. 中国水产科学, 21(4): 509—517
林亮, 李卓佳, 郭志勋等, 2005. 施用芽孢杆菌对虾池底泥细菌群落的影响. 生态学杂志, 24(1): 26—29
夏耘, 郁二蒙, 谢骏等, 2012. 基于PCR-DGGE技术分析生物絮团的细菌群落结构. 水产学报, 36(10): 1563—1571
Baker G C, Gaiar S, Cowan D Aet al, 2001. Bacterial community analysis of Indonesian hot springs. FEMS Cryobiology Letters, 200: 103—109
Brambilla E, Hippe H, Hagelstein Aet al, 2001. 16S rDNA diversity of cultured and uncultured prokaryotes of a mat sample from Lake Fryxell, McMurdo Dry Valleys.Antarctica Extremophiles, 5: 23—33
Burford M A, Thompson P J, McIntosh R Pet al, 2004. The contribution of flocculated material to shrimp (Litopenaeus vannamei) nutrition in a high-density, zero-exchange system.Aquaculture, 232(1—4): 525—537
Crab R, Kochva M, Verstraete Wet al, 2009. Bio-flocs technology application in over-wintering of tilapia. Aquacultural Engineering, 40(3): 105—112
Gomez E, Ferreras L, Toresani S, 2006. Soil bacterial functional diversity as influenced by organic amendment application.Bioresource Technology, 97: 1484—1489
Hari B, Kurup M, Varghese J Tet al, 2004. Effects of carbohydrate addition on production in extensive shrimp culture systems. Aquaculture, 241(1—4): 179—194
Hong Y G, Li M, Cao Het al, 2011. Residence of habitat-specific anammox bacteria in the deep-sea subsurface sediments of the South China Sea: analyses of marker gene abundance with physical chemical parameters. Microbial Ecology, 62:36—47
Horner-Devine M C, Leibold M A, Smith V Het al, 2003.Bacterial diversity patterns along a gradient of primary productivity. Ecol Lett, 6: 613—622
Kuhn D D, Lawrence A L, Boardman G Det al, 2010. Evaluation of two types of bioflocs derived from biologicaltreatment of fish effluent as feed ingredients for Pacific white shrimp,Litopenaeus vannamei. Aquaculture, 303(1—4): 28—33
Pace N R, 1997. A molecular view of microbial diversity and the biosphere. Science, 276(5313): 734—740
Paerl H W, Dyble J, Moisander P Het al, 2003. Microbial indicators of aquatic ecosystem change: current applications to eutrophication studies. FEMS Microbiology Ecology, 46:233—246
Saleena L M, Rangarajan S, Nair S, 2002. Diversity ofAzospirillumstrains isolated from rice plants grown in saline and nonsaline sites of coastal agricultural ecosystem.Microbial Ecology, 44(3): 271—277
Schloss P D, Westcott S L, Ryabin Tet al, 2009. Introducing mother: open-source, platform-independent, communitysupported software for describing and comparing microbial communities. Appl Environ Microbiol, 75: 7537—7541
Simon M, Grossart H P, Schweitzer Bet al, 2002. Microbial ecology of organic aggregates in aquatic ecosystems. Aquat Microb Ecol, 28: 175—211
Zhang W J, Zeng R Y, 2007. Psychrotrophic amylolytic bacteria from deep sea sediment of Prydz Bay, Antarctic: diversity and characterization of amylases. World Journal of Microbiology and Biotechnology, 23(11): 1551—1557
Zhao P, Huang J, Wang X Het al, 2012. The application of bioflocs technology in high-intensive, zero exchange farming systems ofMarsupenaeus japonicas. Aquculture,354—355: 97—106
Zhou J, Bruns M A, Tiemdje J M, 1996. DNA recovery from soils of diverse composition. Appl Environ Microbiol, 62(2): 316—322

