大叶藻(Zostera marina)的热值和元素含量(碳、氮、磷)及其相关性*
杨贵福 邢 坤① 李 耕 刘海映 潘玉洲 张 力
(1. 大连海洋大学海洋科技与环境学院 大连 116023; 2. 中国水产科学研究院营口增殖实验站 营口 115004)
大叶藻(Zostera marinaL.)是温带性多年生海草的一种, 隶属于大叶藻科(Zosteraceae)、大叶藻属(Zostera), 生长在潮间带和潮下带的浅海区域, 在我国主要分布于辽宁、河北和山东等省的浅海地区(Den Hartog, 1970; 范航清等, 2011)。海草床是海洋自然生态系统中重要的初级生产者, 具有极高的生产力, 在海洋生态系统中具有重要的意义。国外学者对大叶藻海草床的研究较早, 集中在植物生理(Duarte, 1990)、生态调查(Shortet al, 2007)、繁殖保育技术(Marionet al, 2010)、分子生物学(Reuschet al, 2000; Lucaset al,2012)等方面。国内关于大叶藻等海草床的研究起步较晚, 20世纪 80年代初, 杨宗岱(1982)、杨宗岱等(1981, 1983)首先发表了有关中国海草植物的生理、系统分类和生态功能研究的文章, 近年来, 关于华南沿海海草床的研究较多(范航清等, 2007; 韩秋影等,2007), 对我国北方零星分布的大叶藻和矮大叶藻等海草床的生态学特征也有一些研究(于函等, 2007; 刘炳舰等, 2013; 张晓梅等, 2013)。
能量是生态系统功能研究中的基本概念之一,热值反映出植物组织中各种生理活动的变化和生长代谢水平状况的差异, 也可以反映出对生长环境的适应性。热值作为评价植物营养成分的指标之一, 与植物体中的碳、氮、磷元素含量有着密切的关系(徐永荣等, 2003; 官丽莉等, 2005)。20世纪30年代, 国外就开始了对植物热值的研究(Long, 1934), 而我国对于这方面的研究滞后许多, 直到20世纪80年代初才出现对青海高寒草甸地区常见植物热值的研究(杨福囤等, 1983), 此后有学者研究了不同群落、不同生活型植物的能量学特征(由文辉等, 1995; 任海等,1999; 曾小平等, 2009)。然而, 对我国潮间带海草床的能量学研究较少, 除了石雅君等(2011)分析了广西近海矮大叶藻(Zostera japonica)根状茎和不同发育阶段叶片的热值动态以外, 对其它海区海草的热值分析还未见报道。而对热值和植物碳、氮、磷元素含量相关性的研究, 仅见于孙国夫等(1993)对水稻叶片热值与碳素相关性和徐永荣等(2003)对天津滨海盐渍土上的几种植物热值与元素含量相关性的分析, 国内对大叶藻海草床热值和碳、氮、磷元素含量的动态分析则尚未报道。本研究以辽宁省獐子岛近海的大叶藻海草床为研究对象, 分析测定了大叶藻须根、根状茎、不同生长阶段叶片的热值和碳、氮、磷元素含量及其相关性, 旨在为海草系统中的能流分析及我国海草的生态系统研究提供基础数据。
1 材料与方法
1.1 样品采集
于2012年12月最低潮时在辽宁大连市的獐子岛浅海区域(39°2′3.21"N, 122°43′44.10"E)大叶藻海草床区(200m×400m)进行取样, 随机选取 3个样方(10m×10m), 然后在每个样方中随机挖取整株海草,挖掘面积小于海草床总面积的 10%, 以利于海草资源恢复。样品用海水冲洗干净, 去除表面上的杂质和附着生物, 放入贴好标签的样品袋中, 在低温环境下带回实验室进行测定分析。
1.2 样品处理
先把大叶藻根据不同器官组织分为须根、根状茎和叶。根据大叶藻的叶簇的形态特征、叶片的相对长度、内外关系、颜色和叶尖形态把大叶藻叶片分为初生叶、幼叶、成熟叶1、成熟叶2和衰老叶(范航清等,2011)。初生叶是叶簇最里面的第1片叶子, 相对长度最短, 颜色为淡绿色。幼叶是叶簇里面的第2片叶子。成熟叶1是叶簇里面的第3片叶子, 幼叶和成熟叶1相对长度中等(长度: 幼叶<成熟叶1), 成熟叶1比幼叶颜色更深。成熟叶2是在叶簇中相对外面的第4片叶子, 成熟叶2在所有叶片中长度最长。衰老叶是在叶簇中最外面的第 5片叶子, 相对长度中等(一般小于成熟叶1和成熟叶2, 大于初生叶和幼叶), 颜色为暗绿色或者黑褐色, 叶尖大部分已经残缺。初生叶是夹在幼叶和成熟叶1之间, 幼叶是夹在初生叶和成熟叶2之间, 成熟叶1是夹在初生叶和衰老叶之间, 成熟叶 2是在幼叶的外层, 衰老叶是在成熟叶 1的外层。根据生长过程, 叶片的生长顺序为初生叶→幼叶→成熟叶1→成熟叶2→衰老叶。
用淡水洗净后将样品不同部位分样处理, 测量叶片长度, 然后60°C烘干, 采用IKA T11研磨机处理后, 过80目筛储存备用。
1.3 测定方法
灰分含量测定方法: 干灰化法, 把不同部位大叶藻须根、根状茎和叶片在马福炉550°C下灰化5h后测定灰分含量。每份样品重复3次。
热值测定: 采用Parr 6400型微电脑氧弹式热量计测定其热值含量。样品热值以干质量热值(每克干物质在完全燃烧条件下所释放的总热量, Gross caloric value, 简称GCV)和去灰分热值(Ash-free caloric value,简称AFCV)来表示。每份样品重复3次, 重复间误差控制在±200Jg–1, 每次实验前用苯甲酸标定热量计的能当量。
营养元素测定方法: 取另一部分处理后的备用样品, 过80目的样品筛后测量其C、N、P元素的含量。其中 C、N元素含量的测定利用 VARIO EL III元素分析仪进行测量; P元素含量采用磷钼蓝比色法进行测定, 其植物体的消解氧化方法为灰化法(Zhouet al, 2003)。
1.4 数据分析与处理
去灰分热值(AFCV)=干重热值/(1-灰分含量)
所得数据试验所得数据采用SPSS19.0统计软件和Excel软件进行统计分析。其中大叶藻不同生长阶段叶片的叶长数据进行单因素方差分析(One-way ANOVA)、Tamhane’s T2多重比较检验。不同部位大叶藻的灰分含量、干质量热值和去灰分热值数据进行单因素方差分析(One-way ANOVA)、S-N-K多重比较检验。
2 结果和分析
2.1 大叶藻不同生长阶段叶片的叶长特征
大叶藻不同生长阶段叶片的叶长特征如图1所示, 叶片长度随着生长不断变化, 叶片从初生叶到成熟叶2叶片长度不断增大, 之后从成熟叶2到衰老叶叶片长度则降低。初生叶的叶片长度为(11.16±6.62)cm, 极显著小于其它生长阶段叶片的长度(P<0.01)。成熟叶2的叶片长度为(30.30±11.14)cm, 在不同生长阶段叶片中叶片长度最高, 与初生叶、幼叶差异极显著(P<0.01), 与衰老叶差异显著(P<0.05), 与成熟叶1无显著性差异(P>0.05)。幼叶、成熟叶1和衰老叶之间无显著性差异(P>0.05)。
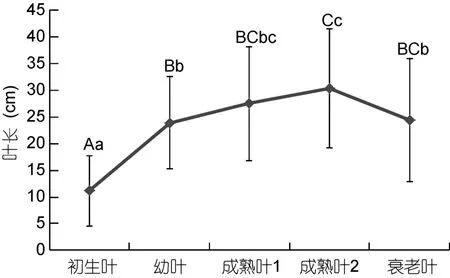
图1 2012年12月獐子岛大叶藻不同生长阶段叶片的叶长Fig.1 The leaves length of Z. marina in different growth stages in Zhangzi Island December 2012
2.2 大叶藻须根、根状茎和不同生长阶段叶片热值的动态变化
大叶藻须根、根状茎和不同生长阶段叶片的灰分含量、干质量热值和去灰分热值如表1所列。图2为大叶藻须根、根状茎和不同生长阶段叶片的灰分含量,根据单因素方差分析和多重比较检验, 不同生长阶段叶片灰分含量逐渐升高, 差异极显著(P<0.01), 结果为: 初生叶(18.46%±0.12%)<幼叶(20.38%±0.10%)<成熟叶 1(23.23%±0.03%)<成熟叶 2(26.53%±0.05%)<衰老叶(29.33%±0.09%)。从表1和图2可知, 不同部位的灰分含量均存在极显著差异(P<0.01), 须根(45.51%±1.02%)的灰分含量最高, 而根状茎(35.13%±1.02%)的灰分含量处于须根和叶片(23.58%±4.10%)之间。
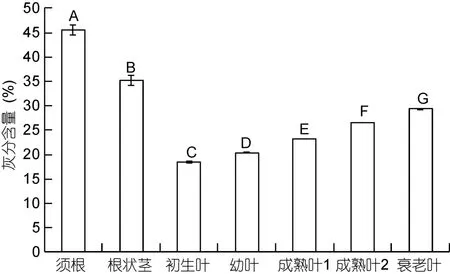
图2 大叶藻须根、根状茎和不同生长阶段叶片的灰分含量Fig.2 Ash contents of the root, rhizome, and leaves of Z.marina in different growth stages
从表1可知, 大叶藻须根、根状茎和不同生长阶段叶片的干质量热值和去灰分热值。根据单因素方差分析和多重比较检验, 不同生长阶段叶片干质量热值逐渐降低, 差异极显著(P<0.01), 结果为: 初生叶[(14.89±0.040)kJ/g]>幼叶[(14.26±0.006)kJ/g]>成熟叶1[(14.03±0.098)kJ/g]>成熟叶 2[(13.10±0.089)kJ/g]>衰老叶[(12.20±0.109)kJ/g]。从表1可知, 大叶藻不同部位的干质量热值均存在极显著差异(P<0.01), 须根[(8.15±0.079)kJ/g]的干质量热值在各组分中最小, 而根状茎[(10.57±0.003)kJ/g]的干质量热值则处于须根和叶[(13.70±0.981)kJ/g]之间。
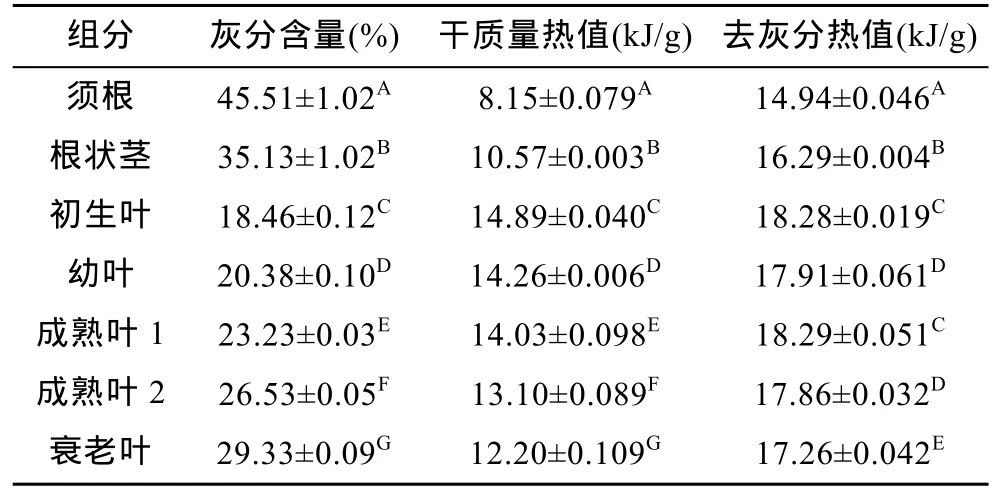
表1 大叶藻须根、根状茎和不同生长阶段叶片的热值Tab.1 The calories of root, rhizome and leaves of Z. marina in different growth stages
从表1可知, 须根[(14.94±0.046)kJ/g]的去灰分热值在各组分中最小, 极显著小于其它部位[(P<0.01)。而根状茎[(16.29±0.004)kJ/g]的去灰分热值则处于须根和叶[(17.92±0.420)kJ/g]之间。不同生长阶段叶片的去灰分热值差别不大, 成熟叶 1[(18.29±0.051)kJ/g]最大, 衰老叶[(17.26±0.042)kJ/g]最小。
2.3 大叶藻须根、根状茎和不同生长阶段叶片的碳、氮、磷元素含量变化
大叶藻须根、根状茎和不同生长阶段叶片的碳、氮、磷元素含量及其比值如表2所列。从表2可知, 大叶藻碳、氮、磷含量变化趋势为叶>根状茎>须根; C/N比值和C/P比值的变化趋势为须根>根状茎>叶; 大叶藻N/P比值变化趋势为根状茎>叶>须根。随着大叶藻叶片的生长, 碳、氮、磷含量逐渐降低(初生叶>幼叶>成熟叶 1>成熟叶 2>衰老叶), 而大叶藻不同叶片的C/N比值和 C/P比值则随着生长过程逐渐升高(初生叶<幼叶<成熟叶 1<成熟叶 2<衰老叶)。在叶片中的N/P比值则是随着叶片生长先升高后降低(初生叶<幼叶<成熟叶1>成熟叶2>衰老叶)。
2.4 大叶藻热值与碳、氮、磷元素含量的关系
大叶藻不同部位的热值与碳、氮、磷元素含量的相关性如表3所列。从表3可知, 大叶藻的灰分含量与干质量热值、去灰分热值、碳含量、氮含量和磷含量呈极显著的负相关性(P<0.01), 与 C/N比值和 C/P比值呈极显著的正相关性(P<0.01)。除了去灰分热值与磷含量呈显著的正相关性(P<0.05)之外, 大叶藻的干质量热值和去灰分热值与营养元素含量之间均呈极显著的正相关性(P<0.01)。除了磷含量与C/N比值呈显著的负相关性(P<0.05)外, 干质量热值、去灰分热值、碳含量、氮含量和磷含量与 C/N比值和 C/P比值都呈极显著的负相关性(P<0.01)。大叶藻的 C/N比值和C/P比值呈极显著的正相关性(P<0.01)。大叶藻的N/P比值与其它参数的关系比较复杂, 并没有出现显著的相关性(P>0.05), 其中灰分含量、C/N 比值和 C/P比值呈负相关性, 但不显著(P>0.05); 而 N/P比值与干质量热值、去灰分热值和碳、氮、磷含量之间差异不显著(P>0.05)。
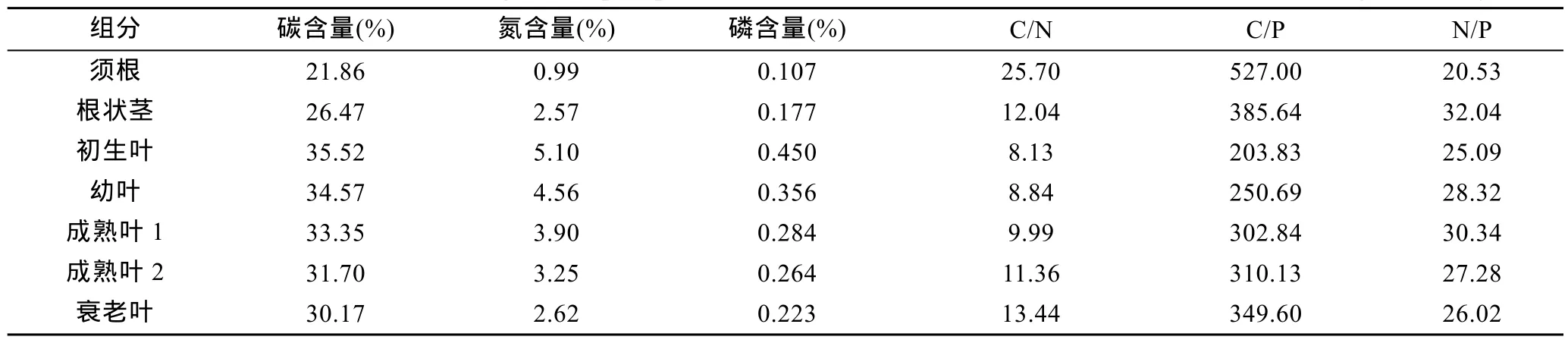
表2 大叶藻须根、根状茎和不同生长阶段叶片的元素含量(碳、氮、磷)Tab.2 Element contents (carbon, nitrogen, and phosphorus) of root, rhizome, and leaves of Z. marina in different growth stages
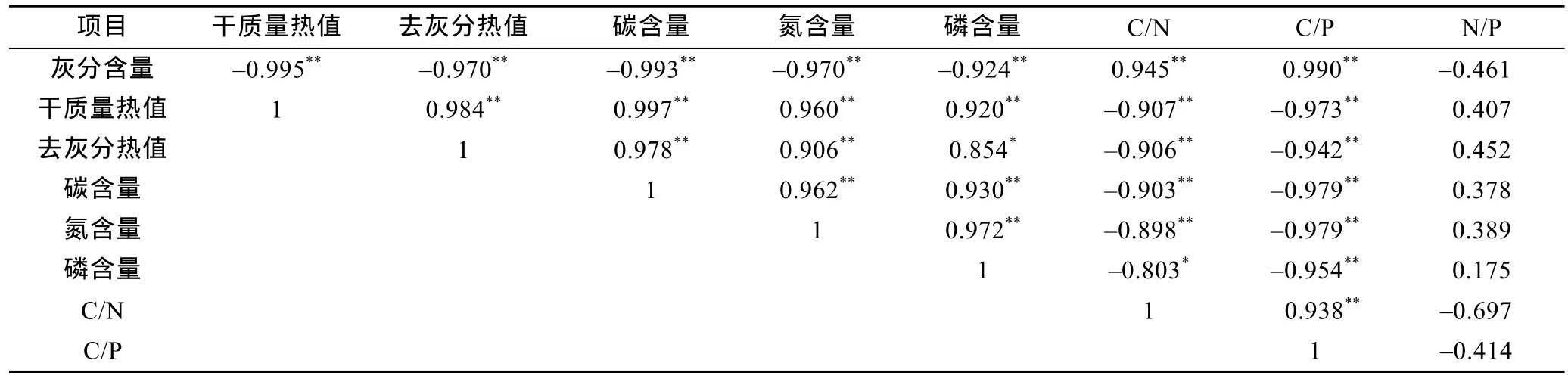
表3 大叶藻热值与元素含量(碳、氮、磷)的Pearson相关关系Tab.3 Pearson correlation between caloric values and element contents (carbon, nitrogen, and phosphorus) of Z. marina
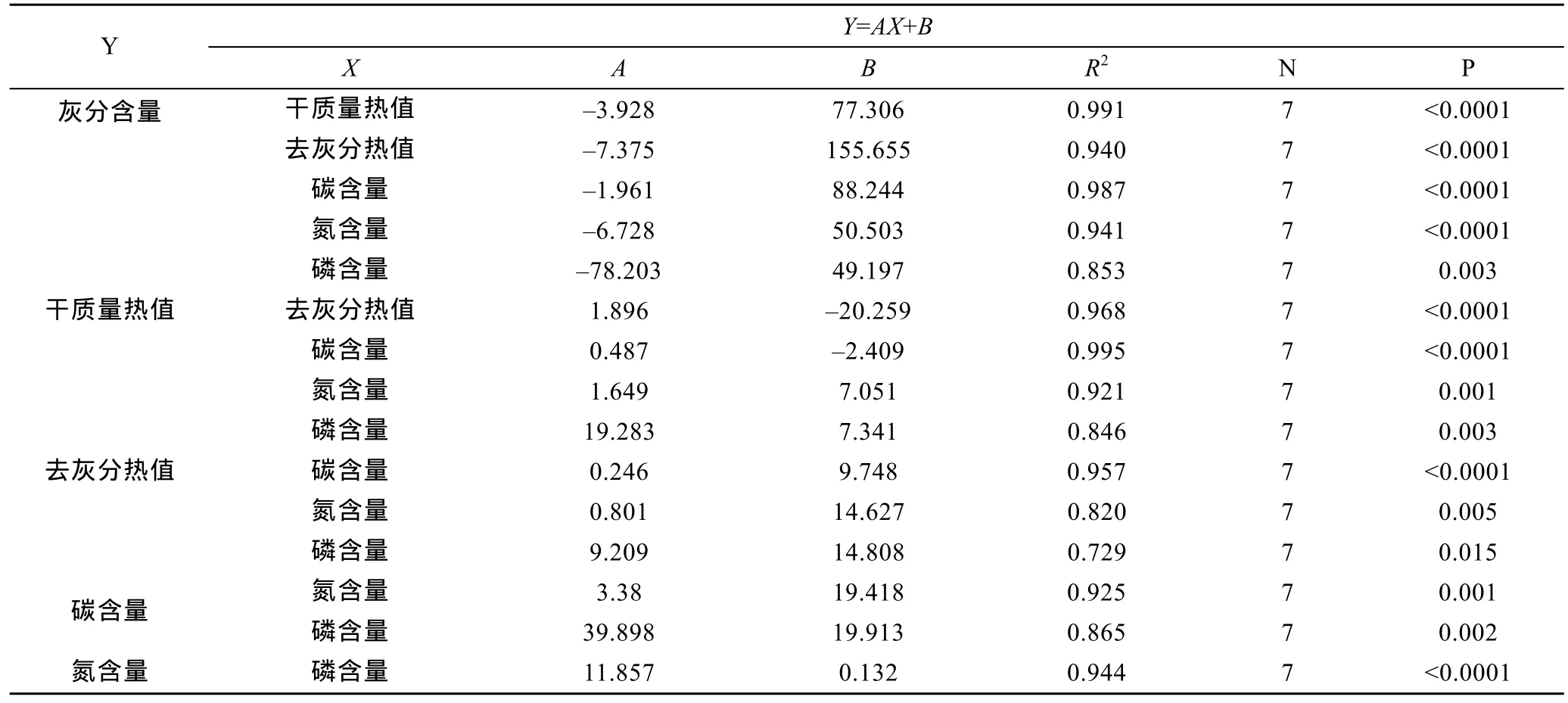
表4 大叶藻热值与元素含量(碳、氮、磷)之间的线性关系Tab.4 Relationships between caloric values and element contents (carbon, nitrogen, and phosphorus) of Z. marina
大叶藻热值与碳、氮、磷元素含量之间的线性关系如表4所列。从表4可知, 大叶藻热值之间和碳、氮、磷含量之间都呈显著的线性关系(P<0.05)。
3 讨论
3.1 大叶藻不同生长阶段叶片的生态特征
植物叶片具有一定的生命周期, 有研究者发现海草的叶片生命周期平均是88.4d, 但不同海草种类差异较大, 从生命周期为345d的聚伞藻科的Posidonia oceanica到只有几天的喜盐草(Halophila ovalis), 而大叶藻科叶片平均生命周期约为80—90d (Hemmingaet al, 1999)。由于不同地区生长环境的差异, 大叶藻植株的叶片数并不同, Lee等(2004)调查了美国Great Bay Estuary、Narragansett Bay和Waquoit Bay三个地区的大叶藻植株平均叶片数, 分别为4.2、3.0和4.1, 而且同一地点内每植株叶片数也显著不同。在植物的生长过程中, 由于不同时期叶片的形态和代谢水平的差异, 其体内的生物化学特征也存在一定的差异。Wang等(1999)和林益明等(2004)根据红树林植物叶片的生命周期把叶片分为生长期、成熟期和衰老期。谭忠奇等(2003)也把五种榕属植物的叶片分为幼叶、成熟叶和衰老叶。石雅君等(2011)根据叶簇的形态特征、叶片的相对长度、颜色和叶尖形态把矮大叶藻分为幼叶、成熟叶和衰老叶三类。为了更加细致得体现出不同生长阶段叶片营养元素含量的变化规律和生理代谢状况, 本文根据不同生长阶段大叶藻叶片数和形态特征细分为五种类型。初生叶的叶片生长时间和长度最短, 与其它叶片差异极显著(P<0.01), 叶片还处于生长时期。而成熟叶1和成熟叶2的叶片处于成熟期,其长度最长。而进入衰老期的叶片由于腐烂凋谢等原因其长度变短。
3.2 大叶藻的热值动态
大叶藻是构件生物, 不同部位和生长阶段的大叶藻灰分含量、干质量热值和去灰分热值具有一定的差异。
灰分含量可以指示植物富集营养元素的作用。在海草中, 大叶藻属于灰分含量较高的种类, 赵辉等(2010)检测了青岛汇泉湾大叶藻的灰分含量, 发现其总体灰分含量为35.95%。 Brix等(1983)研究了丹麦大叶藻的元素含量和灰分含量状况, 发现大叶藻地上部分和地下部分的灰分含量分别是 18.2%和20.0%。而矮大叶藻的灰分含量范围在 10%—15%之间(石雅君等, 2011), 本研究测得大叶藻不同部位的灰分含量范围在18%—45%之间。相对于矮大叶藻、角果木(Ceriops tagal)、海莲(Bruguiera sexangula)(林益明等, 2000)和水稻(孙国夫等, 1993)等植物, 大叶藻的灰分含量较高且变化范围较大。本研究发现大叶藻不同部位的灰分含量差别较大, 且差异极显著(P<0.01), 其中叶片灰分含量比须根和根状茎小。Siegal-Willott等(2010)也发现海草根状茎比叶片有更低的木质素(lignin)和更高的灰分含量, 其原因在于根状茎主要用于储存矿质元素。在不同的季节中, 由于海草的新陈代谢水平不同, 海草的灰分含量也会发生变化。大叶藻的灰分浓度从冬季(400mg/gDW)到春夏季节(200mg/gDW)会不断下降, 在灰分浓度上可以观测到10%的下降(Cabello-Pasiniet al, 2004)。所以本实验中大叶藻的灰分含量较高与采样季节有关。
由于植物不同部位的生物化学成分和功能结构存在差异, 其热值含量不同。叶片是光合作用的场所,新陈代谢水平较高, 其含有的蛋白质和脂类等高能物质比根和茎更多; 而茎属于支持器官, 含有的纤维素较高, 而纤维素的能值相对较低; 根的代谢水平较低, 其主要功能是吸收矿质元素和水分, 所以其热值最低(任海等, 1999)。本研究中大叶藻不同部位的干质量热值: 叶片>根状茎>须根。淀山湖水生植物中茎叶的热值也大于根部(由文辉等, 1995)。而Pradheeba等(2011)研究了多种海草叶和根状茎的热值, 发现海菖蒲(Enhalus acoroides)、贝壳喜盐草(Halophila beccarii)、喜盐草(Halophila ovalis)和海神草(Cymodocea rotundata)等海草叶片热值比根状茎更低; 齿叶海神草(Cymodocea serrulata)和Halodule uninervis这两种海草叶片热值比根状茎大; 而羽叶二药藻(Halodule pinifolia)和针叶藻(Syringodium isoetifolium)这两种海草叶和根状茎的热值则相差不大, 热值状况因海草的种类和生存环境而异。不过其热值数据是由组成生物体的有机物质如蛋白质等热值换算得来的, 其数据与本实验具有一定的差异。
一般认为, 叶片衰老过程中的呼吸消耗及营养元素的外运致使叶片的质量和碳、氮、磷等元素的浓度随之下降, 衰老叶的灰分含量高于幼叶和成熟叶。幼叶由于处于生长初期, 生理活动旺盛, 积累的有机物质最多, 其中含有的高能物质比例也较高; 而衰老叶则处于生命周期的末期, 其中能转移的营养物质都转移到了其它部位, 矿物质等不可转移的元素含量最多; 而成熟叶则处于两者之间。本研究中, 随着大叶藻叶片的生长, 灰分含量不断增大, 干质量热值则不断降低。在矮大叶藻中也发现了这种趋势(石雅君等, 2011)。
去灰分热值不受植物灰分含量的影响, 林鹏等(1991)因此认为植物热值以去灰分热值为根据相对比较稳定, 避免了灰分含量变化而产生的热值波动, 对于衡量植物的热值具有一定的意义。本研究发现不同部位大叶藻去灰分热值不同, 叶片>根状茎>须根。而大叶藻不同叶片的去灰分热值并无明显规律, 成熟叶片的去灰分热值最大, 而衰老叶最小。
3.3 大叶藻的营养动态
植物生物体的碳、氮、磷含量对于植物的生存和繁殖具有重要作用。海草叶片和叶鞘的N、P含量比根状茎和须根更高, 无论是慢生长种类还是快生长种类(Yamamuroet al, 2005)。叶片中氮元素含量和环境中的水体营养盐浓度具有一定的关系。Lee等(2004)研究发现河流上河口中大叶藻叶片氮含量显著高于下河口, 大叶藻叶片氮含量与叶片每平方厘米干质量也具有强的负相关性, 所以研究者建议用叶片氮含量与叶片每平方厘米干质量的比值作为环境早期超营养化的指示器。Wang等(1999)研究了红树林植物Bruguiera gymnorrhiza叶片生命周期中的营养转移状况, 发现叶片在衰老期间, 60%的氮和48%的磷从老叶中被转移到其它器官。在衰老的过程中, 有些营养元素在大叶藻体内能进行回收, 衰老组织中的营养元素能转移到生长活跃的组织里, 然后对其再利用。从衰老叶中进行营养再吸收是植物的一种生存策略。有研究发现大叶藻从衰老组织中回收的氮占植物氮总吸收量的12%, 而其它88%则是通过外界吸收得来(Pedersenet al, 1992)。Hemminga等(1999)也从海草叶片营养再吸收的实验中发现氮的平均再吸收率为20.4%, 磷为21.9%。而实际上再吸收率可能更低, 因为有些叶片会由于早熟而凋落, 加上食草动物的摄食和水流压力也使得海草失去叶片而无法进行营养的再吸收。本研究中, 叶片碳、氮、磷含量均比须根和根状茎高, 而且随着叶片的生长, 叶片的碳、氮、磷含量也随之降低。一般认为植物叶片生长速度比根状茎快, 根状茎的生长速度比须根快, 而在叶片中,幼叶生长速度最快, 成熟叶次之, 衰老叶最慢, 从该趋势可知, 生长迅速的器官所需要的营养物质较多,其碳、氮、磷含量较高。刘炳舰等(2013)调查分析了山东荣成沿海大叶藻的碳、氮、磷含量, 其总体趋势为叶>叶鞘>根茎, 结果与本研究相似。
植物C/N和C/P反映了植物中生物化学组成含量、生长状况和植物对有机物、氮、磷的利用效率, N/P还能反映出植物生长受N或P的限制情况(Koerselmanet al, 1996)。本研究中, C/N和C/P在根茎叶中的变化趋势和碳、氮、磷元素含量相反, 随着生长速度的增加, 其数值会变小。而N/P在各个器官中相差不大, 其平均值为27.08。根据Koerselman等(1996)关于植物N/P的研究, 由于本研究中大叶藻的N/P>16, 所以磷元素是大叶藻生长的限制因子。这与刘炳舰等(2013)的研究结果有差异。张晓梅等(2013)调查了山东荣成天鹅湖的矮大叶藻的C/N比值, 发现矮大叶藻叶片的C/N为13.24, 高于本研究中的10.35。其原因可能是由于地理环境和生物种类不同而发生一定的差异。
3.4 植物的灰分含量、热值与碳、氮、磷元素的相互关系
植物的灰分含量和热值之间有着密切的关系。从本研究的结果发现, 大叶藻的灰分含量与干质量热值和去灰分热值呈极显著的负相关(P<0.01), 干质量热值和去灰分热值呈极显著的正相关(P<0.01)。灰分含量的高低可反映不同植物组织中富含矿质营养元素含量的不同, 而植物的热值是植物样品中有机物含量的反映。矿物质营养元素的能量比较低, 所以灰分含量高, 其热值一般则较低。研究发现, 灰分含量每升高 1%, 其热值约降低 200J/g (Cassidaet al,2005)。国内曾小平等(2009)研究了 20种植物个体的热值和灰分含量的相关性, 发现灰分含量与干质量热值呈显著负相关(P<0.05), 干质量热值与去灰分热值呈显著正相关(P<0.01), 这与本研究的结果相符。在一些其它的研究中, 银新杨(Populus alba×Populus bolleana)的树干热值与灰分含量之间相关性不显著(P>0.05), 而树皮的热值与灰分之间存在极显著的负相关性(P<0.01)(郑朝晖等, 2011b), 其不同器官具有一定的差异性。
植物碳、氮、磷含量之间有着密切的关系。从表3可以看出, 大叶藻中碳、氮、磷含量之间具有极显著正相关性(P<0.01)。而在徐永荣等(2003)关于天津滨海盐渍土的几种植物热值和元素含量的研究中,发现植物中碳含量和氮磷含量呈微弱的负相关性(P>0.05), 氮含量和磷含量存在极显著的正相关性(P<0.01), 而菊芋块茎的碳氮含量呈显著的负相关性(P<0.05)(高凯等, 2011)。这两个结果与本研究都有差别, 说明在不同植物之间存在一定的差异。在红树林植物的研究中, Wang等(1999)发现氮与磷含量具有显著的线性关系(y=0.074x+0.029,R2=0.867,n=10,P<0.01), 与本研究中大叶藻氮与磷含量间极显著的相关性类似(y=11.857x+0.132,R2=0.944,n=7,P<0.0001)。
植物的热值与碳、氮、磷含量之间有着密切的关系。碳含量基本由有机碳化合物含量决定, 碳含量越高, 植物有机物含量越高, 植物的热值就越高。本研究中大叶藻热值和碳含量存在极显著的正相关性(P<0.01), 结果与之相符。而在俄罗斯杨(Populus russkii)碳含量与热值的研究中, 俄罗斯杨树干的热值与含碳率之间相关性不显著(P>0.05), 树皮的热值与含碳率之间却存在极显著的正相关性(P<0.01), 相关系数为 0.677(郑朝晖等, 2011a), 而银新杨的热值与含碳率之间存在显著的负相关性(郑朝晖等, 2011b),这说明植物的热值因种和生存环境而异。
植物的热值与氮含量也有相关性。在本研究中,干质量热值和去灰分热值与氮含量都具有极显著的正相关性(P<0.01)。因为许多高能物质如蛋白质都含有氮元素, 所以氮含量越高, 其热值则越高。而在水稻氮含量与热值的关系研究中, 发现总体上二者并无相关性, 但在孕穗期后叶片氮含量与热值却存在极显著的正相关性(P<0.01), 故认为在生长前期, 叶片氮素多为无机氮, 物质和能量的积累还处于迅速上升阶段, 故氮素虽高热值却低, 孕穗期叶片物质积累达到高峰, 而后不断向穗部输出物能, 叶片氮含量与热值的下降是物能输出同一结果的两个方面, 故热值与氮含量存在极显著的正相关性(P<0.01)(孙国夫等, 1993)。
植物的热值与磷含量也有相关性。徐永荣等(2003)发现植物的干质量热值与磷含量几乎不相关(R2=0.000001)。但本研究发现, 磷含量与干质量热值存在极显著正相关(R2=0.846), 与去灰分热值存在显著正相关(R2=0.729), 说明不同植物种类之间具有一定的差异性。
3.5 海草的热值与食用价值
海草具有较高的生态价值。海草作为海岸生态系统的初级生产者, 不仅给许多鱼类和海洋哺乳动物提供栖息环境和产卵场, 海草叶片和根状茎具有很高的热量, 还能作为海牛、绿海龟等食草动物的食物。本研究发现, 大叶藻叶片具有较高的干质量热值,而且其灰分含量也较低。在五种类型的叶片中, 初生叶的干质量热值[(14.89±0.040)kJ/g]最高, 且灰分含量(18.46%±0.12%)最低, 作为食草动物的食物比较适合, 而成熟叶 1的去灰分热值最高[(18.29±0.051)kJ/g],且生物量比初生叶高, 若考虑所能获取的生物量, 成熟叶1将是食草动物较理想的食物。但是海洋动物摄食海草并不一定完全因为海草的营养价值, 在泰国海岸生活的儒艮(Dugong dugon)摄食生长较快的喜盐草(Halophila ovalis)并不是因为营养价值, 而是因为其高生长率所带来的巨大的供给量(Yamamuroet al,2005)。在把海草作为人类食物的研究中, Pradheeba等(2011)研究了多种海草的生物化学组成和热量值,发现一些海草的热量值相当于孟加拉鹰嘴豆、马铃薯和甜马铃薯等植物, 如海菖蒲(Enhalus acoroides)和海神草(Cymodocea rotundata), 但海草中含有苯酚(phenol)和丹宁(tannin), 研究者认为只要人为去除海草中苯酚和丹宁, 就能把海草作为食草动物或者人类的正常食物。在大叶藻的食用价值研究上, 需要进一步深入了解大叶藻的生物化学组成和能量学特征。
于函, 马有会, 张岩等, 2007. 大叶藻的生态学特征及其与环境的关系. 海洋湖沼通报, (S0): 112—120
石雅君, 范航清, 潘良浩等, 2011. 日本大叶藻(Zostera japonica)根状茎和不同发育阶段叶片的热值动态. 海洋科学, 35(11): 48—51
由文辉, 宋永昌, 1995. 淀山湖水生维管束植物群落能量的研究. 植物生态学报, 19(3): 208—216
任海, 彭少麟, 刘鸿先等, 1999. 鼎湖山植物群落及其主要植物的热值研究. 植物生态学报, 23: 148—154
刘炳舰, 周毅, 刘旭佳等, 2013. 桑沟湾楮岛近岸海域大叶藻生态学特征的基础研究. 海洋科学, 37(1): 42—48
孙国夫, 郑志明, 王兆骞, 1993. 水稻热值的动态变化研究.生态学杂志, 12(1): 1—4
杨宗岱, 1982. 中国海草的生态学研究. 海洋科学, (2): 34—37
杨宗岱, 李淑霞, 1983. 海草系统分类的探讨. 山东海洋学院学报, 13(4): 78—87
杨宗岱, 吴宝铃, 1981. 中国海草场的分布、生产力及其结构与功能的初步探讨. 生态学报, 1(1): 84—89
杨福囤, 何海菊, 1983. 高寒草甸地区常见植物热值的初步研究. 植物生态学与地植物学丛刊, 7: 280—287
张晓梅, 周毅, 王峰等, 2013. 山东荣成天鹅湖矮大叶藻种群的生态特征. 应用生态学报, 24(7): 2033—2039
范航清, 邱广龙, 石雅君等, 2011. 中国亚热带海草生理生态学研究. 北京: 科学出版社, 2—177
范航清, 彭胜, 石雅君等, 2007. 广西北部湾沿海海草资源与研究状况. 广西科学, 14(3): 289—295
林鹏, 林光辉, 1991. 几种红树植物的热值和灰分含量研究.植物生态学与地植物学学报, 15(2): 114—120
林益明, 向平, 林鹏, 2004. 深圳福田几种红树植物繁殖体与不同发育阶段叶片热值研究. 海洋科学, 28(2): 43—48
林益明, 林鹏, 王通, 2000. 几种红树植物木材热值和灰分含量的研究. 应用生态学报, 11(2): 181—184
郑朝晖, 马春霞, 马江林等, 2011a. 俄罗斯杨热值与含碳率特征分析. 河南农业科学, 40(6): 128—131
郑朝晖, 马江林, 孙守文等, 2011b. 新疆8年生银新杨热值与含碳率特征分析研究. 福建林业科技, 38(4): 21—25
官丽莉, 周小勇, 罗艳, 2005. 我国植物热值研究综述. 生态学杂志, 24(4): 452—457
赵辉, 闫华晓, 张萌萌等, 2010. 海洋生物质的热解特性与动力学研究. 生物技术通报, (4): 135—140
徐永荣, 张万均, 冯宗炜等, 2003. 天津滨海盐渍土上几种植物的热值和元素含量及其相关性. 生态学报, 23(3): 450—455
高凯, 朱铁霞, 徐苏铁等, 2011. 不同生境条件对菊芋块茎的热值、C、N和灰分含量的影响. 作物杂志, (2): 17—19
韩秋影, 黄小平, 施平等, 2007. 广西合浦海草床生态系统服务功能价值评估. 海洋通报, 26(3): 33—39
曾小平, 蔡锡安, 赵平等, 2009. 广东鹤山人工林群落主要优势植物的热值和灰分含量. 应用生态学报, 20(3): 485—492
谭忠奇, 林益明, 向平等, 2003. 5种榕属植物不同发育阶段叶片的热值与灰分含量动态. 浙江林学院学报, 20(3):40—43
Brix H, Lyngby J E, Schierup H H, 1983. Eelgrass (Zostera marinaL.) as an indicator organism of trace metals in the Limfjord, Denmark. Marine Environmental Research, 8:165—181
Cabello-Pasini A, Muñoz-Salazar R, Ward D H, 2004.Biochemical characterization of the eelgrassZostera marinaat its southern distribution limit in the North Pacific.Ciencias Marinas, 30: 21—34
Cassida K A, Muir J P, Hussey M Aet al, 2005. Biofuel Component Concentrations and Yields of Switchgrass in South Central U. S. Environments. Crop Science,45:682—692
Den Hartog C, 1970. The sea-grasses of the world. North Holland Publishing Company, Amsterdam, Netherlands: 234—275
Duarte C M, 1990. Seagrass nutrient content. Marine Ecology Progress Series, 67: 201—207
Hemminga M A, Marbà N, Stapel J, 1999. Leaf nutrient resorption, leaf lifespan and the retention of nutrients in seagrass systems. Aquatic Botany, 65: 141—158
Koerselman W, Meuleman A F, 1996. The vegetation N: P ratio: a new tool to detect the nature of nutrient limitation. Journal of Applied Ecology, 33: 1441—1450
Lee K S, Short F T, Burdick D M, 2004. Development of a nutrient pollution indicator using the seagrass,Zostera marina, along nutrient gradients in three New England estuaries. Aquatic Botany, 78: 197—216
Long F L, 1934. Application of cabrimetric methods to ecological research. Plant Physiology, 9: 323—327
Lucas C, Thangaradjou T, Papenbrock J, 2012. Development of a DNA barcoding system for seagrasses: Successful but not simple. PloS ONE, 7(1): e29987
Marion S R, Orth R J, 2010. Innovative techniques for large-scale seagrass restoration usingZostera marina(eelgrass) seeds.Restoration Ecology, 18(4): 514—526
Pedersen M F, Borum J, 1992. Nitrogen dynamics of eelgrassZostera marinaduring a late summer period of high growth and low nutrient availability. Marine Ecology Progress Series, 80: 65—73
Pradheeba M, Dilipan E, Nobi Eet al, 2011. Evaluation of seagrasses for their nutritional value. Indian Journal of Marine Sciences, 40: 105
Reusch T B H, Stam W T, Olsen J L, 2000. A microsatellite-based estimation of clonal diversity and population subdivision inZostera marina, a marine flowering plant. Molecular Ecology, 9: 127—140
Siegal-Willott J L, Harr K, Hayek L A Cet al, 2010. Proximate nutrient analyses of four species of submerged aquatic vegetation consumed by Florida manatee (Trichechus manatus latirostris) compared to romaine lettuce (Lactuca sativavar.longifolia). Journal of Zoo and Wildlife Medicine,41: 594—602
Wang W, Lin P, 1999. Transfer of salt and nutrients inBruguiera gymnorrhizaleaves during development and senescence.Mangroves and Salt Marshes, 3: 1—7
Yamamuro M, Chirapart A, 2005. Quality of the seagrassHalophila ovalison a Thai intertidal flat as food for the dugong. Journal of Oceanography, 61: 183—186
Zhou Y, Zhang F S, Yang H Set al, 2003.Comparison of effectiveness of different ashing auxiliaries for determination of phosphorus in natural waters, aquatic organisms and sediments by ignition method. Water Research, 37: 3875—3882
- 海洋与湖沼的其它文章
- 砂粒粒径与砂层厚度对单体筐养养殖系统中三疣梭子蟹(Portunus trituberculatus)幼蟹摄食行为与生长特性的影响研究*
- 发光细菌法在环渤海污水样品遗传毒性检测中的应用*
- 响应面法优化鱿鱼(Ommastrephes bartrami)皮胶原蛋白提取液脱色工艺*
- 氨氮急性胁迫对日本沼虾(Macrobrachium nipponensis)死亡率、耗氧率及窒息点的影响*
- 16S rDNA克隆文库解析仿刺参(Apostichopus japonicus)苗种培育池中生物絮团的细菌群落结构*
- 温度和盐度对短节硬毛藻(Chaetomorpha brachygona Harvey)生长发育的影响研究*

