温度和盐度对短节硬毛藻(Chaetomorpha brachygona Harvey)生长发育的影响研究*
丁兰平 李雯诗 谭华强 颜泽伟 黄冰心
(汕头大学 汕头 515063)
绿潮是一种海洋生态异常现象, 普遍发生于世界沿海各国(Fletcher, 1996; Schorieset al, 2000;Nelsonet al, 2003; Largoet al, 2004; Charlieret al,2007; Yabeet al, 2009; 唐启升等, 2010)。近几年来,在黄海海域连续大规模暴发绿潮, 如山东青岛、江苏如东等沿海, 绿潮改变了近海海洋生态环境, 也严重影响了沿岸的生态景观及养殖, 造成了经济损失, 引起了社会各界的高度关注(丁兰平等, 2009; 田晓玲等,2011; 吴玲娟等, 2013)。绿潮的主要种类是石莼科的石莼属、浒苔属和刚毛藻科的硬毛藻属、刚毛藻属等大型海藻(Menendez, 2005; 丁兰平等, 2009; 吴玲娟等, 2013), 其中石莼属和浒苔属形成常见绿潮, 受关注较多, 但其它的物种, 如刚毛藻和硬毛藻类, 往往被忽视(邓蕴彦等, 2011)。
硬毛藻属物种可在养殖池中迅速繁殖, 在生长旺盛期可直接将虾或海参缠绕致死。其藻体腐烂变质后致使水质恶化, 滋生各种病菌, 致使虾和海参出现明显病症和大量死亡, 给海水养殖业带来了较大的危害和经济损失(池永雪等, 2009; 邓蕴彦等, 2011)。有报道认为, 该属的某些物种也具入侵性(Menendez,2005; 池永雪等, 2009)。因此, 对于此问题性物种,有必要开展深入研究, 以便有效防控及合理开发利用。
温度影响着海藻的生长及繁殖(王菁等, 2013)。邓蕴彦等(2011)根据强壮硬毛藻生长、生殖的适温范围, 确定了该种所属区系, 并结合国内外文献, 判断了它的扩散分布潜力, 为该物种的防控提供了可靠的理论依据。盐度主要影响生物体的渗透压, 也是影响大型海藻生长及繁殖的重要因素之一。盐度的变化不仅能够改变海藻群落的生物量和组成(Fonget al,1996); 而且能够制约海藻在水体中分布。到目前为止,盐度对硬毛藻属物种的生殖影响, 我国还未见报道。
在 2011—2014年的粤东地区海藻资源调查中,发现在汕头南澳岛及汕尾遮浪的高潮带池沼中着生大量的硬毛藻, 经形态鉴定为短节硬毛藻Chaetomorpha brachygonaHarvey (图1)。本文以其为实验材料, 探讨了温度和盐度对它生长发育的影响, 以期预测它在国内的发展趋势并为后来更加深入的研究提供理论基础。

图1 短节硬毛藻的野外生境Fig.1 Habitat of C. brachygona from Nan’ao Island, China
1 材料与方法
1.1 实验材料
样品采自2013年12月5日广东汕头南澳岛海域(图1)。带回实验室用盐度为30的灭菌海水室温下充气培养一周。
灭菌海水: 取自汕头达濠区, 过滤煮沸后静置冷却待用。
培养海水: 每1000 mL天然海水加入1 mLf1培养液作为实验培养液。
1.2 物种鉴定
在解剖镜和光学显微镜下观察藻体细胞的颜色、大小、形态等基本特征, 并结合藻体的外部形态特征进行物种鉴定。

表1 f1培养液配方Tab.1 The formula of f1 medium
1.3 实验设计
挑选生长健康、色泽饱满的藻体, 用解剖刀将选取的藻体分别切成2 cm长的藻段, 实验之前统一置于 15°C的培养箱中预处理一晚。藻段按 15—20段/皿的密度放入培养皿中进行培养。温度(A)设定20、25、30°C 三个水平; 盐度(B)设定 10、20、30、40、50五个梯度。按3×5的15个组合进行双因素实验, 每组3个重复, 总共45个处理。每个培养皿加入15 mL的f1实验培养液, 放入相应条件下的恒温培养箱中持续培养, 设置光照强度为60 mol/(m2·s), 光暗比12h :12 h, 试验周期为12d, 每3天补充培养液10 mL, 每6天换1次水。分别在实验第3、6、9、12天测量藻段生长长度(seaweed length, SL)和藻体生长活力(seaweed vigor, SV), 并在显微镜下观察藻段各个时期的显微结构。
1.4 结果测定
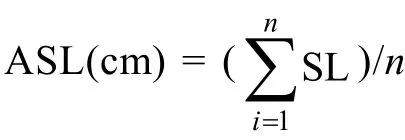
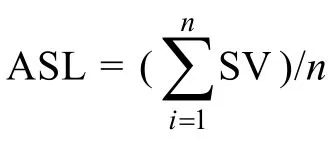
显微观察: 每个培养皿中随机挑取藻段观察, 使用倒置荧光拍照显微镜 DMI3000B(莱卡)拍照、记录结果。
2 结果
2.1 观察结果
培养至第 3天, 在 3个温度水平(20、25、30°C)下的藻段均可见生殖细胞(图2), 25°C和30°C下还出现藻段中单个生殖细胞放散完毕或全部藻段内生殖细胞放散完毕(图2)。在温度20°C和盐度40, 温度25°C和盐度30、40, 温度30°C和盐度为10、30、40的条件组合下藻段细胞内生殖细胞已空, 有的藻段已呈现死亡状态, 开始腐烂(图2)。培养至第6天, 20°C条件下的藻段也已出现死亡腐烂的现象, 但是20—30°C条件下仍有藻段内部细胞处于生殖细胞形成期。至培养第12天, 20°C条件下, 藻段内部仍有生殖细胞形成。
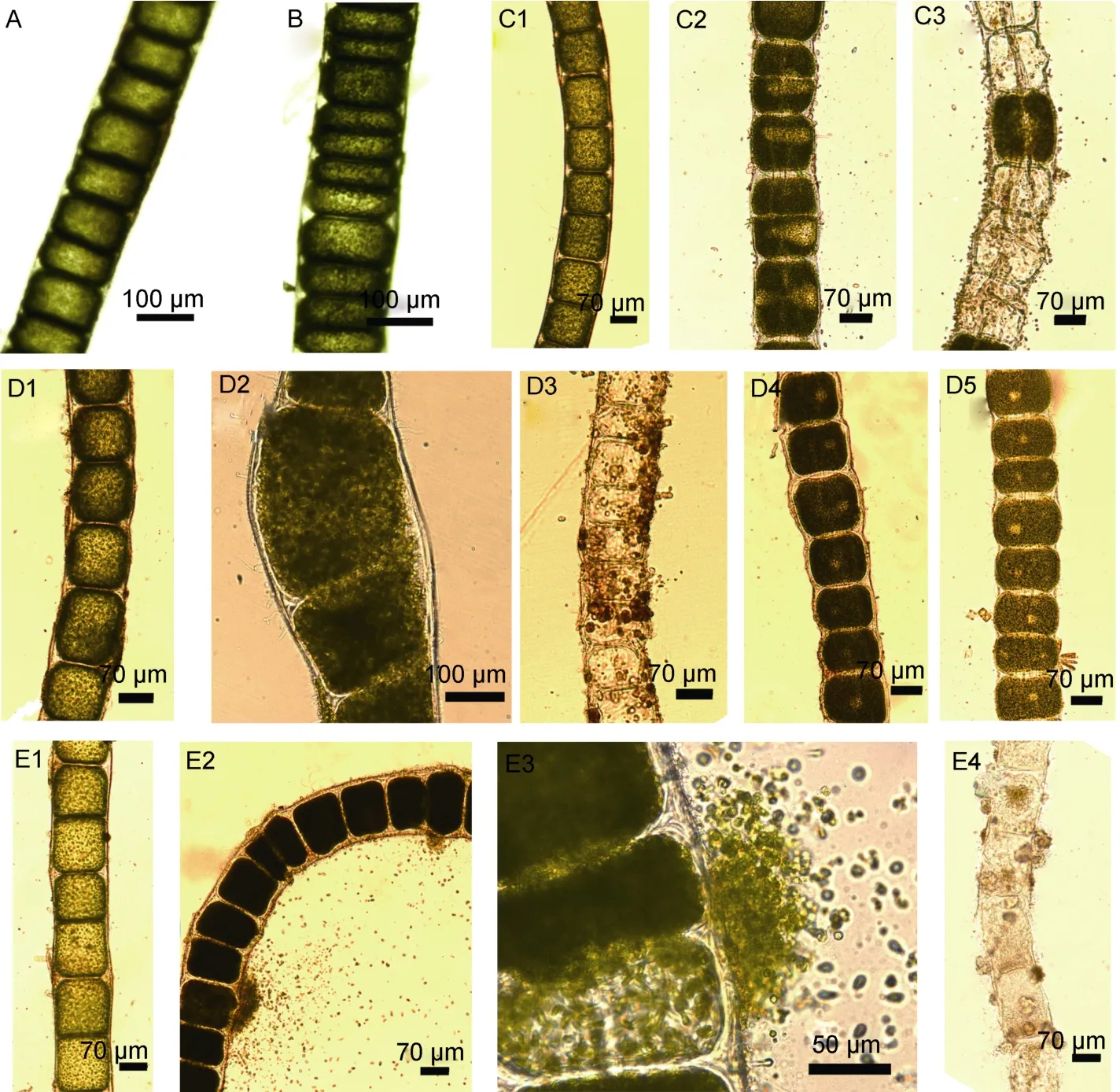
图2 不同温度和盐度对短节硬毛藻生长发育的显微观察Fig.2 Microscopic observation on growth and development of C. brachygona in various temperatures and salinities
2.2 温度对短节硬毛藻生长的影响
2.2.1温度对短节硬毛藻生长的影响从图3中可以看出, 在相同的盐度条件下, 短节硬毛藻在温度20—30°C的条件下长度均明显有不同程度的增长,盐度为 10、20、40、50时, 藻段的生长与温度相关,ASL 呈: 30°C>25°C>20°C, 并在盐度 20、温度 30°C时ASL最长达4.55 cm。盐度为30的条件下, 温度20°C的ASL明显长于温度25°C和 30°C的 ASL, 而30°C的ASL仍长于25°C的 ASL。

图3 培养3天时温度、盐度对短节硬毛藻ASL的影响Fig.3 Effect of temperature and salinity on ASL of C.brachygona in 3-day culture
2.2.2温度对短节硬毛藻活力的影响培养至第3天, 20—30°C条件下短节硬毛藻 ASV主要集中在0.65—0.75Y, 20°C、25°C、30°C 时 ASV 分别集中在0.70—0.75Y, 0.60—0.70Y和 0.55—0.65Y, 各温度下ASV 呈: 20°C>30°C>25°C (图4a)。培养至第 6 天, 20—30°C条件下ASV主要集中在0.55—0.70Y, 其中20°C时ASV主要集中在0.60—0.70Y, 此时不同温度盐度下藻体的ASV波动较大, 盐度20条件下, 藻段ASV与温度的关系呈 25°C>20°C>30°C, 而盐度 30的条件下, 藻段 ASV 与温度的关系呈 20°C>30°C>25°C (图4b)。此时温度不能作为单一影响ASV的因子。培养至第12天时, ASV主要集中在0.50—0.65Y, 20—30°C时的 ASV分别集中在 0.65—0.70Y, 0.55—0.70Y和0.50—0.65Y。25°C和20°C时的整体ASV稍高于30°C的, 温度30°C、盐度40时ASV最低至0.496Y(图4c)。由藻段培养第3、6、12天的活力范围可得, 20°C有利于藻段维持活力。
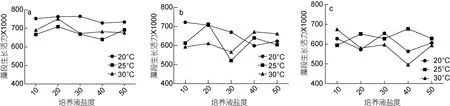
图4 温度和盐度对短节硬毛藻ASV的影响Fig.4 Effects of temperature and salinity on ASV of C. brachygona
2.3 盐度对短节硬毛藻生长的影响
2.3.1盐度对短节硬毛藻生长的影响如图3所示,相同温度条件下, 短节硬毛藻在盐度为10—50范围内均显示不同程度的生长, 并且随盐度的升高呈现先升高后下降的趋势。盐度10—30的ASL明显长于盐度为40和50的ASL, 在盐度20—30时藻段ASL最长达4.55 cm, 盐度到达40时, 短节硬毛藻藻段的生长明显受到抑制, 盐度50条件下的ASL基本分布在2.07—2.20 cm的范围内。盐度10—30时, 更有利于藻体生长,整体趋势为: 20>30>10>40>50。
2.3.2盐度对短节硬毛藻活力的影响如图4显示, 相同的培养天数和相同温度下, 藻段的 ASV在盐度10—50的范围内与盐度的单一变化关系不明显,不同温度下, 藻段ASV随盐度的变化有不同趋势。
2.4 温度和盐度对短节硬毛藻生长和发育的综合影响
如图3、图4所示, 温度和盐度对短节硬毛藻生长的共同影响并结合显微观察结果, 在同一培养时间下, 藻段的ASL最大的5个值及其所对应的条件分别为; 30°C盐度20时ASL为4.55 cm, 20°C盐度30时ASL为4.4 cm, 25°C盐度20时为4.23 cm, 30°C盐度30时ASL为3.81 cm, 25°C盐度30时ASL为3.66 cm。以上可得, 温度和盐度共同影响硬毛藻的生长, 适宜短节硬毛藻生长的盐度范围为 20—30、温度为 20—30°C; 同时结合观察结果, 25—30°C相较而言更适合短节硬毛藻形成生殖细胞。
3 讨论
3.1 温度和盐度对短节硬毛藻生长的影响
温度是藻类生长发育的重要环境因子, 对藻类的生长发育和分布区域具有重要影响(徐宁等, 2004)。盐度也是影响藻类的环境因子之一, 通过影响藻类细胞的能量吸收和渗透压来影响藻类生长(朱明等,2003)。对于不同海藻生长的适宜温度盐度条件的研究, 已有不少报道, 如孔石莼的适宜生长温度范围在15—25°C、盐度在 15—40(刘静雯等, 2001), 刺枝鱼栖苔在20—25°C生长的较快(丁兰平等, 2013), 小球藻的适宜生长温度范围在 25—42.5°C(欧阳峥嵘等,2010), 威海束生刚毛藻的最适条件为温度 15—25°C、盐度 20—45(汪城墙等, 2008), 强壮硬毛藻的生长生殖适宜温度为21—29°C(邓蕴彦等, 2011)。本文实验结果表明, 温度和盐度对短节硬毛藻的生长均有一定影响。在20—30°C范围内短节硬毛藻均能生长, 在 25—30°C 时, 培养初期的短节硬毛藻生长更快并在30°C时ASL达到最大, 这与某些文献的报道一致(袁丽娜等, 2008)。有报道认为, 25°C是大多数藻生长的适宜温度(Wanget al, 2011)。这种差异可能与试验材料、取材阶段, 更与藻体的地区差异有关系(李娜等, 2009), 而本实验中短节硬毛藻生长可以忍受20—30°C的温度范围(图5)。短节硬毛藻在盐度为10—50的范围内均能生长, 在盐度10—30的范围内,随盐度升高ASL先升高后下降, 在盐度20时ASL达到最大; 而盐度到达40—50时, ASL下降并明显低于盐度 10—30范围内的 ASL。有研究显示, 海链藻在盐度20时也会达到最大生长率(朱明等, 2003), 低盐度对浒苔孢子释放量的影响比高盐度要明显(高珍,2010)。本文研究结果表明, 短节硬毛藻的最适生长盐度在20—30, 它对高盐还有较强的适应性。
3.2 温度和盐度对短节硬毛藻光合效率的影响
研究显示, 有效量子产量(Yield)与相对电子传递效率(vETR)均可反映藻类光合效率(高亚平等, 2011),实验中以实际光合效率Yield测量值作为短节硬毛藻生长活力。结果显示, 温度对短节硬毛藻的光合效率有一定的影响, 实验条件下呈: 20°C>30°C>25°C, 与汤文仲等(2009)在温度对长石莼光合作用的影响研究中的结果: 25°C>20°C>15°C>30°C 稍有不同, 这可能与实验材料、处理过程以及实验条件有关, 但均反映出相比30°C, 温度较低的 20°C更有利于光合效率。不同于温度对光合作用的显著影响, 实验过程中短节硬毛藻的生长活力与盐度并不呈单一变化关系。然而, 曾呈奎等(1980)通过研究 12种底栖绿藻的光合作用, 得出大部分潮间带底栖绿藻都属于适应高光强类型, 高亚平等(2011)也证明绿藻实际 Yield值与光强呈负相关, 由此说明光照强度相比盐度更适合用于光合效率的研究。

图5 盐度20下不同温度短节硬毛藻的显微观察Fig.5 Microscopic observation on C. brachygona in various temperatures at salinity 20 a. 20°C; b. 25°C; c. 30°C
3.3 短节硬毛藻暴发潜力分析
绿潮种主要有石莼属、浒苔属、刚毛藻属、硬毛藻属等大型绿藻(刘峰等, 2012), 短节硬毛藻是属于我国南方沿海的绿潮种之一。据报道, 温度和影响盐度的降水量都是影响绿潮的重要环境因子(唐启升等,2010)。绿潮藻大多具有广温广盐的特性(夏斌等,2009), 适宜的温度、盐度可以加速藻体生长(吴玲娟等, 2013); 据报道, 适宜的盐度范围一般在 5—45(Pedroet al, 2008), 浒苔属和石莼属的绿潮藻机会种(唐启升等, 2010)对高浓度氧、强光、干燥、低盐条件均有耐受力(丁兰平等, 2009), 缘管浒苔(长石莼)适宜生长温度为 15—25°C(汤文仲等, 2009)。因此, 对短节硬毛藻开展温度和盐度等研究就显得尤为重要。本实验结果表明, 短节硬毛藻在盐度为10—50、温度20—30°C的范围内都能健康生长, 其适宜温盐条件为25—30°C、20—30, 类似于其它绿潮藻, 短节硬毛藻具有较广的盐度适应性, 并且适宜生长生殖的温度条件在我国南方易于达到, 因此它具有引发绿潮的潜在可能性。
丁兰平, 孙国栋, 黄冰心等, 2013. 温度和盐度对刺枝鱼栖苔(Acanthophora spicifera)(红藻门, 松节藻科)生长及其几种光合色素的影响. 海洋与湖沼, 44(4): 913—918
丁兰平, 栾日孝, 2009. 浒苔(Enteromorpha prolifera)的分类鉴定、生境习性及分布. 海洋与湖沼, 40(1): 68—71
王菁, 陈家长, 孟顺龙, 2013. 环境因素对藻类生长竞争的影响. 中国农学通报, 17: 52—56
邓蕴彦, 丁兰平, 汤晓荣等, 2011. 强壮硬毛藻(Chaetomorpha valida)的温度性质及其在中国海藻区系中的扩散潜力.海洋与湖沼, 42(3): 404—408
田晓玲, 霍元子, 陈丽平等, 2011. 江苏如东近海绿潮藻分子检测与类群演替分析. 科学通报, 56(4—5): 309—317
朱明, 张学成, 茅云翔等, 2003. 温度、盐度及光照强度对海链藻(Thalassiosirasp.)生长的影响. 海洋科学, 12: 58—61
刘峰, 逄少军, 2012. 黄海浒苔绿潮及其溯源研究进展. 海洋科学进展, 30(03): 441—449
刘静雯, 董双林, 马甡, 2001. 温度和盐度对几种大型海藻生长率和NH4-N吸收的影响. 海洋学报, 23(02): 109—116
池永雪, 王丽梅, 栾日孝等, 2009. 中国硬毛藻属新记录种——强壮硬毛藻. 水产科学, 28(3): 162—163
汤文仲, 李信书, 黄海燕等, 2009. 不同光强和温度对长石莼(缘管浒苔)光合作用和叶绿素荧光参数的影响. 水产学报,33(5): 762—769
李娜, 李彦军, 祁保霞, 2009. 温度、光照、盐度对刚毛藻光合作用的影响. 内蒙古民族大学学报, 24(6): 659—661
吴玲娟, 曹丛华, 高松等, 2013. 我国绿潮发生发展机理研究进展. 海洋科学, 12: 118—121
汪城墙, 赵宏, 姜波等, 2008. 威海束生刚毛藻的基础生态研究. 科技信息, 11: 27—28
欧阳峥嵘, 温小斌, 耿亚红等, 2010. 光照强度、温度、pH、盐度对小球藻(Chlorella)光合作用的影响. 武汉植物学研究, 28(1): 49—55
袁丽娜, 宋炜, 肖琳等, 2008. 多环境因素全面正交作用对铜绿微囊藻生长的效应研究. 南京大学学报, 44(4):408—414
夏斌, 马绍赛, 崔毅等, 2009. 黄海绿潮(浒苔)暴发区温盐、溶解氧和营养盐的分布特征及其与绿潮发生的关系.渔业科学进展, 30(5): 94—101
徐宁, 吕颂辉, 陈菊芳等, 2004. 温度和盐度对锥状斯氏藻生长的影响. 海洋环境科学, 23(3): 36—38
高珍, 2010. 浒苔生理生态特性和转录组研究. 兰州: 甘肃农业大学硕士学位论文, 1—65
高亚平, 张继红, 方建光等, 2011. 桑沟湾六种大型海藻光合特性的比较研究. 渔业现代化, 38(1): 33—37
唐启升, 张晓雯, 叶乃好等, 2010. 绿潮研究现状与问题. 中国科学基金, 01: 5—9
曾呈奎, 周百成, 潘忠正, 1980. 底栖海藻比较光合作用研究Ⅰ. 潮间带绿藻光合作用特性和色素组成. 海洋与湖沼,11(2): 134—140
Adriano Arriel Saquet, Josef Streif, 2002. Chlorophyll fluorescence as a predictive method for detection of browning disorders in ‘Conference’ pears and ‘Jonagold’apples during controlled atmosphere storage. Cienia Rural,Santa Maria, 32(4): 571—576
Charlier R H, Mor P, Finkl C Wet al, 2007. Green tides on the Brittany coasts. Environmental Research, Engineering and Management, 3(41): 52—59
Fletcher R L, 1996. The Occurrence of ‘Green Tides’: A Review.In: Schramm W, Nienhuis P H ed. Marine Benthic Vegetation: Recent Changes and the Effects of Eutrophication. Academic, NY, 7—43
Fong P, Boyer K E, Desmond J S, 1996. Salinity stress, nitrogen competition, and facilitation: what controls seasonal succession of two opportunistic green macroalgae. Journal of Experimental Marine Biology and Ecology, 206: 203—221
Largo D B, Sembrano J, Hiraoka Met al, 2004. Taxonomic and ecological profile of “green tides” species ofUlva(Ulvales,Chlorophyta) in central Philippines. Hydrobiologia, 512(1):247—253
Menendez M, 2005. Effect of nutrient pulses on photosynthesis ofChaetomorpha linumfrom a shallow Mediterranean coastal lagoon. Aquatic Botany, 82: 181—192
Nelson T A, Lee D J, Smith B C, 2003. Are “green tides” harmful algal blooms? Toxic properties of water-soluble extracts from two bloom-forming macroalgae,Ulva fenestrataandUlvaria obscura(Ulvophyceae). Journal of Phycology, 39(5):874—879
Pedro H de Paula Silva, Shannon McBride, Rocky de Nyset al,2008. Integrating filamentous ‘green tide’ algae into tropical pond-based aquaculture. Aquaculture, 284(1): 74—80
Schories D, Anibal J, Chapman Aet al, 2000. Flagging greens:hydrobiid snails as substrata for the development of green algalmats (Enteromorphaspp.) on tidal flats of North Atlantic coasts. Marine Ecology Progress Series, 199: 127—136
Wang Z H, Yuan M L, Liang Yet al, 2011. Effects of temperature and organic and inorganic nutrients on the growth ofChattonella marina(Raphidophyceae) from the Daya Bay,South China Sea. Acta Oceanologica Sinica, 30(3): 124—131
Yabe T, Ishii Y, Amano Yet al, 2009. Green tide formed by free-floatingUlvaspp. at Yatsu tidal flat, Japan. Limnology,10(3): 239—245

