氨氮急性胁迫对日本沼虾(Macrobrachium nipponensis)死亡率、耗氧率及窒息点的影响*
邹李昶 任夙艺 王志铮① 朱卫东 吴一挺
(1. 浙江海洋学院 舟山 316022; 2. 余姚市水产技术推广中心 余姚 315400; 3. 舟山市海洋与渔业局 舟山 316000)
氨氮作为含氮化合物的主要最终产物和积聚于水体中的重要无机污染物(Coltet al, 1981; Alonsoet al, 2004; Prenteret al, 2004), 既是评价水域环境质量的重要监测指标, 也是反映水产养殖动物存活状况的重要环境因子。已有研究表明, 氨氮既能直接损害甲壳动物的鳃组织, 也可通过渗入血淋巴引起甲壳动物免疫力下降, 代谢机能紊乱和病原致敏性提高(Chenet al, 1992b; Ackermanet al, 2006; Spenceret al,2008; Sunget al, 2011; 蒋琦辰等, 2013), 故极易引发甲壳动物爆发性疾病的发生。日本沼虾Macrobrachium nipponensis(De Haan, 1849)系我国重要的淡水虾类养殖对象之一, 池塘高密度养殖往往会导致堆积于池底的大量残饵经氨化作用使水体中氨氮浓度急剧升高, 因而系统地开展氨氮对日本沼虾的毒害作用与机制研究, 并据此探析进而确定其氨氮安全耐受限量, 无疑对指导该虾的安全养殖生产具重要现实意义。
研究表明, NH3对水产养殖动物具强毒性(Alonsoet al, 2004), 虽然其在氨氮中的存在比例主要受制于水体中的温度、pH和盐度(Chenet al, 1992a, 1993),但溶解氧也将直接影响其毒性作用的发挥。据报道, 非离子氨的毒性与水中溶解氧含量呈负相关(Thurstonet al, 1981), 高溶解氧可显著提高罗氏沼虾(王龙等,2011)和中国对虾(王娟等, 2007)等甲壳动物对非离子氨的耐受能力。但目前国内外关于氨氮对日本沼虾生态毒理方面的研究, 仅涉及受氨氮胁迫下饲料中添加维生素 C对日本沼虾耗氧率、排氨率及 Na+/K+ATPase的影响(Wanget al, 2003), 以及持续充氧条件下氨氮急性胁迫对日本沼虾酚氧化酶活力、血细胞数量及血蓝蛋白含量的影响(张亚娟等, 2008, 2010), 而有关静水实验条件下氨氮对该虾的急性毒害作用及其安全耐受限量的定量研究则迄今尚未见报道。基于此, 本文作者于2010年8—9月采用静水停食法在余姚市水产技术推广中心实验基地内就氨氮对日本沼虾死亡率、耗氧率及窒息点的影响开展了较为系统的研究, 在获悉氨氮对该虾的急性致死作用并求得 96h LC50值后, 采用SC = 0.1×96h LC50(Sprague, 1971)估算氨氮安全质量浓度, 并以此为终点设置实验质量浓度梯度, 通过测定耗氧率和窒息点, 在核验该估算值可靠性的同时, 确定该虾的安全耐受限量。
1 材料与方法
1.1 材料
1.1.1日本沼虾购自余姚市马渚镇青丰水产养殖场, 运回实验基地驯养4—5d(驯养期间不投喂饲料)后, 选取其中肢体完好、规格相近、反应敏捷的健壮个体作为实验对象, 具体规格为体长(4.29±0.32)cm、体质量(1.80±0.12)g。
1.1.2试剂NH4Cl和液体石蜡均为AR级, 分别购自国药集团化学试剂有限公司和无锡市晶科化工有限公司。按需用双蒸水将 NH4Cl制成一定质量浓度的母液, 现配现用。
1.1.3理化条件以自然曝气 48h的自来水为实验用水, 水温(24±0.2)°C, pH 7.61±0.04, DO (7.24±0.14)mg/L, 水质符合《NY 5051-2001无公害食品 淡水养殖用水水质》(中华人民共和国农业部, 2001)要求。
1.2 实验方法
1.2.1氨氮对日本沼虾的急性毒性实验在室温条件下, 以规格60cm×35cm×30cm的白色塑料箱为实验容器(实验实际容积为20L), 依次设0(对照组)、1.346、2.355、3.701、5.720、9.421mg/L等6个实验梯度(每一梯度设3个平行, 每个平行放实验虾10尾),采用静水停食实验法开展氨氮对日本沼虾的急性毒性实验。实验期间, 连续观察实验虾的活动状况, 并按王志铮等(2013)确定的死亡个体判定标准及时取出死亡个体, 每24h换液并统计1次总体死亡率。
1.2.2氨氮对日本沼虾耗氧率和窒息点的影响实验依次设 0(对照组)、0.056、0.112、0.169、0.225、0.281和0.337mg/L等 6个实验梯度, 并按王志铮等(2013)的实验方法开展氨氮对日本沼虾耗氧率和窒息点的影响实验, 实验时间均始于22:00。
1.3 数据处理
根据急性毒性实验结果, 建立 24h、48h、72h、96h等不同观察时段氨氮质量浓度(x)与日本沼虾死亡概率单位(y)间的直线回归方程; 应用 SC = 0.1×96h LC50求得氨氮安全质量浓度估算值, 并借助各实验时段MAC值(王志铮等, 2007)的变化特征分析实验虾对氨氮的蓄积与降减动态; 昼、夜区间耗氧率的统计时段分别按6:00至18:00和18:00至翌日6:00, 并采用 LSD多重比较法分别检验耗氧率、窒息点的组间差异显著性(a=0.05)。上述统计分析均借助 SPSS 17.0软件来完成。
2 结果
2.1 急性毒性死亡率与死亡症状
除对照组外, 相同氨氮质量浓度组日本沼虾的死亡率均随实验时间的延长而增加, 相同实验时段内日本沼虾的死亡率均随氨氮质量浓度的提高而增加(图1)。观察发现, 濒死实验虾鳃组织均出现不同程度的受损变白症状, 且该症状随氨氮质量浓度增大和攻毒时间延长而变得愈加明显, 表明鳃是氨氮攻毒日本沼虾的重要靶器官, 氨氮攻毒该虾的时间—剂量效应与其鳃组织受损情形关联密切。
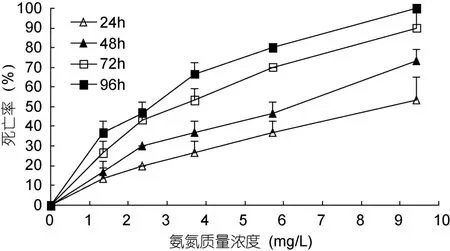
图1 氨氮对日本沼虾的急性毒性Fig.1 Acute toxicity of ammonia-N on M. nipponensis
2.2 急性致毒特征
日本沼虾24h、48h、72h、96h的LC50值分别为7.922、6.034、4.237 和 3.371mg/L(表1); 经计算, 实验24—48h、48—72h、72—96h时段的MAC值依次为41.5%、39.5%和19.0%, 表明氨氮对日本沼虾的致死作用强度与实验时间呈正相关, 而在其体内的蓄积作用强度却与实验时间呈负相关。经估算, 日本沼虾对氨氮的安全质量浓度为0.337mg/L。
2.3 耗氧率
由图2可见, 各实验组和对照组在时段耗氧率间的变化上均趋于一致, 且耗氧率均呈夜均>日均>昼均, 表明各实验组日本沼虾的呼吸生理节律均未发生实质性改变; 与此同时, 各时段及夜均、日均、昼均耗氧率随氨氮质量浓度的梯次增加均呈“∩”型走势的结果, 进一步表明本研究质量浓度范围内的氨氮可致日本沼虾耗氧率表露毒物兴奋效应(hormesis)。
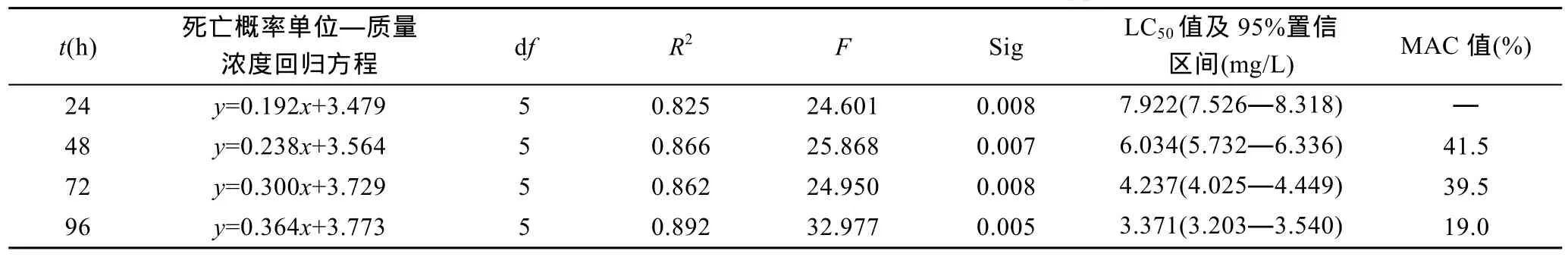
表1 氨氮对日本沼虾的急性致毒特征Tab.1 The acute toxic characteristic of ammonia-N to M. nipponensis
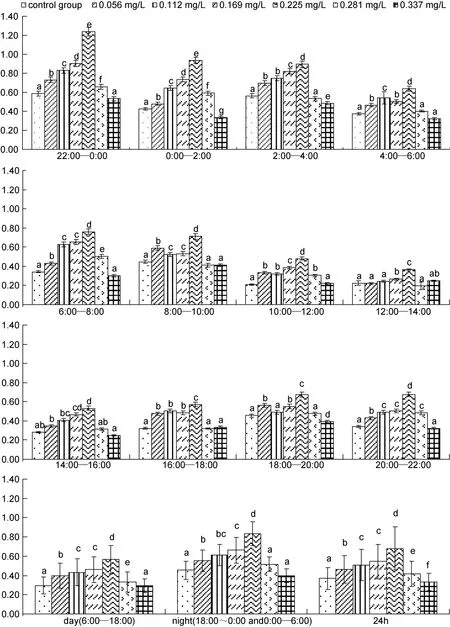
图2 氨氮对日本沼虾耗氧率昼夜节律的影响Fig.2 The effect of ammonia-N on oxygen consumption rate of circadian rhythm in M. nipponensis
由图2可知, 在本研究所设各实验组中, 各时段耗氧率以及昼均、夜均和日均耗氧率均以氨氮质量浓度 0.225mg/L实验组为最高(P<0.05), 而 0.337mg/L实验组不仅昼均、夜均耗氧率与对照组均无差异(P>0.05), 且在所观测的12个时段中耗氧率与对照组无差异(P>0.05)的时段也多达 9个, 为本研究诸实验组中与对照组耗氧率相似性最高的实验组别, 故致日本沼虾耗氧率表露毒物兴奋效应峰值的氨氮质量浓度为 0.225mg/L, 而致日本沼虾毒物兴奋效应被终止的氨氮质量浓度则为0.337mg/L。
2.4 窒息点
由图3可见, 实验组窒息点氧含量随氨氮质量浓度的增加依次呈稳定、略增、再稳定之态势。其中, 对照组窒息点氧含量仅与0.056mg/L、0.112mg/L氨氮质量浓度实验组无显著差异(P>0.05), 氨氮质量浓度0.169、0.225、0.281和0.337mg/L实验组窒息点氧含量间均无显著差异(P>0.05), 与对照组和氨氮质量浓度 0.169mg/L实验组窒息点氧含量均无显著差异(P>0.05)的组别仅为0.112mg/L实验组, 表明致该虾窒息点发生显著改变的氨氮临界阈质量浓度为0.112mg/L。

图3 氨氮对日本沼虾窒息点的影响Fig.3 Effects of ammonia-N on the suffocation point of M. nipponensis
3 讨论
Thurston等(1981)指出, 非离子氨对水产养殖动物的毒害作用强度与水中溶解氧含量呈负相关。据报道, 水温(23±1)°C、pH 7.11±0.07 条件下, 非离子氨对全长3cm左右罗氏沼虾溶解氧7mg/L、11mg/L实验组的96h LC50值分别为0.83 mg/L和1.425 mg/L (王龙等, 2011); 水温21°C、盐度30—31、pH 7.99条件下, 非离子氨对体长1.9—2.1cm中国对虾溶解氧5.5—6.0mg/L、10—12mg/L实验组的96h LC50值分别为0.98mg/L和1.52mg/L (王娟等, 2007)。研究发现, 体长3.5—4.1cm的日本沼虾在水温(25.0±1)°C条件下,饥饿2d内的超氧阴离子OD值与对照组无显著差异(P>0.05), 且其 SOD、CAT活力均显著大于对照组(P<0.05), 饥饿4d时不仅其超氧阴离子OD值显著高于对照组(P<0.05), 而且SOD、CAT活力也均显著低于对照组(P<0.05), 饥饿6d后其超氧阴离子OD值极显著高于对照组(P<0.01), 且SOD、CAT活力均极显著低于对照组(P<0.01)(李志华等, 2007), 体长 4.2—5.2cm的日本沼虾在水温20°C条件下, 其饥饿代谢适应区和饥饿存活适应区分别为饥饿处理 2—4d和饥饿处理8—10d , 且SOD活力随饥饿时间的延长而显著下降(张静等, 2007), 表明饥饿4d为日本沼虾的免疫抗逆能力和代谢水平出现显著下滑的临界点。故在水温、pH及实验虾体长和体质量规格均相近条件下,停食1d后连续充气培养的日本沼虾受氨氮质量浓度36.6mg/L攻毒24h后的成活率仍为100% (张亚娟等,2008, 2010), 而本研究所获氨氮对日本沼虾的 24h LC50值则仅为 7.922mg/L (停食驯养 4—5d后开始实验, 实验期间不充气)的根本原因, 无疑为两者间在实验供氧方式和实验用虾驯养方法选择上的差异共同所致。据报道, 在与本研究相同水温及相近 pH条件下, 体质量(0.942±0.187)g的日本沼虾受氨氮攻毒的96h LC50值为36.6mg/L (Wanget al, 2003), 远高于本研究所获的 3.371mg/L [实验虾体质量为(1.80±0.12)g], 表明日本沼虾养成后期对氨氮攻毒更具敏感性。综上, 为进一步规避养殖风险, 应在该虾养殖后期切实提高其生长所需的食物和溶氧保障水平。
毒物兴奋效应是生物长期进化过程中为提高在各种低水平胁迫下的成活率而形成的一种顺应自然选择的生理机制, 意在当生物体内稳态(homostatic)受损后能迅速获得恢复(Calabreseet al, 2001)。据报道, 非离子氨对甲壳动物的毒害作用往往表露为鳃组织受损及血淋巴 pH的改变(Coltet al, 1981;Romanoet al, 2007), 水环境中过高质量浓度的非离子氨不仅会导致甲壳动物耗氧量的增加和血蓝蛋白浓度的下降(Chenet al, 1994; Racpttaet al, 2000), 而且也将直接妨碍鳃的排氨作用(Spiceret al, 1994;Maltby, 1995)。因此, 张亚娟等(2008, 2010)所报道的日本沼虾酚氧化酶活力、血细胞数量和血蓝蛋白含量均随水环境中氨氮质量浓度的增加而呈先升后降趋势, 在连续充气状态下血蓝蛋白含量达到峰值的氨氮质量浓度为 2.2mg/L (P<0.05), 远低于酚氧化酶活力和血细胞数量均达到峰值的氨氮质量浓度8.7mg/L(P<0.05)的情形, 与本研究中濒死日本沼虾鳃组织受损变白症状随氨氮质量浓度增大和攻毒时间延长而变得愈加明显的现象, 以及随氨氮质量浓度的梯次增加, 日本沼虾各时段耗氧率及夜均、日均、昼均耗氧率均呈“∩”型走势(图2)和窒息点呈稳定、略增和再稳定之态势(图3)的结果, 均表明以呼吸生理补偿为代价的内稳态保持机制是引发日本沼虾受氨氮急性胁迫下其耗氧率表露毒物兴奋效应的主因, 这就为人们从呼吸生理变化特征的角度来进一步表征氨氮对日本沼虾的安全质量浓度提供了重要的证据支持。目前, 国内外有关毒物对目标水产养殖动物安全质量浓度值的估算多采用SC = 0.1×96h LC50, 因96h LC50值具相应的置信区间, 故实际上SC值的设定也应具上、下限。由此, 在致日本沼虾耗氧率表露毒物兴奋效应的氨氮质量浓度范围内, 可将0.112mg/L这一致日本沼虾尚未越过该效应耗氧率峰值且窒息点氧含量处于临界阈水平的氨氮质量浓度, 定义为日本沼虾安全质量浓度取值范围的下限; 将 0.337mg/L这一致日本沼虾耗氧率终止毒物兴奋效应且窒息点含氧量显著高于对照组(P<0.05)的氨氮质量浓度(图2, 图3), 定义为日本沼虾安全质量浓度取值范围的上限, 其与急性毒性实验所获的估算值(SC = 0.1×96h LC50)完全一致(表1)。
王龙, 郝志敏, 王晶, 2011. 两种溶氧条件下亚硝酸盐和氨氮对罗氏沼虾毒性比较的研究. 饲料与畜牧, 25(8): 12—16
王娟, 曲克明, 刘海英等, 2007. 不同溶氧条件下亚硝酸盐和氨氮对中国对虾的急性毒性效应. 海洋水产研究, 28(6):1—6
王志铮, 申屠琰, 熊威, 2007. 4种消毒剂对麦瑞加拉鲮鱼幼鱼的急性毒性研究. 海洋水产研究, 28(3): 92—97
王志铮, 任夙艺, 赵晶等, 2013. Zn2+对日本沼虾(Macrobrachium nipponensis)幼虾的急性致毒效应. 海洋与湖沼, 44(1): 235—240
中华人民共和国农业部, 2001. NY 5051-2001无公害食品 淡水养殖用水水质. 北京: 中国标准出版社, 1—5
李志华, 谢松, 王军霞等, 2007. 饥饿对日本沼虾生长和部分免疫功能的影响. 上海水产大学学报, 16(1): 16—21
张静, 王军霞, 张亚娟等, 2007. 饥饿对日本沼虾代谢及SOD活性的影响. 河北大学学报(自然科学版), 27(5):537—540
张亚娟, 王超, 刘存歧等, 2010. 氨态氮和亚硝态氮对日本沼虾酚氧化酶活力及血蓝蛋白含量的影响. 水产科学,29(1): 31—34
张亚娟, 刘存歧, 王军霞等, 2008. 氨态氮和亚硝态氮对日本沼虾血细胞数量及血蓝蛋白含量的影响. 四川动物, 27(5):853—854
蒋琦辰, 顾曙余, 张文逸等, 2013. 氨氮急性胁迫及其毒后恢复对红螯光壳螯虾幼虾相关免疫和代谢指标的影响. 水产学报, 37(7): 1066—1072
Ackerman P A, Wicks B J, Iwama G Ket al, 2006. Low levels of environmental ammonia increase susceptibility to disease in Chinook salmon smolts. Physiological and Biochemical Zoology, 79(4): 695—707
Alonso A, Camargo J A, 2004. Toxic effects of unionized ammonia on survival and feeding activity of the freshwater amphipodEulimnogammarus toletanus(Gammaridae,Crustacea). Bull Environ Contam Toxicol, 72: 1052—1058
Calabrese E J, Baldwin L A, 2001. U-shaped responses in biology,toxicology, and public health. Annu Rev Public Health, 22:15—33
Chen J C, Cheng S Y, Chen C T, 1994. Changes of haemocyanin,protein and free amino acid levels in the haemolymph ofPenaeus japonicusexposed to ambient ammonia. Comp Biochem Physiol, 109A(2): 339—347
Chen J C, Kou Y Z, 1993. Accumulation of ammonia in the haemolymph ofPenaeus monodonexposed to ambient ammonia. Aquaculture, 109: 177—185
Chen J C, Lin C L, 1992a. Oxygen consumption and ammonia-N excretion ofPenaeus chinensisjuveniles exposed to ambient ammonia at different salinity levels. Comp Biochem Physiol,102C(2): 287—291
Chen J C, Nan F H, 1992b. Effect of ambient ammonia-N excretion and ATPase activity ofPenaeus chinensis. Aquat Toxic, 23: 1—10
Colt J E, Armstrong D A, 1981. Nitrogen Toxicity to Crustaceans,Fish and Molluscs. In: Allen L J, Kinney E C ed.Proceedings of the Bio-Engineering Symposium for Fish Culture. Fish Culture Section. American Fisheries Society,Northeast Society of Conservation Engineers, Bethesda,Maryland, 34—47
Maltby L, 1995. Sensitivity of the crustaceansGammarus pulex(L.) andAsellus aquaticus(L.) to short-term exposure to hypoxia and unionized ammonia: observation and possible mechanisms. Water Res, 29: 187—781
Prenter J, MacNeil C, Dick J Tet al, 2004. Lethal and sublethal toxicity of ammonia to native, invasive and parasitised freshwater amphipods. Water Res, 38: 2847—2850
Romano N, Zeng C S, 2007. Ontogenetic changes in tolerance to acute ammonia exposure and associated gill histological alterations during early juvenile development of the blue swimmer crab,Portunus pelagicus. Aquaculture, 266: 245—254
Spencer P, Pollock R, Dubé M, 2008. Effects of un-ionized ammonia on histological, endocrine, and whole organism endpoints in slimy sculpin (Cottus cognatus). Aquatic Toxicology, 90: 300—309
Spicer J I, McMahon B R, 1994. Gill function in the amphipodMegalorchestia(Orchestoides)californiana(Brandt, 1851)(Crustacea). Can J Zool, 72: 1155—1158
Sprague J B, 1971. Measurement of pollutant toxicity to fish. III.Sublethal effects and “safe” concentrations. Water Res, 5:245—266
Sung Y Y, MacRae T H, Sorgeloos Pet al, 2011. Stress response for disease control in aquaculture. Reviews in Aquaculture,3(3): 120—137
Thurston R V, Russo R C, Vinogradov G A, 1981. Ammonia toxicity to fishes. Effect of pH on the toxicity of the un-ionized ammonia specie. Environmental Science and Technology, 5(7): 837—840
Wang A L, Wang W N, Wang Y, 2003. Effect of dietary vitamin C supplementation on the oxygen consumption, ammonia-N excretion and Na+/K+ATPase ofMacrobrachium nipponensisexposed to ambient ammonia. Aquaculture, 220:833—841

