基于重组蛋白质的水凝胶
孔 娜,高晓晔,李宏斌
(加拿大不列颠哥伦比亚大学化学系,温哥华加拿大V6T1Z1)
生物组织在实现其功能的过程中依赖其自身特有的理化性质,因此在生物学和药学等领域,设计制备能够模拟这些生物性质的功能材料受到了科学界的普遍重视。例如,某些肌肉组织具有特殊的力学性能,其在较低的拉力下显得柔软而富有弹性,而当压力增大时则变得坚硬。这种特有的对作用力的响应性能够降低受到较强外力时肌肉拉伤的风险。尽管目前在生物材料等领域,研究人员已经能够设计出模拟某些软组织的材料,但目前对于能够实现此类复杂响应性的材料的研发仍是一个难题。因此,由生物分子构成的材料就体现出独特的难以取代的优势。
一个代表性的例子就是水凝胶,这是一类具有三维网状结构的交联体系,能够吸收和储存大量水溶液。构成水凝胶的材料多种多样,天然或者合成的亲水性材料经过适当的交联即可得到网络结构的水凝胶。根据交联方式的不同,水凝胶可以被分为两大类:物理凝胶或化学凝胶。化学凝胶是指通过共价键交联的凝胶,而物理凝胶是通过物理作用,例如氢键、电荷或疏水作用实现交联的凝胶。不同交联方式得到的水凝胶在理化性质等方面具有明显的差异,因此在应用前景上可以满足不同方面的要求。
组成水凝胶的材料可以分为天然材料和合成材料两大类。天然材料包括胶原、纤维蛋白等蛋白质以及海藻酸、琼脂糖等多糖。合成类材料大多是通过聚合反应得到的高分子材料,典型代表是得到广泛应用的聚丙烯酰胺水凝胶。作为对这两类材料的补充,通过基因工程方式设计合成的蛋白类材料在近些年得到迅速的发展。通过设计特定蛋白序列对应的DNA序列,并将该DNA导入宿主细胞如大肠杆菌进行表达,即可得到目标蛋白质构筑基元。目前有报道用于水凝胶合成的人工蛋白质包括亮氨酸拉链 (Leucine Zipper)、类弹性蛋白 (Elastin-like Protein,ELP)以及多模块串联蛋白(tandem modular proteins)。这类人工合成的重组蛋白质在组织工程、药物载体、生物探针及传感器等方面得到越来越深入的研究,这主要得益于两项与蛋白相关的科研新进展,其一是基于复杂蛋白质的结构和功能,科研人员能够设计多功能的重组蛋白,其二则是分子生物技术的发展使研究者能够通过控制重组DNA技术最终得到相对分子质量可控、分布均一的目标蛋白质[1]。由于篇幅的限制,我们在这篇简要的综述中主要集中讨论在重组蛋白质水凝胶的构筑与功能方面的近期发展,而以多肽和天然蛋白质为构筑基元的水凝胶则不在本研究讨论的范围,有兴趣的读者可以参考已发表的综述。
相比于天然及合成材料构成的水凝胶,重组蛋白质水凝胶具有几方面的优势。众所周知,天然材料普遍具有良好的生物相容性,因此在生物领域得到了广泛应用[2]。但同时天然材料也存在诸如提纯困难、产率低、易失活或难降解等问题,而且不同批次及不同来源的材料往往难以保证性质的一致性,导致天然材料在某些对一致性要求较高的领域的应用前景受到了限制[3]。对于合成材料而言,其组成和性质的调控相对较容易,而且可以对材料的特定性质进行针对性的设计,但合成材料的产物均一度难以精确控制,同时合成材料往往官能团单一,需要进一步官能化来实现某些功能[4]。
通过基因和蛋白工程得到的重组蛋白质不仅兼具了天然材料的生物相容性和合成材料的可控性,同时还具有某些特殊的理化特性。第一,通过重组DNA技术获得的重组蛋白其相对分子质量均一,结构明确,重复性好[1]。第二,在重组蛋白的设计过程中可以直接引入具有生物活性的短肽或片段,例如结合细胞的RGD或KNEED片段,而不需要材料合成后的进一步修饰[5]。第三,蛋白质本身的多样性能够满足不同目的对材料性质的要求,比如可降解的蛋白质可以用来作为药物载体,而具有特殊力学性能的蛋白质则是设计组织工程材料的首选蛋白[6]。
1 物理交联的水凝胶
物理交联的水凝胶近些年得到广泛的发展,其主要原因是在交联过程中不需要额外添加交联剂[7]。其中物理交联的蛋白质凝胶由于既保留了蛋白本身的特性,同时其代谢产物又无副作用,因而得到了越来越多的关注。能够交联蛋白质的物理方式有很多种,其中主要的推动力包括生物分子识别和蛋白质相变等。
1.1 卷曲螺旋(Coiled coil)
卷曲螺旋是一类在近些年在水凝胶构筑方面得到广泛应用的生物分子识别。卷曲螺旋是一类蛋白质超二级结构,构成一种蛋白质折叠的基本模式。它是由两个或多个螺旋相互结合而形成的超螺旋。其主要的特征是由7个氨基酸残基所构成的重复结构单元,重复片段被称为七肽重复区,可以用(abcdefg)n来表示[18-19][图 1a)]。在水环境中,七肽重复区中疏水性的氨基酸残基a、d、e和g在螺旋结构中形成疏水内核,而亲水性氨基酸残基b、c和f则暴露在水环境中。通过疏水作用,两个蛋白质分子形成二聚体。在七肽重复区中,残基a和d由于在螺旋中提供疏水环境并形成螺旋间的疏水作用而尤为重要。由于a或d通常为亮氨酸残基或其他非极性残基,该结构常称为为亮氨酸拉链(Leucine Zipper)结构。一般e和g为带电荷的氨基酸残基,b、c和f则为亲水性带电荷或中性的氨基酸残基。利用这种自发的分子间的物理作用,科研人员开发了多种具有响应性的可逆水凝胶,这类凝胶能够响应环境的变化比如pH值、温度或离子强度等条件的改变。

图1 a)平行双链卷曲螺旋侧面图和俯视图,卷曲螺旋由重复的七肽序列abcdefg组成。字母a和a’代表不同螺旋的相似位置。当位置a和d上的氨基酸是亮氨酸时,卷曲螺旋被称为亮氨酸拉链结构域(leucine zipper domains)。采自文献[87]。b)基于卷曲螺旋的蛋白质水凝胶的形成示意图。蓝色的螺旋代表亮氨酸拉链结构域,绿线代表亲水的间隔基团。水凝胶的形成是由亮氨酸拉链结构域的自交联所驱动的。通过调控卷曲螺旋的聚集,水凝胶的凝胶-溶胶转变可以通过环境刺激来实现。采自文献[88]。c)基于卷曲螺旋的双组分水凝胶。CCE和CCK是2个互补的亮氨酸拉链序列(绿色和蓝色)。2个串联的模块化多聚蛋白序列用来形成水凝胶,其中1个包含3个CCK(三官能,蓝色),另一个包含2个CCE(双官能,绿色)。红色的椭圆代表间隔域GB1。混合蛋白溶液使CCK和CCE相互结合成卷曲螺旋,最终交联导致凝胶形成。采自文献[13]。
Tirrell等在这一领域开展了开拓性的工作[8]。他们报道了一种基于卷曲螺旋的蛋白质物理凝胶。他们设计了一种三嵌段蛋白,其缩写为AC10A,其中A代表亮氨酸拉链结构域,C10则代表一段亲水的无规卷曲的多肽嵌段[(AG)3PEG]10。该三嵌段蛋白能够通过卷曲螺旋形成可逆的蛋白质自组装水凝胶[图1b)],但意料之外的是水凝胶在溶液中的降解速度非常快。这种现象是由多方面原因造成的,包括多嵌段蛋白形成了分子内的卷曲螺旋结构、亮氨酸拉链较低的结合能力、较快的结合周期等[9]。针对这些问题,科研人员采取了一系列的措施来降低水凝胶的降解速度。例如,可以通过在每个亮氨酸拉链的一端加入1个半胱氨酸残基的方式提高亮氨酸拉链之间的相互作用,因为在亮氨酸拉链形成二聚体时两个半胱氨酸残基的巯基能够形成二硫键,进而提高二聚体的稳定性,同时保留了物理凝胶的可逆性[10]。还有一种方法是采用另一种相似的卷曲螺旋蛋白结构域P代替亮氨酸拉链A作为三嵌段蛋白的组成部分PC10A[11],其中卷曲螺旋蛋白结构域P倾向于和另外分子中的P相作用,而不会和A作用形成卷曲螺旋。其结果是杜绝了分子内卷曲螺旋的形成。和设计相符,这种由PC10A蛋白组成的物理凝胶的降解速度比AC10A或PC10P凝胶的降解速度低100倍以上[11]。
我们课题组也开展了这方面的研究并发展了一种新的方法。我们课题组设计并表达了三嵌段蛋白AG8A[12],其中A 代表亮氨酸拉链,G8代表了由8个GB1蛋白域串联而成的蛋白嵌段,这一嵌段具有良好的稳定性,其刚性也比前文提到的无规卷曲的C10高[13]。刚性更高的中间段显著增加了分子链两端的距离,降低了两端的亮氨酸拉链域形成分子内结构的几率。相比于之前报道的AC10A凝胶,AG8A的降解速度提高了10倍。在此基础上,我们设计了含有两种多聚蛋白的混合凝胶,两个组分分别为AG4A 和 CG5CG5C[14][图 1c)]。A 和 C 代表了理性设计的两种亮氨酸拉链结构域CCE和CCK,这两种结构互补[15],只能形成杂二聚体而不能形成均二聚体,从而进一步降低了形成分子内结构的几率。这种混合凝胶的降解速度比AC10A低30倍,比AG8A低3倍。由于这种凝胶的两个组分自身不能形成凝胶,因此相比于均一组分的物理凝胶,这种混合凝胶可以制备各自的高浓度溶液之后再进行混合,降低了凝胶的制备难度,同时提高了组成物理凝胶的蛋白质浓度[15]。
经过近10年的发展,亮氨酸拉链结构域已经发展成一种应用最广泛的生物识别的方法来设计和制备蛋白质水凝胶,以及蛋白质-聚合物杂化水凝胶。利用三嵌段蛋白质的模块特性,特殊的具有环境应激响应的蛋白质序列可以很方便地引入到三嵌段蛋白质,从而制备具有环境应激响应特性的蛋白质水凝胶[8,10-11,16-18]。同时,具有特定生理功能的蛋白质功能结构域也可以方便地引入到蛋白质水凝胶,从而构筑功能性的蛋白质水凝胶。例如,具有细胞黏附功能的多肽序列及完整的蛋白质结构域的引入使蛋白质水凝胶可以作为人工模拟细胞间质来培养不同的细胞,而酶的引入则为构筑具有催化功能的蛋白质水凝胶奠定了可能。而基于这些功能化的蛋白质水凝胶在生物医学领域的应用的研究也得到了长足的进展。
1.2 蛋白-蛋白/蛋白-多肽相互作用
在Tirrell等的研究工作基础上,其他研究组也开展了利用生物识别为驱动力的蛋白质水凝胶的构筑的研究。原则上,任何蛋白质-蛋白质/蛋白质-多肽的相互作用都可以作为蛋白质水凝胶构筑的驱动力。利用不同蛋白质-蛋白质相互作用的结合常数不同,可以设计不同交联体系的组分比例、浓度以及外部条件来调控所得的水凝胶的性能。由于大部分蛋白质相互作用都是可逆而且具有环境响应性,这类物理凝胶常被用来作为负载药物或细胞的可注射凝胶材料。
Heilshorn研究组报道了基于WW蛋白域和富含脯氨酸多肽相互作用的双组分水凝胶(MITCH)[19][图 2a)]。所谓 WW 结构域得名于其序列内的色氨酸残基,这个结构域能够形成反平行的β折叠结构并与富含脯氨酸多肽结合[20]。通过将WW域或富含脯氨酸多肽与无规卷曲的亲水片段串联得到相应的多聚蛋白,之后将两组分蛋白溶液在生理条件下充分混合即可得到双组分的物理凝胶。调节蛋白序列可以控制水凝胶的机械性能,而引入细胞结合位点则能够提高负载细胞的存活率,使该水凝胶能够成为可注射的负载细胞的载体。
Regan研究组报道了一种离子响应的水凝胶,这种水凝胶通过34个氨基酸残基的四三肽重复单元(tetratricopeptide repeat)(TPR)和五肽 DESVD之间的相互作用而交联[21]。Heilshorn研究组则将TPR与其他蛋白相连,同时在四臂聚乙二醇(4-arm PEG)末端引入DESVD五肽,采用相同的交联方法制备了类似的水凝胶。由于TPR与DESVD之间的相互作用会被较高的环境离子强度干扰,通过这种方法制备的水凝胶能够响应环境离子强度的变化,在低离子强度的环境中形成凝胶,而凝胶在高离子强度的环境下则会解交联。
Topp研究组则在交联中同时利用了蛋白-多肽的相互作用以及卷曲折叠作用[22][图2b)],设计了两种三嵌段共聚蛋白,一种是将钙调蛋白片段与亮氨酸拉链通过一段亲水的蛋白连接,另一种则是通过一段疏水蛋白连接了两个钙调蛋白的结合片段,这两种蛋白溶液直接混合即能得到物理凝胶。这种凝胶的结构、响应性、强度等性能可以通过凝胶组分比例以及外部条件进行调节。
除了采用串联的嵌段结构共聚蛋白,另一种蛋白设计方法是将具有交联能力的片段与低聚蛋白结合成融合蛋白,使其能够提供多个交联位点,或者自组装成含有多个交联位点的纳米纤维。Ito研究组首先报道了由重组融合蛋白与低聚多肽组成的物理凝胶[23]。他们将含有PDZ结构域的tax interactive protein-1(TIP-1)融合到三角形的三聚CutA蛋白的3个顶点,将此蛋白溶液与含有PDZ结合蛋白的四臂聚乙二醇溶液混合即可得到物理交联的水凝胶。受此启发,结合离子交联的自组装纳米纤维的相关报道[24],Yang研究组设计了一种四聚融合蛋白,称作类泛素-TIP1蛋白 (ULD-TIP1)[25]。该蛋白能够增强 Nap-GFFYGGGWRESAI自组装的纳米纤维的相互作用从而实现交联。与其他物理交联的凝胶类似,这种凝胶同样能够通过调节组分浓度和相互作用能力改变凝胶的机械性能[26]。
1.3 弹性蛋白和类弹性蛋白(ELP)
弹性蛋白是一种广泛存在于生物组织,例如结缔组织、肺、血管、皮肤等组织内的蛋白。弹性蛋白能够在受到外力拉伸后恢复自身结构,为器官提供拉伸强度和弹性[27]。弹性蛋白的前体是弹性蛋白原,由疏水的五氨基酸重复单元缬-脯-甘-X-甘(VPGXG,其中X为疏水性氨基酸)以及含有赖氨酸的富丙氨酸结构域构成[28-30]。当温度升高至转变温度以上时,无规卷曲的弹性蛋白原发生自组装,同时富丙氨酸域内的赖氨酸发生交联,形成不可溶的网络结构,即弹性蛋白。虽然天然弹性蛋白具有优良的机械性能,并广泛存在于细胞间质中,但由于难以提纯等多方面因素的制约,天然弹性蛋白在组织工程等领域仅得到有限的应用。为此,科研人员开发了一系列的类弹性蛋白(ELP)。类弹性蛋白是一类由与弹性蛋白相似的五氨基酸重复单元VPGXG组成的合成蛋白,具有响应外界环境如温度、pH值、离子强度等变化的能力。当环境温度较低时蛋白能够形成稳定溶液,当环境温度升高至蛋白的转变温度以上时,蛋白质发生迅速的亲水-疏水转变,形成沉淀或水凝胶。这一转变是可逆的,当温度降低至转变温度以下时蛋白又能够发生疏水-亲水转变而形成蛋白质溶液。蛋白质的转变温度受到其一级结构、相对分子质量、浓度、离子强度和pH值等多方面因素的影响。
Urry等通过对PGVG多聚蛋白的研究开启了对类弹性蛋白材料的合成与研究[30-31]。这类蛋白在25℃以下时处于无规卷曲状态并具有水溶性[32]。当温度升高至25℃以上,该蛋白发生迅速的相转变,形成β螺旋结构,同时排出与蛋白结合的水分子[33](图 3)。之后的研究发展了基于VPGXG重复单元的类弹性蛋白,并基于这类蛋白设计了温度响应的物理凝胶[34]。通过改变重复单元中的第4个残基X可以调节多聚蛋白的转变温度,同时疏水的折叠和组装转变也会导致凝胶性能的改变[35],因此可以通过设计特定的基因序列得到具有特定属性的水凝胶,包括转变温度、机械性能等方面的控制都可以通过调整基因序列而实现[36]。

图3 在转换温度以上,VPGVG多倍体形成的a)β旋转和b)β-螺旋结构。采自文献[33]。
Conticello等系统地研究了基于类弹性蛋白的AB双嵌段或BAB三嵌段共聚蛋白,其中A为亲水的 [VPGVG(IPGVGVPGVG)2]19或 [VPGEG(IPGAG)4]14类弹性蛋白,B为疏水的[VPAVG(IPAVG)4]16多聚蛋白[17,37]。这类共聚蛋白在高于一定浓度的水溶液中随温度升高会可逆地自组装为纳米颗粒或水凝胶,在这一过程中蛋白质从可溶的伸展态转变为折叠态。
Capello等设计合成了丝蛋白-弹性蛋白-丝蛋白的三嵌段共聚蛋白[38-39],其中由GAGAGS重复单元组成的类丝蛋白能够通过氢键作用形成β折叠结晶结构从而提高蛋白稳定性,而同时由GVGVP重复单元组成的类弹性蛋白会干扰类丝蛋白的结晶度,提高蛋白的柔性和水溶性。科研人员研究并报道了这种共聚蛋白的溶胀性和负载能力[38-39]。通过基因工程引入带电荷的氨基酸残基能够提高水凝胶的pH值和温度响应能力[40-41]。
2 化学水凝胶
除了物理交联的水凝胶,化学交联是另一种重要的交联方法。相比物理交联水凝胶,由于化学交联是通过共价键进行交联,形成的水凝胶网络结构往往更加稳定。目前,已有多种交联方法被用于化学水凝胶的合成。对于蛋白水凝胶,化学反应通常发生在氨基酸残基的侧链上。在20种常见氨基酸中,一些氨基酸含有具有反应活性的侧链基团,可以作为交联位点形成水凝胶网络。以下列举几种最近发展的交联方法。
2.1 酪氨酸(tyrosin)交联
在生物材料的合成中经常利用酪氨酸侧链上的活性苯酚基团。在重组蛋白交联中,酪氨酸的交联可以通过过氧化酶的催化(如,辣根过氧化酶(horseradish peroxidase,HRP)或光化学反应(如钌离子Ru2+引发)等多种方式。
2.1.1在钌离子和过硫酸铵存在下的光化学交联
在钌离子Ru2+存在下所引发的基于酪氨酸的光化学交联反应最早是用来研究蛋白质-蛋白质相互作用。反应过程中,在可见光的照射下2价钌离子配合物发生光解,产生的3价钌离子活性金属配合物会夺走酪氨酸的1个电子并生成酪氨酸自由基,随后攻击其他临近的酪氨酸残基。在此过程中过硫酸盐作为电子受体接受光激发后2价钌离子配合物释放的电子。两个相邻的酪氨酰自由基通过共价交联自发形成二酪氨酸[42]。Elvin等最早认识到这一反应在蛋白质基生物材料构筑领域的价值,并成功地将这一方法发展成一种高效的制备蛋白质水凝胶的化学交联方法[43]。
利用这一方法所产生的交联多发生在多酪氨酸蛋白/肽链上,且这些酪氨酸需暴露在环境中。Elvin等成功地制备了基于重组节肢弹性蛋白(Resilin)的具有高弹性的橡胶状弹性水凝胶。节肢弹性蛋白(Resilin)是一种细胞外骨架蛋白,在许多昆虫的跳跃、飞行以及发声等方面起着重要的作用,是一种卓越的弹性材料[44]。Elvin等研究人员通过基因工程和克隆技术得到了第一个重组的原节肢弹性蛋白(pro-resilin)。它是一种未交联的可溶节肢弹性蛋白,由 Elvin等于 2005年报道,被命名为 rec1-resilin[43]。具有无规线团构象的rec1-resilin由18个重复的单元组成,每个单元由15个氨基酸残基组成,其序列为GGRPSDSYGAPGGGN,每个单元包含1个裸露的酪氨酸残基。酪氨酸残基通过钌离子/过硫酸铵催化,在600 W卤钨灯下光交联成二酪氨酸,最终生成弹性高达97%的橡胶状弹性水凝胶[图4a)~图4b)]。与高分子合成橡胶相比,这种材料具有更高的弹性和更长的抗疲劳时间[43]。这一开拓性的工作为这种方法成为一种通用的高效交联方法奠定了坚实的基础。目前这一方法已广泛适用于合成包含1个或多个暴露的酪氨酸的蛋白质生物材料[45-50]。

图4 a)双酪氨酸加合物的结构及光交联反应。b)通过光交联反应所形成的rec1-resilin水凝胶(左图:白光下;右图:紫外光下)。蓝色萤光来自于光交联所形成的双酪氨酸加合物[44]。图4a)~图4b)改编自文献[43]。c)B1-resilin组成的蛋白水凝胶的网络示意及照片。下图:白光下;上图:紫外光照射下[49]。改编自文献[49]。
我们小组采用这种行之有效的钌离子引发的光化学交联反应来设计一种基于GB1-resilin的蛋白质水凝胶[图 4c)],并用它模拟肌肉[49]力学性能。球状蛋白GB1是一种力学稳定的结构域,而随机螺旋状的节肢弹性蛋白可提供酪氨酸残基用于交联成胶。在人工合成的多蛋白链(G-R)4和GRG5RG4R中,GB1(G)模仿肌联蛋白中折叠的免疫球蛋白结构域,节肢弹性蛋白(R)模仿肌联蛋白非结构化序列(如肌联蛋白中的N2B序列),这两个结构域是控制肌肉的被动弹性的两个重要力学元素。在单分子水平上,多蛋白链可以模仿肌联蛋白的结构和力学性能;在高分子材料水平上,水凝胶可以模仿肌联蛋白调节的肌肉被动弹性性能。也就是说,通过在单分子水平上的精心设计,可以使蛋白胶在宏观上获得所需的力学性能。按照这个思路,我们又设计了串联的多模块FnIII-resilin构成的多蛋白水凝胶,用来模仿细胞外基质中天然的串联的模块化的蛋白质的功能和行为[50]。另一个有趣的研究是类铁氧还蛋白(FL)与节肢弹性蛋白组成的水凝胶[51]。由于类铁氧化还原蛋白的水溶性和力学不稳定性,水凝胶吸水溶胀导致类铁氧化还原蛋白的解折叠和聚集,这些行为与交联的网络交织在一起,赋予了这一水凝胶不同寻常的物理和力学性能,如负膨胀率、高伸缩性和韧性等。
2.1.2辣根过氧化酶(HRP)与过氧化氢
除了光交联,辣根过氧化酶(HRP)与过氧化氢(H2O2)是另一种通过酪氨酰自由基反应产生二酪氨酸形成蛋白质水凝胶的交联方法[52]。辣根过氧化酶是一种单链β型血红素蛋白,可以催化苯酚或苯胺类衍生物在过氧化氢中的结合[53]。在这一反应中,辣根过氧化酶先结合过氧化氢,形成的络合物可以氧化羟苯基。HRP是在凝胶交联中最常用的过氧化酶,主要集中应用于聚合物的水凝胶交联上。Qin等最近报道了类橡胶的生物材料,他们采用一种提取自果蝇节肢弹性蛋白的1和3外显子的蛋白,通过辣根过氧化酶调节的交联反应生成水凝胶[54]。交联蛋白通过凝胶电泳、傅里叶变换红外光谱(FTIR)、圆二色谱(CD)和原子力显微镜(AFM)等方法进行检测。交联在几分钟之内完成,且不需要其他方法的辅助。
2.2 通过赖氨酸(lysine)交联
β-[三(羟甲基)膦基]丙酸(THPP)是合成多肽类生物材料的三官能交联剂。THPP中的羟甲基与赖氨酸中的伯胺在生理条件下发生曼氏反应。Chilkoti和Heilshorn科研组报道的类弹性蛋白多肽(ELP)可迅速通过赖氨酸与THPP的反应在水溶液中形成水凝胶[77-78]。ELP交联的水凝胶的力学性能主要是由赖氨酸的浓度调节。据报道,成纤维细胞[55]、软骨细胞[56]和人胚状体[57]都可成功嵌入THPP交联的水凝胶中,表明水凝胶具有很好的细胞相容性。此外,Kiick组报道,类节肢弹性蛋白多肽(RLP)可通过与THPP反应交联形成水凝胶[58](图5a-c)。他们合成的水凝胶具有可调的力学性能、细胞的黏附性能和变形性能。
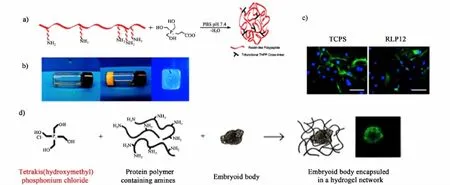
图5 a)节肢弹性蛋白多蛋白链通过与THPP反应凝胶的示意图。b)水凝胶的图像。水凝胶是由赖氨酸残基与THPP反应交联而成[58]。c)NIH-3T3细胞在聚苯乙烯细胞培养皿上的荧光显微镜照片(左)和在RLP12水凝胶为培养基质上的荧光显微镜照片(右),标尺为100 μm[63]。图5a)~图5c)改编自文献[58]。d)类弹性蛋白多蛋白链通过与THPC反应形成凝胶和包埋小鼠胚体的示意图。水凝胶是由赖氨酸残基与THPC反应交联而成。采自文献[59]。
由于化学合成过程过于复杂,尽管THPP是一个功能强大的交联剂,但目前已停止生产和销售。作为THPP的一种代替品,Heilshorn等研究了四(羟甲基)氯化鏻(THPC)。THPC是1个四官能团的交联剂,具有与THPP类似的化学结构,常用于阻燃材料。它可以在水溶液中快速生成,并与伯胺或仲胺发生曼氏反应。实验证明通过THPC反应交联形成的ELP水凝胶具有很好的细胞相容性[59](图5d)。因此,THPC作为一种廉价的可溶的交联剂常用于交联反应中代替THPP。
2.3 通过半胱氨酸残基交联
以半胱氨酸残基为交联位点的交联方式主要有两种。其一是在氧化态下将半胱氨酸残基侧链的巯基氧化为二硫键实现分子间的交联。有报道将ELP与含半胱氨酸残基的多聚蛋白连接之后所得的蛋白质能够在温和条件下通过巯基被氧化成二硫键的方式形成可逆的水凝胶[60]。另一种方式是通过“点击”反应中的巯基-烯反应实现交联,将半胱氨酸侧链的巯基与含有双键的大分子交联成水凝胶。这是一种常用的蛋白质-聚合物共混水凝胶的合成方式[61-63]。在早期的研究中,Hubbell研究组以端烯基的大分子聚乙二醇为交联剂交联含半胱氨酸残基的重组蛋白得到了蛋白质-聚合物杂化水凝胶[64-65]。Murphy研究组则通过将钙调蛋白(CaM)上的2个氨基酸残基突变为半胱氨酸残基,之后与双端烯基的聚乙二醇反应并紫外照射的方式制得水凝胶[66]。CaM在有无配体的状态下具有两种不同的构象,因此配体的存在与否会直接改变水凝胶中CaM的构象,进而改变水凝胶的性质[67]。Kiick研究组之后报道了一种基于类节肢弹性蛋白(resilin-like protein,RLP)的通过巯基-烯反应得到的水凝胶[68]。通过巯基-烯的反应,含有半胱氨酸残基的大分子RLP被端烯基的四臂聚乙二醇交联得到弹性水凝胶,并通过对人成纤维细胞的培养实验证明了水凝胶具有良好的生物相容性。
虽然巯基-烯反应具有很多优势并被广泛研究,但由于天然蛋白中基本不存在双键基团,因此这种方法很少被用来制备纯蛋白基凝胶,而如上文所述常被用来制备杂化凝胶。
2.4 通过其他氨基酸残基的交联方式
蛋白/蛋白或蛋白/多肽的物理作用的热力学和力学稳定性普遍较低[69],但最近科研人员发现并研究了一个具有极高稳定性的蛋白[70]。这种被称作类免疫球蛋白胶原附着域2(CnaB2)的蛋白,通过1个分子内的酰胺键为蛋白提供了极为稳定的结构。研究人员进一步将该蛋白一分为二,一部分为含有13个氨基酸残基的多肽(Spytag),另一部分为138氨基酸残基的蛋白质片段(Spycatcher),发现两部分能够自发地组成一个完整的结构域,其中Spytag中的天冬氨酸-117与Spycatcher内的赖氨酸-31能够形成分子间的酰胺键[71][图6a)和图6b)]。这个共价键的形成只需几分钟,而且反应活性很高,因此Spycatcher和Spytag之间的特异性反应为设计蛋白凝胶提供了可行性。最近,Tirrell组就报道了一组基于该反应的重组蛋白凝胶体系。他们设计并表达了多嵌段的Spytag-ELP多聚蛋白(AAA)和Spycatcher-ELP多聚蛋白(BB),并将两种蛋白的溶液混合得到了化学交联的水凝胶[72][图6c)]。引入能结合细胞的基团的水凝胶具有良好的细胞相容性,能够作为细胞载体使用[图6d)]。到目前为止,Spycatcher-Spytag反应体系是唯一的,还没有研究人员报道类似的形成共价键的蛋白-蛋白或蛋白-多肽反应,或许将来能够发现更多的相似体系。
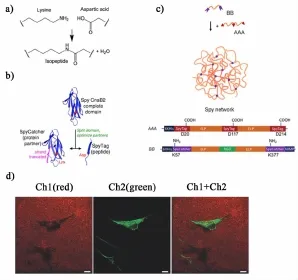
图6 a)赖氨酸与天冬氨酸侧链之间形成异构肽键。b)SpyTag和SpyCatcher的示意图。活性残基标为红色[72]。c)通过混合含3个SpyTag的蛋白链(AAA)和含2个SpyCatcher的蛋白链(BB),共价交联产生的水凝胶示意图。d)包埋在mCherry-Spy水凝胶中的3T3成纤细胞的荧光共聚焦显微镜图像。通道1是mCherry的荧光图像,细胞所在的位置为黑色阴影区域;通道2显示的是2个铺展的成纤细胞(绿色);通道1和通道2是2个通道的叠加。标尺为10 μm。改编自文献[72]。
3 重组蛋白水动态水凝胶
过去,水凝胶只被当成“白板”,需后期在其表面修饰添加所需功能基团。这样的水凝胶通常具有固定的结构与性能。尽管这样的水凝胶能模拟生物体系某一特定的方面,但还不能模拟生物体系高度动态的特性。为更好地模拟生物体系的动态特性,发展动态水凝胶体系是生物材料领域一个重要的研究课题,它的发展有可能为模拟生物结构和仿生组织工程学开拓新的道路。
目前,动态水凝胶分为两大类:动态整体结构降解水凝胶和动态性能水凝胶。顾名思义,动态整体结构降解水凝胶的整体结构可以降解,发生由凝胶态到液态的相转变(gel-sol transition)。相转变可通过破坏水凝胶的组成蛋白链或通过外在刺激破坏蛋白链之间的交联点,如通过改变温度[73]、酸碱性[8]、离子浓度[22]等实现[图 7a)]。光解水凝胶是其中典型的例子,当光感基团合成于水凝胶链上时,光能够引发这些基团间的反应断裂,最终导致整个水凝胶的降解。在蛋白水凝胶中,物理交联的水凝胶通常具有整体结构降解的性质,因为物理交联的水凝胶是通过氨基酸间非共价相互作用交联,系统中任何改变一旦足够强大到可以减弱或抑制这些相互作用时,就会导致水凝胶的整体降解。有些破坏不是永久性的,当这些刺激元素消除时降解的水凝胶可以恢复到初始态。例如,弹性蛋白(elastin)组成的蛋白水凝胶对酸碱性和温度都非常敏感[73],系统的设计水凝胶的组成结构将非常有助于控制其对酸碱性和温度的敏感强度,从而使其符合在药物运输和生物组织模拟等实际应用中的材料要求。

图7 a)由外部刺激引起的水凝胶整体结构动态降解示意图。降解过程可以是可逆或不可逆的。b)由外部刺激引起的水凝胶动态性能改变及响应示意图,改变过程中整体网络稳定不被破坏,水凝胶不发生降解或相变。在水凝胶网络活性成分会对外界刺激产生反应,从而影响水凝胶的性质。
第二种动态水凝胶,即动态性能水凝胶,拥有稳定的整体结构,但其特定性能是动态可调控的(图7b)。许多科研工作着重于这类水凝胶的动态物理性质,尤其是动态体积变化,因为体积变化观察直接且测量简单。钙调蛋白(calmodulin)是一种广泛共知的蛋白,其在与配体结合时,会发生明显的构象变化。当它存在于水凝胶的蛋白链中时,配体的加入将驱使它由伸展的结构变成收缩的结构,同时导致水凝胶的收缩[57,67]。而且,收缩程度与calmodulin的浓度成正比,当calmodulin数量增多时,文献表明水凝胶体积可收缩到原来的1/5[66,74]。
体积变化的测量对于动态水凝胶的研究是非常有价值的,但同时还有很多其他重要性质的动态变化也在复杂多变的水凝胶结构中得到关注,力学性质便是其中之一。力学性质可以反应材料的硬度、强度和整体结构。目前,对于动态力学性质的研究是非常有限的,主要因为设计复杂、选择有限和维持蛋白生物功能的困难等方面。
杨氏模量(E)是用于描述材料力学性能的一个物理量。在材料的弹性形变范围内,应力(σ)与应变(ε)成正比,其比例系数称为杨氏模量:

应力-应变的关系可以用橡胶弹性的经典统计理论进行分析:
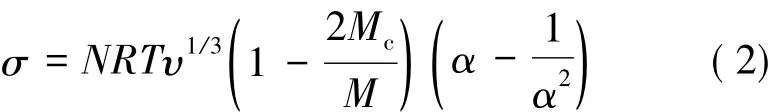
式(2)中,N是交联密度;R是气体常数;T是绝对温度;υ是在膨胀样品中橡胶的体积分数;Mc是交联点间的分子质量;M是分子质量;α是伸展率。
由于N=ρ/Mc(ρ是密度),而且Mc∝LEC,可推算得出杨氏模量与交联密度(N)成正比,与交联点间的有效链长(LEC)成反比。
目前,用于动态控制水凝胶力学性质的方法主要有两种。第一种是控制水凝胶的交联密度,即用外界刺激控制改变原有水凝胶交联点的数量,如利用光、氧化还原、金属离子等。这些改变有些是可逆的有些是不可逆的,交联点的数量也可能增加或减少。通常来说,通过光感基团产生的改变是不可逆的,相反,通过蛋白间相互作用产生的改变大多是可逆的。通过控制水凝胶的交联密度,科研人员已经成功地发展了制备动态聚合物水凝胶。第二种方法是控制交联点间的有效链长(LEC)。与控制交联密度的方法不同,交联点的数量不会被改变,但交联点间的空间距离将通过外界刺激被增大或减小。这意味着交联点间的有效链长将会延长或缩短。实际上,控制交联点间的有效链长是控制交联密度的一种特殊形式,尽管它没有影响交联点的整体数量,但是密集或松散的空间网链仍然与交联密度有关。我们研究组利用这一原理发展了制备蛋白质动态水凝胶的方法。
在大量的蛋白质家族中,许多已知的球状蛋白质可以通过与配体结合产生构象变化而引起蛋白质长度的变化,如前面提到的calmodulin,还有adenylate kinase[66,74-75],它们的构象变化可以引起 蛋白质的氮端和碳端距离改变达2 nm。尽管这样的构象改变在分子层面已经是比较大的变化,但所引起的蛋白质长度的变化并不足以使水凝胶的力学性能上产生显著差异。另一种控制蛋白质的构象变化来引起蛋白质长度的变化的方式是通过控制其折叠状态。相比折叠状态,蛋白质解折叠可使蛋白质氮端和碳端距离增加到序列全长,例如包含56个氨基酸残基的蛋白GB1可以通过解折叠增加其有效长度达18 nm。在蛋白质水凝胶中通过蛋白质解折叠构象变化可以达到调控杨氏模量的结果,但化学变性剂诱导的蛋白质解折叠不具有生物相容性,并不能应用到实际的生物应用中[49]。最近,我们研究组通过一种设计的蛋白质折叠开关——互斥蛋白(MEP)来达到控制蛋白质折叠状态并进而构筑动态蛋白质水凝胶。
互斥蛋白是一种特别的人工设计的插入型融合蛋白[76],它由一个主体结构域和一个客体结构域组成。客体结构域的N—C末端距离较长,但被嵌入了主体结构域中一个短的表面环结构。由于主体结构域和客体结构域的结构上的不相容,互斥蛋白中的主体结构域和客体结构域只能有一个蛋白结构域能折叠成其天然的三级结构,而另外一个则处于无规线团构象[76]。
我们设计了互斥蛋白GL5-I27,其中GL5作为主域而I27作为客域插入到GL5的第二个表面环上[76]。由于I27有相对较高的热力学稳定性,互斥蛋白主要存在于GL5(U)-I27(F)构象,表示GL5展开而I27折叠。为进一步控制互斥蛋白的平衡构象,我们将主域的第41和43个氨基酸突变为半胱氨酸,从而形成互斥蛋白GL5CC-I27。我们报道了GL5CC-I27可作为一个对氧化还原敏感的蛋白质折叠开关[77]。在氧化状态下,Cys41和cys43可以形成二硫键,稳定GL5的折叠,迫使GL5CC-I27停留在GL5CC(F)-I27(U)构象。在被还原后,二硫键断开,GL5CC-I27形成GL5CC(U)-I27(F)的构象,主域的解折叠有效增加互斥蛋白的长度达26 nm之多(图8a)。对GL5CC-I27折叠及构象的深入理解启发我们将它应用于蛋白基水凝胶的设计。据此,GL5CC-I27开始被用作构建元素生成蛋白凝胶。通过对氧化还原的动态控制,调整GL5CC-I27的构象,使我们能够充分地控制主域GL5在水凝胶蛋白质网络中的有效长度,从而改变水凝胶的交联点间有效长度和力学性能[图8b)和图8c)]:在氧化态,该水凝胶的杨氏模量达到60 kPa,而在还原态,杨氏模量则下降到20 kPa[78]。而这些力学性质的动态变化是完全可逆的,这是目前所报道的动态水凝胶的一个特例。这一研究显示出构筑动态蛋白质水凝胶的前景,而这一方法则代表了一种崭新的研究思路,为进一步设计动态蛋白质水凝胶奠定了基础。
4 蛋白质水凝胶在组织工程学和细胞外基质中细胞培养和繁殖的应用
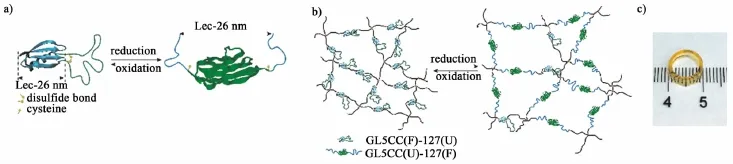
图8 用于构建动态蛋白水凝胶的互斥蛋白的折叠开关。a)在氧化和还原态下,互斥蛋GL5CC-I27的示意图。其平衡构象可以通过氧化或还原剂控制。主域GL5CC标为蓝绿色,客域I27标为绿色。b)由GL5CC-I27构成的蛋白水凝胶的三维网络在氧化和还原态的示意图。c)一个透明圈状的水凝胶样品的照片。图8c)中标尺单位是厘米。采自文献[78]。
蛋白质水凝胶不仅保留其蛋白组分的生物相容性,也从水凝胶网络结构中获得独特的功能,如力学和结构特性,使它可以模拟许多天然组织。由于拥有这些独特的性能,许多蛋白水凝胶已被开发用于组织工程学中,作为支持细胞存活的生物材料。组织工程学中水凝胶常被设计来模仿天然细胞外基质的组成[79]。在活体组织中,细胞外基质可以帮助调节细胞在特定的分子信号下的动态,如细胞的增殖、分化和迁移。细胞外基质大分子成分的分布与变化可以导致其组织的不同的组成及功能的多样性[80]。对于细胞外基质的分析已经确定了各种负责不同功能的活性大分子序列。这些已知的活性序列可以添加在仿生水凝胶的设计中。其中一个最著名的与细胞黏附的蛋白序列是RGD三肽-精氨酸甘氨酸天冬氨酸。RGD是常见的细胞黏附蛋白结构域,广泛存在于细胞外基质和血液的多种天然蛋白质中(如纤连蛋白fibronectin,玻连蛋白vitronectin,骨桥蛋白 osteopontin,胶原蛋白 collagens)[81]。它可以被超过20种的整合蛋白识别,并促进细胞的黏附、扩散和生长。因此,科学家们已经将RGD加到水凝胶的组成链或连接在水凝胶表面,以用于细胞的黏附、扩散和扩增[82]。鉴于不同水凝胶的设计所需,RGD序列可以直接纳入或由天然含 RGD 的蛋白质加入水凝胶蛋白链[50,72,83]。Tenascin-C是一种多模块串联细胞外基质蛋白,在维持细胞与基质的相互结合中起重要作用。Tenascin-C第三纤连蛋白III型结构域(TNfn3)是一种含RGD的结构域。我们的研究结果表明,含TNfn3和节肢弹性蛋白(resilin)的多蛋白链可光交联成杨氏模量约为20 kPa的弹性水凝胶[50]。人肺成纤维细胞可以成功地在TNfn3水凝胶表面扩散和传播。
除了二维表面细胞培养,许多研究都强调三维细胞嵌入的重要性,这是因为三维培养基质能够更准确地模拟天然细胞外基质,更重要的是细胞更适应三维的培养环境。用于3D细胞嵌入的材料必须具备许多关键的力学性能,如合适的硬度和细胞黏附能力。研究证实,精确地调整这些属性会影响细胞的行为,包括形态、迁移、分化,与邻近细胞作用和细胞内信号传递[84-85]。如前文所述,由SpyCatcher和SpyTag构成的化学水凝胶可成功地用于三维细胞嵌入[图6d)]。由于BB蛋白链含RGD和MMP-1序列,该spy系统可支持细胞存活、传播和细胞质重塑[72]。此外,又如之前提及的 MITCH系统,它涉及WW结构域和富含脯氨酸的肽链之间的物理相互作用,这一系统也被测试了其对于嵌入多种细胞的能力和黏弹力可控性[19]。最新的结果表明,MITCH系统可以帮助提高在活体实验中植入干细胞的存留[86]。这一系统中,快速的物理交联所形成的交联网络使得水凝胶在注射时在适当平行力下分解并在作用力停止后实现重组[86]。这些特点使水凝胶成为一种理想的注射细胞的载体。基于不同的物理或化学交联的设计,重组蛋白水凝胶可成为合适的材料提供所需性质和功能。
5 结论与展望
经过近20年的发展,基于重组蛋白质的水凝胶取得了长足的进展,科研工作者已经制备出了许多具有创新性的蛋白质水凝胶体系以满足从基本的生物学研究,组织工程到药物缓释等不同领域应用的需求。通过蛋白质工程和设计,蛋白质水凝胶的特性可以通过理性设计以达成实际应用所需要的特性,比如机械特性和降解性能。我们预测这一领域将会继续保持快速的发展,研发的新型的蛋白质水凝胶将会使新的应用变为可能。展望未来,我们认为发展新型的生物相容的物理交联和化学交联方法依然是这一领域的重要使命。以基于生物识别为基础的物理交联的蛋白质水凝胶为例,科研工作者目前所选用的生物识别的体系仅仅只是生命体系中所存在的生物识别中的冰山之一角。许多在生物体系中普遍存在的生物识别体系尚未被用来构筑蛋白质水凝胶。其中一个例子就是蛋白质片段重构(protein fragment reconstitution)。我们可以预期科研人员将会探索和发展新型高效的生物识别来构筑具有特定的物理化学性质和功能的蛋白质水凝胶,并通过调控生物识别的相互作用的强度来调控水凝胶的性质。而在化学交联的蛋白质水凝胶方面,类似的挑战同样存在,尤其是发展生物相容的化学交联方法至关重要。降低并消除化学交联剂的毒性是拓展蛋白质水凝胶在生物医学领域应用的前提,基于这一考虑,发展 Spycatcher+Spytag一类的化学交联方法就显得尤其具有吸引力,我们预测这一方向将成为蛋白质水凝胶领域的一个前沿,将为蛋白质水凝胶在生物医学和组织工程领域的真正应用奠定坚实的基础。可以预见,蛋白质水凝胶领域将会有一个更加美好的将来。致谢:
这一研究工作得到了加拿大健康研究院的资助。
参考文献:
[1]Chow D,Nunalee M L,Lim D W,et al.Peptide-Based biopolymers in biomedicine and biotechnology[J].Materials Science& Engineering R-Reports,2008,62:125-155
[2]Langer R,Tirrell D A.Designing materials for biology and medicine[J].Nature,2004,428:487-492
[3]DiMarco R L,Heilshorn S C.Multifunctional materials through modular protein engineering[J].Advanced Materials,2012,24:3 923-3 940
[4]Lutolf M P,Hubbell J A.Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering[J].Nature Biotechnology,2005,23:47-55
[5]Wong J Y,Weng Z P,Moll S,et al.Identification and validation of a novel cell-recognition site(KNEED)on the 8th type III domain of fibronectin[J].Biomaterials,2002,23:3 865-3 870
[6]Biondi M,Ungaro F,Quaglia F,et al.Controlled drug delivery in tissue engineering[J].Advanced Drug Delivery Reviews,2008,60:229-242
[7]Hennink W E,van Nostrum C F.Novel crosslinking methods todesignhydrogels[J].AdvancedDrug Delivery Reviews,2002,54:13-36
[8]Petka W A,Harden J L,McGrath K P,et al.Reversible hydrogels from self-assembling artificial proteins[J].Science,1998,281:389-392
[9]ShenW.Structure, dynamics, andpropertiesof artificial protein hydrogels assembled through coiled-coil domains[D].California Institute of Technology,2005
[10]Shen W,Lammertink R G H,Sakata J K,et al.Assembly of an artificial protein hydrogel through leucine zipper aggregation and disulfide bond formation[J].Macromolecules,2005,38:3 909-3 916
[11]Shen W,Zhang K C,Kornfield J A,et al.Tuning the erosion rate of artificial protein hydrogels through control of network topology[J].Nature Materials,2006,5:153-158
[12]Cao Y,Li H B.Engineering tandem modular protein based reversible hydrogels[J].Chemical Communications,2008,36:4 144-4 146
[13]Cao Y,Li H B.Polyprotein of GB1 is an ideal artificial elastomeric protein[J].Nature Materials,2007,6:109-114
[14]Lv S,Cao Y,Li H B.Tandem modular protein-based hydrogels constructed using a novel two-component approach[J].Langmuir,2012,28:2 269-2 274
[15]Yang J Y,Xu C Y,Wang C,et al.Refolding hydrogels self-assembledfromN-(2-hydroxypropyl)-methacrylamide graft copolymers by antiparallel coiledcoil formation[J].Biomacromolecules,2006,7:1 187-1 195
[16]Stevens M M,Allen S,Davies M C,et al.Molecular level investigations of the inter-and intramolecular interactions of pH-responsive artificial triblock proteins[J].Biomacromolecules,2005,6:1 266-1 271
[17]Wright E R,Conticello V P.Self-Assembly of block copolymers derived from elastin-mimetic polypeptide sequences[J].Advanced Drug Delivery Reviews,2002,54:1 057-1 073
[18]Banta S,Wheeldon I R,Blenner M.Protein engineering in the development of functional hydrogels[M].In Annual Review of Biomedical Engineering,Vol 12,Yarmush M L,Duncan J S,Gray M L,Eds.Annual Reviews:Palo Alto,2010
[19]Foo C, Lee J S, Mulyasasmita W, et al.Two-Component protein-engineered physical hydrogels for cell encapsulation[J].Proceedings of the National A-cademy of Sciences of the United States of America,2009,106:22 067-22 072
[20]Macias M J,Gervais V,Civera C,et al.Structural analysis of WW domains and design of a WW prototype[J].Nature Structural Biology,2000,7:375-379
[21]Grove T Z,Osuji C O,Forster J D,et al.Stimuli-Responsive smart gels realized via modular protein design[J].Journal of the American Chemical Society,2010,132:14 024-14 026
[22]Topp S,Prasad V,Cianci G C,et al.A genetic toolbox for creating reversible Ca2+-sensitive materials[J].Journal of the American Chemical Society,2006,128:13 994-13 995
[23]Ito F,Usui K,Kawahara D,et al.Reversible hydrogel formation driven by protein-peptide-specific interaction and chondrocyte entrapment[J].Biomaterials,2010,31:58-66
[24]Micklitsch C M,Knerr P J,Branco M C,et al.Zinc-Triggered hydrogelation of a self-assembling beta-hairpin peptide[J].Angewandte Chemie-International Edition,2011,50:1 577-1 579
[25]Zhang X,Chu X,Wang L,et al.Rational design of a tetrameric protein to enhance interactions between selfassembled fibers gives molecular hydrogels[J].Angewandte Chemie-International Edition,2012,51:4 388-4 392
[26]Wang H,Shi Y,Wang L,et al.Recombinant proteins as cross-linkers for hydrogelations[J].Chemical Society Reviews,2013,42:891-901
[27]Indik Z,Yeh H,Ornsteingoldstein N,et al.Alternative splicing of human elastin messenger-RNA indicated by sequence-analysisofclonedgenomicand complementary-DNA[J].Proceedings of the National A-cademy of Sciences of the United States of America,1987,84:5 680-5 684
[28]Urry D W.Entropic elastic processes in protein mechanisms.2.Simple(passive)and coupled(active)development ofelasticforces[J].JournalofProtein Chemistry,1988,7:81-114
[29]Vrhovski B,Weiss A S.Biochemistry of tropoelastin[J].European Journal of Biochemistry,1998,258:1-18
[30]Urry D W,Seitz M,Gaub H E,et al.Elastin:A representative ideal protein elastomer[J].Philosophical Transactions of the Royal Society of London Series B-Biological Sciences,2002,357:169-184
[31]McPherson D T,Morrow C,Minehan D S,et al.Production and purification of a recombinant elastomeric polypeptide,g-(vpgvg)19-vpgv,from escherichia-coli[J].Biotechnology Progress,1992,8:347-352
[32]Urry D W.Physical chemistry of biological free energy transduction as demonstrated by elastic protein-based polymers[J].Journal of Physical Chemistry B,1997,101:11 007-11 028
[33]Urry D W.Free-Energy transduction in polypeptides and proteins based on inverse temperature transitions[J].Progress in Biophysics& Molecular Biology,1992,57:23-57
[34]Urry D W,Gowda D C,Parker T M,et al.Hydrophobicity scale for proteins based on inverse temperature transitions[J].Biopolymers,1992,32:1 243-1 250
[35]Lee J,Macosko C W,Urry D W.Mechanical properties of cross-linked synthetic elastomeric polypentapeptides[J].Macromolecules,2001,34:5 968-5 974
[36]Trabbic-Carlson K,Setton L A,Chilkoti A.Swelling and mechanical behaviors of chemically cross-linked hydrogels of elastin-like polypeptides[J].Biomacromolecules,2003,4:572-580
[37]Lee T A T,Cooper A,Apkarian R P,et al.Thermo-Reversible self-assembly of nanoparticles derived from elastin-mimetic polypeptides[J].Advanced Materials,2000,12(15):1 105-1 110
[38]Dinerman A A,Cappello J,Ghandehari H,et al.Solute diffusioningeneticallyengineeredsilk-elastinlike protein polymer hydrogels[J].Journal of Controlled Release,2002,82:277-287
[39]Dinerman A A,Cappello J,Ghandehari H,et al.Swelling behavior of a genetically engineered silk-elastinlike protein polymer hydrogel[J].Biomaterials,2002,23:4 203-4 210
[40]Nagarsekar A,Crissman J,Crissman M,et al.Genetic synthesis and characterization of pH-and temperaturesensitive silk-elastinlike protein block copolymers[J].Journal of Biomedical Materials Research,2002,62:195-203
[41]Nagarsekar A,Crissman J,Crissman M,et al.Genetic engineering of stimuli-sensitive silkelastin-like protein block copolymers[J].Biomacromolecules,2003,4:602-607
[42]Fancy D A,Kodadek T.Chemistry for the analysis of protein-protein interactions:Rapid and efficient crosslinkingtriggeredbylongwavelengthlight[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96:6 020-6 024
[43]Elvin C M,Carr A G,Huson M G,et al.Synthesis and properties of crosslinked recombinant pro-resilin[J].Nature,2005,437:999-1 002
[44]Balu R, Whittaker J, Dutta N K, et al.Multi-Responsive biomaterials and nanobioconjugates from resilin-like protein polymers[J].Journal of Materials Chemistry B,2014,2:5 936-5 947
[45]Vashi A V,Werkmeister J A,Vuocolo T,et al.Stabilization of collagen tissues by photocrosslinking[J].Journal of Biomedical Materials Research Part A,2012,100A:2 239-2 243
[46]Elvin C M,Brownlee A G,Huson M G,et al.The developmentofphotochemicallycrosslinkednative fibrinogen as a rapidly formed and mechanically strong surgical tissue sealant[J].Biomaterials,2009,30:2 059-2 065
[47]Elvin C M,Danon S J,Brownlee A G,et al.Evaluation of photo-crosslinked fibrinogen as a rapid and strong tissue adhesive[J].Journal of Biomedical Materials Research Part A,2010,93A:687-695
[48]Elvin C M,Vuocolo T,Brownlee A G,et al.A highly elastic tissue sealant based on photopolymerised gelatin[J].Biomaterials,2010,31:8 323-8 331
[49]Lv S,Dudek D M,Cao Y,et al.Designed biomaterials to mimic the mechanical properties of muscles[J].Nature,2010,465:69-73
[50]Lv S S,Bu T J,Kayser J,et al.Towards constructing extracellular matrix-mimetic hydrogels:An elastic hydrogel constructed from tandem modular proteins containing tenascin FnIII domains[J].Acta Biomaterialia,2013,9:6 481-6 491
[51]Fang J,Mehlich A,Koga N,et al.Forced protein unfolding leadstohighlyelasticandtoughprotein hydrogels[J].Nature Communications,2013,4:2 974-2 983
[52]Bailey A J.The chemistry of natural enzyme-induced cross-links of proteins[J].Amino Acids(Vienna),1991,1:293-306
[53]Teixeira L S M,Feijen J,van Blitterswijk C A,et al.Enzyme-Catalyzed crosslinkable hydrogels:Emerging strategies for tissue engineering[J].Biomaterials,2012,33:1 281-1 290
[54]Qin G,Rivkin A,Lapidot S,et al.Recombinant exonencoded resilins for elastomeric biomaterials[J].Biomaterials,2011,32:9 231-9 243
[55]Lim D W,Nettles D L,Setton L A,et al.In situ crosslinkinig of elastin-like polypeptide block copolymers for tissuerepair[J].Biomacromolecules, 2008, 9:222-230
[56]Nettles D L,Haider M A,Chilkoti A,et al.Neural network analysis identifies scaffold properties necessary for in vitro chondrogenesis in elastin-like polypeptide biopolymer scaffolds[J].Tissue Engineering Part A,2010,16:11-20
[57]Chung C,Anderson E,Pera R R,et al.Hydrogel crosslinking density regulates temporal contractility of human embryonic stem cell-derived cardiomyocytes in 3D cultures[J].Soft Matter,2012,8:10 141-10 148
[58]Li L Q,Teller S,Clifton R J,et al.Tunable mechanical stability and deformation response of a resilin-based elastomer[J].Biomacromolecules,2011,12:2 302 -2 310
[59]Chung C,Lampe K J,Heilshorn S C.Tetrakis(hydroxymethyl)phosphonium chloride as a covalent crosslinking agent for cell encapsulation within protein-based hydrogels[J].Biomacromolecules,2012,13:3 912-3 916
[60]Asai D,Xu D,Liu W,et al.Protein polymer hydrogels by in situ,rapid and reversible self-gelation[J].Biomaterials,2012,33:5 451-5 458
[61]Jo Y S,Gantz J,Hubbell J A,et al.Tailoring hydrogel degradation and drug release via neighboring amino acid controlled ester hydrolysis[J].Soft Matter,2009,5:440-446
[62]Miller J S,Shen C J,Legant W R,et al.Bioactive hydrogels made from step-growth derived PEG-peptide macromers[J].Biomaterials,2010,31:3 736-3 743
[63]Xu K D,Fu Y,Chung W J,et al.Thiol-ENE-Based biological/synthetic hybrid biomatrix for 3-D living cell culture[J].Acta Biomaterialia,2012,8:2 504-2 516
[64]Rizzi S C,Hubbell J A.Recombinant protein-co-PEG networks as cell-adhesive and proteolytically degradable hydrogel matrixes.Part 1:Development and physicochernical characteristics[J].Biomacromolecules,2005,6:1 226-1 238
[65]Halstenberg S,Panitch A,Rizzi S,et al.Biologically engineeredprotein-graft-poly(ethyleneglycol)hydrogels:A cell adhesive and plasm in-degradable biosynthetic material for tissue repair[J].Biomacromolecules,2002,3:710-723
[66]Sui Z,King W J,Murphy W L.Dynamic materials based on a protein conformational change[J].Advanced Materials,2007,19(20):3 377-3 380
[67]Cook W J,Walter L J,Walter M R.Drug-Binding by calmodulin-crystal-structureofacalmodulin trifluoperazine complex[J].Biochemistry,1994,33:15 259-15 265
[68]McGann C L,Levenson E A,Kiick K L.Resilin-Based hybrid hydrogels for cardiovascular tissue engineering[J].Macromolecular Chemistry and Physics,2013,214:203-213
[69]Stanfield R L,Wilson I A.Protein-Peptide interactions[J].Current Opinion in Structural Biology,1995,5:103-113
[70]Zakeri B,Fierer J O,Celik E,et al.Peptide tag forming a rapid covalent bond to a protein,through engineering a bacterial adhesin[J].Proceedings of the National Academy of Sciences of the United States of A-merica,2012,109:E690-E697
[71]Zakeri B,Howarth M.Spontaneous intermolecular amide bond formation between side chains for irreversible peptide targeting[J].Journal of the American Chemical Society,2010,132(13):4 526-4 527
[72]Sun F,Zhang W B,Mahdavi A,et al.Synthesis of bioactive protein hydrogels by genetically encoded SpyTag-SpyCatcher chemistry[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111:11 269-11 274
[73]Martin L,Javier-Arias F,Alonso M,et al.Rapid micropatterning by temperature-triggered reversible gelation of a recombinant smart elastin-like tetrablock-copolymer[J].Soft Matter,2010,6:1 121-1 124
[74]Sui Z J,King W J,Murphy W L.Protein-Based hydrogels with tunable dynamic responses[J].Advanced Functional Materials,2008,18:1 824-1 831
[75]Yuan W,Yang J,Kopeckova P,et al.Smart hydrogels containing adenylate kinase:Translating substrate recognition into macroscopic motion[J].Journal of the American Chemical Society,2008,130,15 760-15 761
[76]Peng Q,Li H.Direct observation of tug-of-war during the folding of a mutually exclusive protein[J].Journal of the American Chemical Society,2009,131:13 347-13 354
[77]Peng Q,Kong N,Wang H C E,et al.Designing redox potential-controlled protein switches based on mutually exclusive proteins[J].Protein Science,2012,21:1 222-1 230
[78]Kong N,Peng Q,Li H.Rationally designed dynamic protein hydrogels with reversibly tunable mechanical properties[J].Advanced Functional Materials,2014,24:7 310-7 317
[79]Pradhan S,Farach-Carson M C.Mining the extracellular matrix for tissue engineering applications[J].Regenerative Medicine,2010,5:961-970
[80]AltunbasA, PochanDJ. Peptide-Basedand polypeptide-based hydrogels for drug delivery and tissue engineering[M].In Peptide-Based Materials,Deming T,Ed.Springer-Verlag Berlin:Berlin,2012
[81]Ruoslahti E,Pierschbacher M D.New perspectives in cell-adhesion-RGD and integrins[J].Science,1987,238:491-497
[82]Mitra A,Mulholland J,Nan A,et al.Targeting tumor angiogenic vasculature using polymer-RGD conjugates[J].Journal of Controlled Release,2005,102:191-201
[83]Liu J C,Tirrell D A.Cell response to RGD density in cross-linked artificial extracellular matrix protein films[J].Biomacromolecules,2008,9:2 984-2 988
[84]Lutolf M P,Gilbert P M,Blau H M.Designing materials to direct stem-cell fate[J].Nature,2009,462:433-441
[85]Griffith L G,Swartz M A.Capturing complex 3D tissue physiology in vitro[J].Nature Reviews Molecular Cell Biology,2006,7:211-224
[86]Parisi-Amon A,Mulyasasmita W,Chung C,et al.Protein-Engineered injectable hydrogel to improve retention oftransplantedadipose-derivedstemcells[J].Advanced Healthcare Materials,2013,2:428-432
[87]Fong J H,Keating A E,Singh M.Predicting specificity in bZIP coiled-coil protein interactions[J].Genome Biology,2004,5(2):R11.doi:10.1186/gb-2004-5-2-r11
[88]Kim M,Tang S,Olsen B D.Physics of engineered protein hydrogels[J].Journal of Polymer Science Part BPolymer Physics,2013,51:587-601

