福尔马林固定石蜡包埋样本提取的RNA质量分析及其临床应用
薛洋,曾富春,舒骏,丛伟
(四川省人民医院胸外科,四川 成都610072)
福尔马林固定石蜡包埋(formalin-fixed paraffin-embedded,FFPE)组织是目前国内外运用最为广泛的组织保存形式。因为其能够保持组织的特殊形态,而且保存时间较长,能够适合后期的免疫组化和组织学分析,为临床治疗的选择提供可靠的保障。
目前,分子靶向治疗逐步成为肿瘤治疗的主流,在临床用药前对患者基因突变状态进行检测,可正确指导临床个体化用药,减轻患者经济负担,提高分子靶向药物治疗效果。因此,从FFPE样本中提取高质量的DNA/RNA进行分子靶标检测也逐渐受到关注。从FFPE中提取到能够有效扩增的DNA/RNA不仅适用于回顾性研究,也对疾病的诊断与鉴别、评估疾病预后和探索疾病分子机制具有重要意义[1]。
但是DNA/RNA在福尔马林固定和石蜡包埋的过程中,都有不同程度的片段化,而且样本大小、固定时间、固定温度和包埋条件等等都对DNA/RNA的质量产生极大的影响。近年来,研究人员试图了解在FFPE样本制备过程中存在着的各种对DNA/RNA的不利因素,找出解决方案,力求提取出高质量的DNA/RNA,用于后续的基因突变分析,还原样本真实的基因信息,以提高FFPE样本在疾病的诊断和预后中的应用价值。
在2011年发表的《中国非小细胞肺癌患者表皮生长因子受体基因突变检测专家共识》中,对FFPE样本的处理提出了规范化操作流程,使得各大医院能轻松地完成从FFPE样本中提取到高质量的DNA,用于表皮细胞生长因子受体(EGFR)的基因突变检测,为非小细胞肺癌的靶向治疗提供了重要的临床依据。但是由于环境中存在较多且稳定的RNA酶,导致从FFPE样本中提取完整的RNA较为困难。随着技术的不断完善,国内外出现了许多不同的提取方法,所得RNA的产量及扩增效率也存在着很大差异[2-4]。因此,目前存在着很多质疑:能否从FFPE样本中提取到高质量并且足够多的RNA用于后续的基因突变检测?
目前尚无文献报道对国内大队列的FFPE样本提取的RNA质量进行分析。因此,本研究从国内不同地区收集了994例FFPE样本,采用厦门艾德生物医药科技有限公司生产的FFPE样品RNA分离试剂盒(2013年获CFDA批准上市)进行RNA分离,对RNA质量进行分析,并将提取的RNA用于EML4-ALK基因融合和ROS1基因融合检测,通过对比测序结果,以此判断采用FFPE样本RNA进行基因突变检测的可靠性。
1 材料与方法
1.1 样本来源 收集2010年1月至2013年12月共994例FFPE样本,其中四川省人民医院303例、上海市某医院389例、福建省某医院302例,所有样本均有明确的病理诊断结果,并根据地区来源和不同年限进行分类,每例患者的组织蜡块连续切2张5μm厚的切片。
1.2 试剂 FFPE样品RNA分离试剂盒 (厦门艾德生物医药科技有限公司,货号:ADx-FF04,简称AmoyDx RNA试剂盒);人类EML4-ALK基因融合检测试剂盒(厦门艾德生物医药科技有限公司);人类ROS1基因融合检测试剂盒(厦门艾德生物医药科技有限公司)。
1.2 方法
1.2 .1 FFPE样本的RNA分离 采用AmoyDx RNA试剂盒进行RNA抽提。(1)切片:一次性切片刀,连续5μm厚切片,每个蜡块取2个切片,置入1个1.5ml EP管内,4℃冰箱保存;(2)脱蜡:分析纯二甲苯浸没组织切片,涡旋混匀促使组织溶解,离心弃上清;(3)脱二甲苯:加入无水乙醇以去除二甲苯,离心弃上清;(4)干燥;组织沉淀物经干燥蒸发残留的乙醇;(5)蛋白消化:蛋白酶K及其缓冲液浸没组织 ,56℃消 化 15min,80℃ 孵 育 15min;(6)DNA 降解:加入DNaseⅠ及其缓冲液,吹打混匀后静置15min;(7)RNA吸附:加入结合缓冲液,用吸附柱吸附RNA;(8)RNA收集:洗涤两次吸附柱,空管离心14000r/min 5min; 加入 80μl RNase-freeWater,静置3min;14000r/min离心1min。RNA样本立即保存于-80℃冰箱中。
1.2 .2 RNA的质量检测 使用Thermo Scientific公司的NanoDrop 1000超微量分光光度计检测核酸的纯度和浓度。A260的数值即OD值作为核酸浓度的指标,浓度以ng/μl为单位。A260/A280和A260/A230的比值作为核酸纯度的指标。
取5μlAmoyDx RNA试剂盒提取的RNA进行1%琼脂糖凝胶电泳分析,以鉴定RNA的完整性。取6μl RNA用于HPRT1基因检测,用于评估RNA样本中能进行有效扩增的片段含量。
1.2 .3 qRT-PCR 将所提取的RNA进行逆转录。采用Takara公司逆转录试剂盒进行cDNA合成。25μl逆转录体系包含:6μl RNA,5.0μl 5×逆转录缓冲液,1μl M-MLV 逆转录酶(200U/μl),3.5 pmol/l特异性逆转录引物。反应程序为:42℃60min;95℃5min。分别取5μl逆转录产物进行HPRT1基因、EML4-ALK基因融合和ROS1基因融合检测。40μl反应体系含有5μl cDNA,0.2mmol/L dNTPs,引物浓度为 0.4μmol/L,1 U ExTaq DNA聚合酶(Takara公司),4.0μl10×PCR 缓冲液。反应程序为:95℃预变性 5min,15个循环的 95℃变性 25s,64℃退火 20s,72℃延伸20s,接着31个循环的 93℃变性 25s,60℃退火 35s(收集 FAM 和 HEX信号),72℃延伸20s。实时荧光定量PCR仪机型为Stratagene Mx3000PTM。
1.2 .4 Sanger测序 所提取的RNA样本先进行逆转录及RT-PCR,然后将得到的PCR产物送至生工生物工程(上海)有限公司进行测序。
对于EML4-ALK基因融合阳性和ROS1基因融合阳性的RNA样本,根据已有报道的基因融合序列设计引物进行扩增;对于EML4-ALK基因融合阴性和ROS1基因融合阴性的RNA样本,则根据EML4-ALK基因和ROS1基因断裂点处的序列设计引物进行扩增。
1.3 统计学分析 将所提RNA进行EML4-ALK和ROS1基因融合检测,同时使用Sanger测序法进行验证,采用χ2检验分析其一致性。采用SPSS17.0统计分析软件进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 RNA纯度 对本实验所得的RNA纯度进行检测:A260/A280(图 1)和 A260/A230(图 2),RNA 的A260/A280和A260/A230均值分别为1.97和1.92。

图1 RNA A260/A280
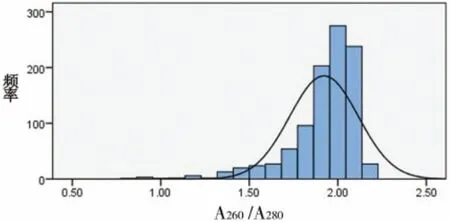
图2 RNA A260/A230
2.2 RNA浓度 对本实验所得的RNA浓度进行检测。RNA的浓度和HPRT1的qRT-PCR检测的Ct均值分别为 204.23ng/μl(图 3)和 14.09(图 4)。

图3 RNA浓度
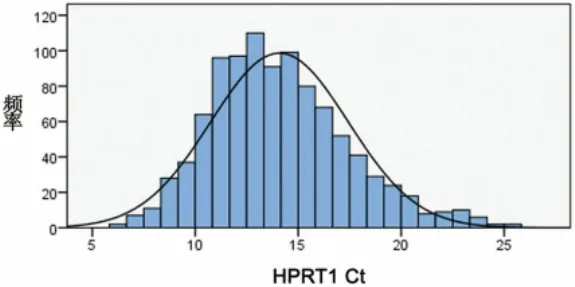
图4 RNA HPRT1 Ct值
2.3 RNA完整性 对本实验所得的RNA的完整性进行检测。FFPE样本的RNA电泳多数呈宽带状、弥散分布的smear带,提示降解明显,平均长度集中在200bp左右。
2.3 .1 比较不同地区来源的FFPE样本提取的RNA质量 分别对各家医院的样本RNA质量进行评估(图5)。结果显示:四川省人民医院样本RNA的 A260/A280、A260/A230、浓度和 HPRT1 的 Ct均值分别为 2.02、1.98、196ng/μl和 12.0。 上海市某医院的FFPE样本RNA的A260/A280和A260/A230均值分别为1.94和1.84, 平均浓度为248ng/μl, 经qRT-PCR检测的HPRT1的Ct值为14.8,其中有两例标本没有检测到HPRT1的Ct值,标本检测失败。福建省某 医 院 样 本 RNA的 A260/A280、A260/A230、 浓 度 和HPRT1 的 Ct 均 值 分 别 为 1.96、1.98、156ng/μl、15.3。

图5 不同地区来源的FFPE样本的RNA质量比较
2.3 .2比较不同保存年限的FFPE样本的RNA质量 收集2010~2013年四川省人民医院的FFPE样本,其中2010年23例,2011年75例,2012年110例,2013年95例。对上述FFPE样本进行RNA抽提,并对所获得RNA的质量进行检测(图6)。
2010 年的FFPE样本提取的RNA的A260/A280、A260/A230、浓度和 HPRT1的 Ct均值分别为1.97、2.03、146 ng/μl、12.8;2011 年的 FFPE 样本提取的RNA 的 A260/A280、A260/A230、 浓度和 HPRT1的 Ct值分别为 2.02、2.01、169ng/μl、12.6;2012 年的 FFPE样 本 提 取 的 RNA的 A260/A280、A260/A230、 浓 度 和HPRT1 的 Ct 均 值 分 别 为 2.03、1.98、226ng/μl、12.4;2013年的 FFPE样本提取的 RNA的 A260/A280、A260/A230、 浓度和 HPRT1的 Ct均值分别为2.04、1.94、195ng/μl、10.9。

图6 不同保存年限的FFPE样本的RNA质量比较
2.4 EML4-ALK和ROS1基因融合检测与Sanger测序结果的对比 人类EML4-ALK基因融合和ROS1基因融合检测试剂盒与Sanger测序法均得到检测结果的FFPE样本为992例,检测成功率为99.80%(992/994)。两种方法检测结果均为EML4-ALK基因融合和ROS1基因融合阳性的样本数为117例,总检出率为11.79%(117/992)。两种方法检测结果均为EML4-ALK基因融合和ROS1基因融合阴性的样本数为875例(表1)。

表1 试剂盒法和Sanger测序法对临床样本的检测结果对比情况
根据表1所列检测数据,两种方法对992例临床FFPE样本的检测结果的符合率为:
①两种方法检测的基因融合阳性符合率为a/(a+c)=100%。
②两种方法检测的基因融合阴性符合率为d/(b+d)=100%。
③两种检测方法检测结果的总符合率为 (a+d)/(a+b+c+d)=100%。
即使用人类EML4-ALK基因融合和ROS1基因融合检测试剂盒的检测结果与Sanger测序法完全一致。
3 讨论
FFPE样本具有来源充足、疾病种类广阔、疾病信息丰富和监控肿瘤性疾病的长期临床处理过程以及可长期保存、原位诊断和随时获取等[5]诸多优点,显示了其在疾病研究中的巨大潜力。因此,从FFPE中获取高质量的RNA,对疾病尤其是肿瘤的研究和临床用药治疗[6-8]具有重要的意义。
RNA样本的质量检测一般分为总量、纯度与完整性三大项。其中总量可以通过微量分光光度计测定260nm吸收值进行计算。纯度可以通过微量分光光度计测定A260/A230的比值,用于评估有机溶剂残留,理想值应当≥1.8,如果比值低于1.8,则表明存在有机物/盐离子等污染;测定A260/A280吸收值的比值可用于评估蛋白质污染比例,理想值应为1.9-2.1,如果比值低于1.8,则表明存在蛋白污染。完整性可以通过电泳,目测有无基因组DNA污染,有无RNA降解(28S,18S条带)[9]。研究表明,每个样本的Ct值与该样本的特定基因的起始拷贝数存在一定关系[10],起始拷贝数越多,Ct值越小。因此,只要比较不同样本的Ct值,即可推断出样本中含有特定基因的起始拷贝数的多寡。由于HPRT1是一种管家基因,在不同来源的细胞中的表达比较稳定,因此可以通过比较RNA样本中HPRT1的qRT-PCR的Ct值,来判断样本中的可扩增片段的浓度。基于上述指标,本文总共对994例FFPE样本采用AmoyDx RNA试剂盒进行RNA抽提 ,RNA 的 质 量 通 过 A260/A280、A260/A230、 浓 度 和HPRT1的qRT-PCR的Ct值来检测。
各家医院对于样本的处理有所不同,包括样本离体时间、固定时间和温度、包埋时间和温度、FFPE组织保存时间和温度等。而上述条件均会导致FFPE样本中RNA的片段化程度不同。本文从三个不同地区的三家医院收集FFPE样本,均采用AmoyDx RNA试剂盒提取RNA,并对RNA的质量进行检测分析。从上述结果可以看出:所提取的RNA的A260/A280和A260/A230数值均大于1.8,说明该RNA试剂盒能去除多余的蛋白质和盐离子,获得的RNA纯度较好。在后续的qRT-PCR反应中,三家医院的RNA样本都能进行有效扩增,尤其是四川省人民医院的RNA样本的有效扩增片段显著多于其它两家医院,说明采用RNA试剂盒法从这三家医院的FFPE样本提取的RNA,在纯度和总得率上均能适用于qRT-PCR的基因突变检测。
Nam等人[11]评估了样本的储存时间对RNA抽提质量的影响。将FFPE样本储存在室温1个月至10年。结果显示储存时间越长,RNA得率越低,纯度也显著降低。储存3~8年的样本中有58.3%能检测出β-actin的表达,储存1个月至1年的样本有62.5%能检测出β-actin的表达,储存时间少于1个月的样本全部能检测出β-actin的表达。本研究对样本的保存年限进行分组,考察RNA试剂盒提取的RNA的质量。结果显示,不同保存年限的FFPE样本,所提取的RNA的纯度均能符合要求,即A260/A280和A260/A230大于1.8,而在RNA得率方面,2012和2013年的FFPE样本的RNA浓度高于2010和2011年,而且有效片段浓度也高于后者,说明FFPE样本保存年限越长,RNA降解程度越大。
EML4-ALK基因融合和ROS1基因融合各自分别代表了一类具有特定临床与病理特征的NSCLC分子亚群。文献报道约3%~7%的NSCLC存在EML4-ALK基因融合[12-15],另有约1%-3%的NSCLC存在ROS1基因融合[16,17],从而为肺癌的治疗提供了新的分子靶点。现有临床研究表明,以EML4-ALK基因融合、ROS1基因融合为靶点的新型EML4-ALK/ROS1酪氨酸激酶抑制剂克唑替尼对携带EML4-ALK基因融合或ROS1基因融合的NSCLC患者疗效显著,其客观缓解率(ORR)分别为57%和54%,疾病控制率(DCR)则分别达到了87%和85%[18,19]。因此,准确检测EML4-ALK基因融合和ROS1基因融合存在状态,可为肿瘤患者的靶向用药治疗提供必要依据。本研究检测的EML4-ALK和ROS1融合基因阳性率为11.77%,与上述报道数据一致,而且检测结果与Sanger测序法的阳性检出率、阴性检出率均为100%,说明从FFPE样本中提取的RNA,可以用于基因突变检测,而且检测结果真实可靠,可为靶向治疗方案的选择提供重要的证据。
994 例FFPE样本RNA中有992例可用于qRT-PCR的检测,检测成功率为99.80%。由于目前各大医院对样本的处理进行了规范化操作:控制离体时间,用中性的10%福尔马林浸泡,根据样本大小不同来调节固定时间,使得从FFPE样本中提取出来的RNA质量较好,而且qRT-PCR产物长度较短,低于130bp,这些改善措施大大提高了从FFPE样本中提取的RNA质量,适合后续的基因突变检测,使得FFPE样本的临床利用率大为提高,能提供真实可靠的基因突变图谱,可为靶向治疗提供可靠的保障。
[1]Klopfleisch R,Weiss AT,Gruber AD.Excavation of a buried treasure-DNA,mRNA,miRNA and protein analysis in formalin fixed,paraffin embedded tissues[J].Histol Histopathol,2011,26(6):797-810.
[2]Fedorowicz G,Guerrero S,Wu TD,et al.Microarray analysis of RNA extracted from formalin-fixed,paraffin-embedded and matched fresh-frozen ovarian adenocarcinomas[J].BMC Med Genomics,2009,2:23-35.
[3]Takano EA,Mikeska T,Dobrovic A,et al.A multiplex endpoint RT-PCR assay for quality assessment of RNA extracted from formalin-fixed paraffin-embedded tissue[J].BMC Biotechnology,2010,10:89-102.
[4]Waddell N,Cocciardi S,Johnson J,et al.Gene expression profiling of formalin-fixed,paraffin-embedded familial breast tumours using thewhole genome-DASL assay.JPathol,2010,221(4):452-461.
[5]Osawa S,Shimada Y,Sekine S,et al.MicroRNA profiling of gastric cancer patients from formalin-fixed paraffin-embedded samples[J].Oncol Lett,2011,2(4):613-9.
[6]中国临床肿瘤学会肿瘤生物标志物专家委员会.中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊断专家共识(2013版)[J].中华病理学杂志,2013,42(6):402-406.
[7]中华医学会呼吸病学分会肺癌学组 中国肺癌防治联盟.晚期非小细胞肺癌分子靶向治疗专家共识(2013版)[J].中华结核和呼吸杂志,2014,37(3):177-183.
[8]中国非小细胞肺癌患者表皮生长因子受体基因突变检测专家组.中国非小细胞肺癌患者表皮生长因子受体基因突变检测专家共识[J].中华病理学杂志,2011,40(10):700-702.
[9]Eldh M,Latvall J,Malmholl C,et al.Importance of RNA isolation methods for analysis of exosomal RNA:evaluation of different methods[J].Mol Immunol,2012,50(4):278-286.
[10]Kreth S,Heyn J,Grau S,et al.Identification of valid endogenous control genes for determining gene expression in human glioma[J].Neuro Oncol,2010,12:570-579.
[11]Nam SK,Im J.Effects of fixation and storage of human tissue samples on nucleic acid preservation[J].Korean JPathol.,2014,48(1):36-42.
[12]Soda M,Choi YL,Enomoto M,et al.Identification of the transforming EML4-EML4-ALK fusion gene in non-small cell lung cancer[J].Nature,2007,448(7153):561-566.
[13]Kwak E,Bang YJ,Camidge R,et al.Anaplastic lymphoma kinase inhibition in non-small cell lung cancer[J].N Engl JMed,2010,363(18):1693-1703.
[14]Kim H,Yoo SB,Choe JY,et al.Detection of ALK gene rearrangement in non-small cell lung cancer:a comparison of fluorescence in situ hybridization and chromogenic in situ hybridization with correlation of ALK protein expression[J].JThorac Oncol,2011,6(8):1359-1366.
[15]Paik JH,Choe G,Kim H,et al.Screening of anaplastic lymphoma kinase rearrangement by immunohistochemistry in non-small cell lung cancer:correlation with fluorescence in situ hybridization[J].J Thorac Oncol,2011,6(3):466-472.
[16]Bergethon K,Shaw AT,Ou SH,et al.ROS1 rearrangements define a uniquemolecular class of lung cancers[J].JClin Oncol,2012,30(8):863-870.
[17]Davies KD.Identifying and targeting ROS1 gene fusions in nonsmall cell lung cancer[J].Clin Cancer Res,2012,18(17):4570-4579.
[18]Camidge DR,Bang Y,Kwak EL,et al.Progression-Free Survival(PFS)from a Phase 1 Study of Crizotinib (PF-02341066)in Patients with EML4-ALK-Positive Non-Small Cell Lung Cancer(NSCLC)[R].Chicago:the ASCO Annual Meeting,2011.
[19]Shaw AT,Yeap BY,Solomon BJ,et al.Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring EML4-ALK gene rearrangement:a retrospective analysis[J].Lancet Oncol,2011,12(11):1004-1012.

