血液肿瘤CD44基因检测及4亚型克隆原核表达
蔡壬辛 ,洪旭灿 ,张轩 ,李沫 ,秦笙 ,许振杰 ,曾建明
(1、广东省中医院检验科,广东 广州 510006;2、佛山市第二人民医院检验科,广州 佛山528000)
CD44是广泛分布于多种细胞表面的糖蛋白分子,属黏附分子的成员,具有多种重要的生物功能,它与细胞黏附、淋巴细胞活化和归巢、肿瘤生长和转移密切相关[1,2];CD44分子呈广泛多态性,多态性主要由核心肽的不同及翻译后的糖基化修饰引起[3]。目前对CD44分子的研究主要集中在实体瘤,相继发现CD44v6亚型的过度表达与多种人体恶性肿瘤的发生、发展、侵袭和转移密切相关,被认为是肿瘤转移促进因子[4-7]。
化疗后复发是白血病治疗的难点,近十年提出残留的白血病干细胞(leukemia stem cells,LSCs)是疾病复发的根源。有研究提示拮抗LSCs黏附、归巢(homing)途径可能有助于杀灭LSCs[8]。有研究发现CD44单克隆抗体A3D8通过抑制ERK1/2上调Bim诱导HL-60细胞早期凋亡[9]。CD44通过p27Kip1途径抑制AML细胞增殖[10]。伊马替尼是治疗慢性粒细胞白血病(CML)的一线药物,它能够降低JURL-MK1细胞CD44等分子表达,并引起细胞凋亡[11];现发现伊马替尼耐药细胞中CD44亦表达增高[12],阻断CD44有益于CML患者自体移植[13,14]。另外,CD44在AML和CML的LSCs细胞龛中发挥重要作用[15]。此外,淋巴瘤CD44高表达患者发生治疗不缓解或复发,甚至死亡率更高[16];小鼠动物实验也发现BCR-ABL1转染的CD44缺陷干细胞不能在受体小鼠骨髓归巢[13],这提示通过干预CD44途径实现拮抗残留的LSCs,有望成为白血病治疗新的切入点。
本实验旨在通过PCR检测临床血液肿瘤患者和细胞株CD44分子,并通过基因重组技术构建CD44胞外区(hCD44om)多肽原核表达载体,在大肠埃希菌BL21(DE3)中表达,为下一步研究CD44骨髓靶向功能奠定基础。
1 材料与方法
1.1 材料
1.1 .1 主要试剂 X-gal、IPTG、 氨苄西林钠(Amp)、低分子质量蛋白标准、丙烯酰胺、甲叉双丙烯酰胺,购自大连宝生物工程有限公司;酵母提取物、胰蛋白胨、低熔点琼脂糖,购自北京原平皓生物工程公司;限制性内切酶EcoR I、HindⅢ,连接酶,Ex TaqDNA聚合酶为 TakaRa公司产品;Trizol、DNA Marker、质粒抽提和胶回收试剂盒为东盛公司产品,蛋白Marker、异丙基β-D硫代半乳糖苷(IPTG)为Fermentas公司产品;ECL超敏发光液为北京普利莱公司产品,兔抗人CD44单克隆抗体为美国Abcam公司产品,羊抗兔IgG-HRP为武汉博士德公司产品。
1.1 .2标本 血标本源于广东省中医院临床样本。9个标本中,4例为急性白血病(AML),5例为慢性粒细胞白细胞 (CML);K562、HL-60细胞源于南方医科大学附属南方医院血液科实验室。
1.1 .3 菌种和质粒 质粒pET32a(+)、大肠埃希菌(E.coli)DH5α为本实验室保存,BL21(DE3)由东盛生物公司提供。
1.1 .4 PCR引物 根据Genbank基因序列设计引物,由北京华大基因技术有限公司合成。P1:5’-CCGGAATTCATGGACAAGTTTTGGTGGCACG-3’(含 EcoR I 酶切位点);P2:5’-CGCAAGCTTTTCTGGAATTTGGGGTGTCCT-3’(含 HindⅢ 酶切位点)。
1.2 方法
1.2 .1 cDNA的制备 采用Ficoll淋巴细胞分离液分离单个核细胞,Trizol提取总RNA,-70℃保存备用。参照Invitrogen公司试剂盒(货号1559026)说明书提取细胞总RNA,按TakaRa试剂盒说明书进行 RT-PCR。 PCR 条件:95℃预变性 5 min;94℃45s、55℃ 40s、72℃延伸 1min,共 30 个循环;72℃延伸10min。
1.2 .2重组质粒pET32-CD44的构建 凝胶回收试剂盒回收PCR产物,经EcoR I、HindⅢ双酶切后与同样双酶切的 pET32a(+)质粒 16℃连接3h,转化DH5α感受态细胞,涂布于60μg/ml Amp LB平板,培养10~14h后挑选单个菌落,转移至3ml 60μg/m l Amp LB培养,37℃ 250r/min摇菌培养10~14h,菌液煮沸后PCR鉴定;同时送Invitrogen公司测序鉴定。
1.2 .3 CD44胞外区的诱导表达 将测序鉴定正确的重组表达载体pET32-CD44转化BL21(DE3)感受态细胞,挑取单个克隆于含60μg/m l Amp LB液体培养基中过夜培养。取60μl过夜培养液菌至3ml 60μg/ml Amp LB,培养至A600值为0.6~0.8时,加入终浓度为 0.2、0.4、0.6和 1.0 mM 的 IPTG,37℃振荡培养 4h,4℃离心收集菌体,10%SDSPAGE分析;然后以终浓度为1.0 mM的IPTG在37℃诱导2h~5h,再进行SDS-PAGE分析;同时进行30℃诱导表达。以BandScan5.0软件分析蛋白表达情况。按优化后条件扩大培养,分别取上清及包涵体沉淀进行SDS-PAGE分析蛋白表达情况。以pET28a(+)-GFP为阳性对照,BL21(DE3)菌为阴性对照。
1.2 .4 Western blot细菌裂解产物离心后经10%SDS-PAGE电泳,湿转PVDF膜,5%脱脂奶粉封闭1h后,与兔抗人CD44单克隆抗体(1:5000)37℃孵育 2h;1×TBS-T(1×TBS,0.05 Tween 20)充分洗涤,然后用辣根过氧化物酶(HRP)标记的羊抗兔IgG(1:3000)37℃孵育2h;洗膜后用加入ECL发光液浸泡2min,暗室显影、定影。
2 结果
2.1 CD44基因检测 除K562细胞组扩增结果为阴性外,9例临床标本和HL-60细胞的PCR产物电泳均获得特异性电泳条带(结果未展示)。PCR结果测序后经DNAman软件比对分析,发现HL-60 CD44与9例临床标本序列差异较大,其与参考序列比对发现其匹配度为 83.83%(见图1);再以BLASTX程序比对nr蛋白库,发现HL-60细胞与CD44isoform4型一致性最高,但第21位出现4个氨基酸HPHQ(H:组氨酸,P:脯氨酸,Q:谷氨酰胺),160~213氨基酸出现较高频率的点突变;其余标本为CD44isoform4型(NP_001001391.1)。比对结果见图2。
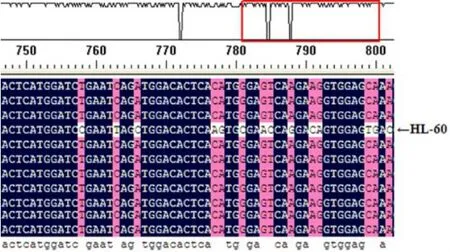
图1 HL-60细胞CD44测序部分结果

图2 HL-60细胞CD44测序结果的BLASTX比对分析
2.2 pET32-CD44鉴定结果 PCR鉴定pET32-CD44转化子,1%琼脂糖凝胶电泳见DNA条带位置与预计的产物804bp一致 (图3);测序结果与Genbank序列比对完全一致,部分峰型图结果见图4。

图3 pET32-CD44质粒鉴定图

图4 pET32-CD44质粒部分测序结果
2.3 CD44胞外区诱导表达条件的优化 pET32-CD44转化BL21(DE3)后,经IPTG诱导表达。CD44的优化表达结果,各温度、各时间点表达产物进行10%SDS-PAGE电泳(图5)。与不含质粒BL21(DE3)相比在53KD处出现一条蛋白表达条带,片段大小与预期值相符。用BandScan5.0软件分析发现,IPTG浓度对目的蛋白表达量影响不大 (图5A),1 mM IPTG,37℃诱导2h的表达量最大,占总蛋白的48.6%。
2.4 CD44的表达形式分析 诱导表达产物的10%SDS-PAGE结果见图6。BandScan5.0分析hCD44om在2h细菌裂解液的沉淀中占总蛋白的37.3%,在上清中占总蛋白的14.2%;在3h细菌裂解液的沉淀中占总蛋白的23.8%,在上清中占总蛋白的21.8%,表明该蛋白在菌体中同时有包涵体和可溶表达两种形式,随着诱导时间不同,蛋白存在形式发生改变。

图5 蛋白表达产物10%SDS-PAGE结果

图6 SDS-PAGE分析蛋白表达形式
2.5 Western blot鉴定 1mM IPTG 37℃诱导2h细菌裂解沉淀经SDS-PAGE电泳后转膜后以兔抗人CD44单克隆抗体(1:5000)为一抗,进行ECL显影(图7),结果发现在53KD处出现特异性条带,且显色条带随蛋白加入量增加而增强。

图7 Western blot分析人CD44蛋白特异性
3 讨论
近年来在研究CD44基因及蛋白结构和生物学功能的基础上,对其在肿瘤发生、发展、转移中的机制进行了大量探索[17],对肿瘤干细胞的表型研究亦发现CD44为多种肿瘤干细胞的细胞表面标记物,因此针对CD44的靶向治疗可能揭示分子靶点治疗的新前景。
CD44基因含20个外显子(exon),其中exon1~5,exon16~20为组成型表达,中间的exon6~15则为可变表达,因此命名为v1~v10[18]。CD44v转录方式十分复杂,其中,CD44v6亚型高表达与实体肿瘤转移、侵袭密切相关;而CD44v在血液肿瘤中的研究尚不够清楚。
本实验基于CD44基因剪切模式研究进展,设计上游引物位于exon1上,下游引物跨exon16、exon17a,因此,理论上可以检测到不同的CD44v亚型。测序结果显示AML、CML临床标本均为CD44isoform4 型 (图 1),HL-60 为 CD44isoform4 变异性,且有多个氨基酸发生突变。估计与细胞株基因组不稳定有关。此外,未能在K562细胞株中检出CD44(重复3次),与文献报道不一致,原因不明[14,19,20]。
在蛋白表达方面,试验发现pET32a/BL21(DE3)原核表达系统不能够表达CD44全长蛋白(其编码区CDS插入到pET32a(+)的EcoR I和HindⅢ酶切位点之间,数据未显示),而重新设计引物克隆无信号肽的CD44胞外区则可以被IPTG高效诱导表达。在课题组前期进行的CD96蛋白的表达中也观察到类似的情况[21],估计这与CD44信号肽和跨膜区氨基酸极性有关。本文对蛋白原核表达所用IPTG浓度、温度和诱导时间进行优化,发现IPTG浓度对CD44表达量影响不大,37℃结果略高于30℃,2~3h时达到较高的表达水平,这与CD96蛋白诱导条件不同[21]。
试验发现CD44在细菌裂解液沉淀和上清中含量在不断变化,表明该蛋白以包涵体和可溶性形式表达,同时随着诱导时间延长,蛋白存在的形式也发生改变。此外,Western blot分析发现:CD44单克隆抗体在53KD处有条带,在53KD条带下还有小的拖尾带,可能是目的蛋白降解所致。
综上所述,本实验发现AML和CML患者外周血细胞表达CD44isoform4型分子,HL-60细胞为CD44isoform4变异性,K562细胞中不表达CD44,为后续研究CD44在髓系白血病中的作用奠定基础;同时,实验获得CD44isoform4胞外区片段,为进一步研究单克隆抗体制备提供了基础。
[1]Denning SM,Le PT,Singer KH,et al.Antibodies against the CD44 p80,lymphocyte homing receptor molecule augment human peripheral blood T cell activation[J].J Immunol,1990,144(1):7-15.
[2]Noroozinia F,Fahmideh AN,Yekta Z,et al.Expression of CD44 and P53 in renal cell carcinoma:association with tumor subtypes[J].Saudi JKidney Dis Transpl,2014,25(1):79-84.
[3]Jackson DG,Buckley J,Bell JI.Multiple variants of the human lymphocyte homing receptor CD44 generated by insertions at a single site in the extracellular domain[J].JBiol Chem,1992,267(7):4732-4739.
[4]Orian-Rousseau V.CD44,a therapeutic target formetastasising tumours[J].Eur JCancer,2010,46(7):1271-1277.
[5]Gwak JM,Kim HJ,Kim EJ,et al.MicroRNA-9 is associated with epithelial-mesenchymal transition,breast cancer stem cell phenotype,and tumor progression in breast cancer[J].Breast Cancer Res Treat,2014,147(1):39-49.
[6]SterlacciW,Savic S,Fiegl M,et al.Putative stem cellmarkers in non-small-cell lung cancer:a clinicopathologic characterization[J].JThorac Oncol,2014,9(1):41-49.
[7]Ghatak S,Bogatkevich GS,Atnelishvili I,et al.Overexpression of c-Met and CD44v6 receptors contributes to autocrine TGF-beta1 signaling in interstitial lung disease[J].JBiol Chem,2014,289(11):7856-7872.
[8]Tavor S,Petit I.Can inhibition of the SDF-1/CXCR4 axis eradicate acute leukemia?[J].Semin Cancer Biol,2010,20(3):178-185.
[9]Chang GQ,Wang J,GaoW,et al.[Early apoptosis of HL-60 cells induced by anti-CD44 McAb A3D8 inhibiting ERK1/2-upregulated Bim expression][J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2011,19(3):656-660.
[10]Gadhoum Z,Leibovitch MP,Qi J,et al.CD44:a new means to inhibit acute myeloid leukemia cell proliferation via p27Kip1[J].Blood,2004,103(3):1059-1068.
[11]Kuzelova K,Pluskalova M,Grebenova D,et al.Changes in cell adhesivity and cytoskeleton-related proteins during imatinib-induced apoptosis of leukemic JURL-MK1 cells[J].JCell Biochem,2010,111(6):1413-1425.
[12]Grosso S,Puissant A,Dufies M,et al.Gene expression profiling of imatinib and PD166326-resistant CML cell lines identifies Fyn as a gene associated with resistance to BCR-ABL inhibitors[J].Mol Cancer Ther,2009,8(7):1924-1933.
[13]Krause DS,Lazarides K,von Andrian UH,et al.Requirement for CD44 in homing and engraftment of BCR-ABL-expressing leukemic stem cells[J].NatMed,2006,12(10):1175-1180.
[14]Chang G,Zhang H,Wang J,et al.CD44 targetsWnt/beta-catenin pathway to mediate the proliferation of K562 cells[J].Cancer Cell Int,2013,13(1):117.
[15]Krause DS,Fulzele K,Catic A,et al.Differential regulation of myeloid leukemias by the bone marrow microenvironment[J].Nat Med,2013,19(11):1513-1517.
[16]Horst E,Meijer CJ,Radaszkiewicz T,et al.Adhesion molecules in the prognosis of diffuse large-cell lymphoma:expression of a lymphocyte homing receptor(CD44),LFA-1(CD11a/18),and ICAM-1(CD54)[J].Leukemia,1990,4(8):595-599.
[17]孙丽萍.CD24与CD44v6在宫颈癌中的表达及意义[J].实验与检验医学,2011,29(5):479-481.
[18]Vela E,Roca X,Isamat M.Identification of novel splice variants of the human CD44 gene[J].Biochem Biophys Res Commun,2006,343(1):167-170.
[19]Lompardia SL,Papademetrio DL,Mascaro M,et al.Human leukemic cell lines synthesize hyaluronan to avoid senescence and resist chemotherapy[J].Glycobiology,2013,23(12):1463-1476.
[20]Liu YP,Liu CF,Ma DX,et al.Effect of CD44 gene silence on multi-drug resistance reversal and biologic activity in K562/A02 cells[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2010,18(2):335-339.
[21]Zeng JM,Liu F,Tan PH,et al.Human CD96 gene cloning,expression and identification[J].Nan Fang Yi Ke Da Xue Xue Bao,2011,31(7):1232-1235.

