橙皮素铜(II)配合物与牛血清白蛋白作用的研究*
邹淑君,张 蕾,郭迎喜,徐 暘,许树军*
(黑龙江中医药大学a.药学院;b.实验中心,黑龙江 哈尔滨150040)
橙皮素(Hesperetin),化学名5,7,3′- 三羟基-4′-甲氧基二氢黄酮,为柑橘果实中主要活性成分橙皮苷的水解产物。在国外,橙皮素用做心血管保健药物,也做为抗氧化剂用于化妆品和食品添加剂中[1]。橙皮素分子具有4- 羰基、5- 羟基结构,易与过渡金属离子配位形成配合物。过渡金属铜在机体生长发育过程中起着重要的作用,Cu2+也是容易发生配位反应的重要金属离子。本研究参考文献[2],用橙皮素与Cu2+反应合成橙皮素铜配合物(以下简称Hes-Cu),其结构式见图1。测试了Hes-Cu 与牛血清白蛋白(BSA)之间的作用,并同橙皮素与BSA 之间的作用进行比较。以考察Cu2+的引入对橙皮素与血清蛋白作用的影响,以间接探索橙皮素被吸收入血液后,在血液中储存、转运及与靶向物质作用的过程中受Cu2+影响的情况。
图1 橙皮素铜配合物的结构Fig.1 Structures of hesperetin copper(II)complex
1 材料与方法
1.1 材料与仪器
橙皮素(Hes 98%)(上海晶纯实业有限公司);三羟甲基氨基甲烷(简称Tris 99.8%)(上海博宏生物科技有限公司);牛血清白蛋白(BSA 99.8%)(美国Sigma 公司);实验用水均为二次蒸馏水;其它常用试剂均为国产分析纯。
PB-20 型pH 计(德国赛多利斯);SK250LH 型超声波清洗器(上海科导);XS105DU 型电子分析天平(瑞士梅特勒);CU600 型温水浴锅(上海益恒实验仪器有限公司);RF-5301PC 荧光光度计(日本岛津公司)。
1.2 实验方法
用 移 液 枪 分 别 取0,200,400,600,800,1000,1200,1400,1600,1800,2000μL 的橙皮素铜配合物溶液(1.0×10-4mol·L-1,用少量DMSO 超声溶解后,再用二次蒸馏水定容),加入到盛有1.00mLBSA(1.0×10-5mol·L-1)溶液的10mL 容量瓶中,用Tris-HCl(pH=7.40)溶液定容混匀。3 次操作,分别置于290、300、310K 水浴中温育15min,取出后用荧光光谱仪进行检测,固定激发波长为280nm,在300~550nm范围内扫描样品溶液的荧光光谱。
1.3 实验数据处理
实验数据均参照文献[3]的方法进行处理。
2 结果与分析
2.1 橙皮素铜配合物与牛血清白蛋白作用的荧光光谱
图2 给出了300K 时,不同浓度的Hes-Cu 存在下的BSA 的发射光谱。
由2 图可见,随着Hes-Cu 浓度的增加,BSA 的荧光发射强度逐渐减小,且减小的幅度越来越小。这表明实验所测的Hes-Cu 浓度都可以使BSA 的内部荧光发生猝灭,Hes-Cu 与BSA 之间都存在相互作用。且随Hes-Cu 浓度的增加,二者的结合趋向饱和。Hes-Cu 不但猝灭BSA 内源荧光的强度,而且引起BSA 内源荧光的最大发射波长发生明显的红移。红移幅度均约2~9nm;配合物浓度越大,红移程度越大。表明Hes-Cu 与BSA 结合后使BSA 的色氨酸或酪氨酸周围环境的亲水性增加。对比文献[3]可以判断,Hes-Cu 使BSA 内源荧光的最大发射波长红移幅度比橙皮素大,说明受金属Cu2+的影响,使配合物对BSA 的氨基酸周围环境的极性改变程度增大。

图2 橙皮素铜配合物对BSA 的荧光猝灭光谱Fig.2 Fluorescence emission spectra of BSA upon addition of hesperetin copper(II)complex[BSA]=1.0×10-6mol·L-1,a~k:[ Hes-Cu]/[BSA]= 0, 2.0, 4.0, 6.0,8.0, 10.0, 12.0, 14.0, 16.0, 18.0, 20.0
由图2 还可见,Hes-Cu 对BSA 的影响体系中,在410nm 左右出现了一个荧光发射峰,且发射峰的强度随着Hes-Cu 浓度的增加而增强。这可能是溶液中游离的配合物产生的[4]。
参照文献[3]的方法,计算得到在实验条件下,Hes-Cu 在2×10-6~1×10-5mol·L-1浓度范围内对BSA 的荧光猝灭率,与橙皮素对比的结果见图3。
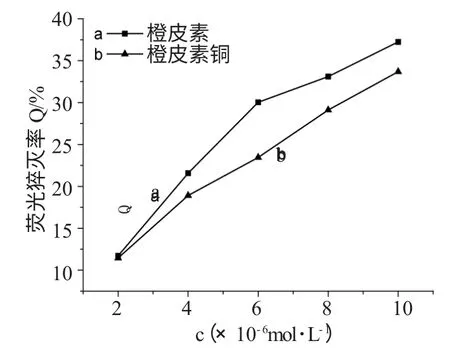
图3 橙皮素铜配合物及橙皮素对BSA 的荧光猝灭率Fig.3 Fluorescence quenching efficiency of BSA upon additionof hesperetin copper(II)complex and hesperetin
相同浓度时,从整体规律看,配合物对BSA 荧光猝灭程度率比相橙皮素对BSA 荧光猝灭率小。
2.2 橙皮素铜配合物对牛血清白蛋白的荧光猝灭机理
图4 为Hes-Cu 分别在3 个不同温度下(290、300 和310K)与BSA 相互作用的Stern-Volmer 曲线。根据Stern-Volmer 方程F0/F=1+Kqτ0[Q]=1+Ksv[Q]求得配合物的猝灭常数Ksv及Kq并列于表1中,方程式中各符号的意义参看文献[3]。

图4 橙皮素铜配合与BSA 作用的Stern-Volmer 曲线Fig.4 Stern-Volmer plots of BSA fluorescence quenching caused by the addition of hesperetin copper(II)complex
结合图4 和表1 可以看出,在290、300、310K下Hes-Cu 与BSA 的动态猝灭速率常数Kq 均大于猝灭剂与生物聚合物大分子相互作用的最大扩散碰撞猝灭速率常数(2.0×1010L·mol-1·s-1),初步认为猝灭机理是静态猝灭。且静态猝灭常数Ksv(290K)>Ksv(300K)>Ksv(310K),即随着温度升高,Ksv减小,进一步表明Hes-Cu 对BSA 荧光的猝灭可能是由分子间形成复合物而引起的静态猝灭。
可见,橙皮素铜配合物较规律的符合温度升高,静态猝灭常数降低,所以橙皮素铜配合物对BSA的荧光猝灭应以静态猝灭为主,即配合物都与BSA结合形成了复合物。对比文献[3]中橙皮素与BSA 作用的结果,配合物结合BSA 的静态猝灭速率常数小于橙皮素结合BSA 的静态猝灭速率常数,降低1 个数量级,可见,配合物与BSA 的静态结合率减弱。
2.3 用静态猝灭法分析橙皮素铜与牛血清白蛋白作用的结合常数和结合位点数
参照文献[3]计算橙皮素铜配合物与BSA 作用的结合常数和结合位点数,结果见表1。

表1 不同温度下橙皮素铜配合物与BSA 作用的猝灭常数、结合常数及结合位点数Tab.1 Quenching constants, binding constants and the number of binding sites of the systems of Hes-Cu-BSA at differenttemperatures
由表1 可见,橙皮素铜配合物与BSA 作用的结合常数Ka值多为103~104量级,说明橙皮素铜配合物与BSA 之间有一定的结合作用。Ka随着温度的增加呈现不规律性变化;结合位点数均比1 小很多。对比文献[3]中橙皮素的相关参数可见,橙皮素铜配合物与BSA 之间的结合位点数平均值远小于橙皮素与BSA 之间的结合位点数。可见配合物的形成,Cu2+占据了橙皮素与BSA 之间作用的有效基团,从而减弱了配合物与BSA 之间的静态复合作用,这与有些文献报导相似[5]。另一方面也可能是金属离子配位空间的四面体或八面体构型,使配合物空间立体结构与BSA 的折叠结构所能提供的合适取向不匹配而导致形成复合物的能力降低。
2.4 橙皮素铜配合物与牛血清白蛋白之间作用的热力学参数和作用力类型
参照文献[3]计算在290~310K 范围内橙皮素铜配合物与BSA 的结合作用的热力学参数,配合物与BSA 的作用过程为ΔG=-25.01kJ·mol-1,表明是自发过程。橙皮素铜与BSA 的作用过程的ΔH=-71.96kJ·mol-1,ΔS=-161.93kJ·mol-1,表明范德华力及氢键是配合物与BSA 的主要作用力。对比橙皮素来说,橙皮素铜配合物的作用力类型虽未改变,但热力学参数变化很大。
3 结论
本部分工作是应用荧光光谱法分析了橙皮素铜配合物与BSA 的相互作用关系,探讨了因形成铜配合物对橙皮素与BSA 作用的影响。可以得出以下结论。
(1)配合物均能有效猝灭BSA 的荧光,猝灭机理与橙皮素相似,是与BSA 结合形成复合物导致的静态猝灭为主。但铜配合物对BSA 的荧光猝灭率小于橙皮素;
(2)对比橙皮素,铜配合物对BSA 的结合常数变小,结合位点数也明显减小。
(3)配合物与BSA 作用力类型与橙皮素相似,也以范德华力为主。预测造成以上不同的可能原因是:金属离子的引入,使橙皮素与BSA 作用的有效位点被金属离子占据,据此估计橙皮素4 位羰基与5 位羟基可能是与BSA 作用的有效位点。
因此,在考虑橙皮素进入生物体血液中,从贮存、转运、释放、至作用于靶点的整个过程,Cu2+都可能是重要的影响因素,因为在生理pH 条件下,它可与橙皮素发生配位作用而减弱橙皮素与蛋白的结合作用。
[1] 刘学仁,张莹.橙皮苷和橙皮素生物活性的研究进展[J].中国新药杂志,2011,20(4):329-333.
[2] 朱金婵.三种黄酮铜配合物的合成及其生物活性研究[D].中国优秀硕博士学位论文全文数据库:广西师范大学,2008.
[3] 邹淑君,张蕾,郭迎喜,等.橙皮素及橙皮苷与牛血清白蛋白作用的比较[J].中医药信息,2014,31(2):8-12.
[4] 刘哲,王坤杰,宋玉民,等.水杨酸金属配合物与牛血清白蛋白的相互作用[J].无机化学学报,2010,26(1):72-78.
[5] 蒋新宇,李文秀,陈景文.锌离子存在下槲皮素、杨梅素与牛血清蛋白的结合[J].无机化学学报,2008,24(10):1588-1595.

