岩藻黄质标准样品的研制*
张怡评 ,陈伟珠 ,方华 ,谢全灵 ,陈晖 ,洪专 ,易瑞灶 ,吴皓
(1.国家海洋局第三海洋研究所,福建厦门 361005; 2.南京中医药大学,南京 210023)
岩藻黄质(fucoxanthin,亦称褐藻黄素)是从可食用褐藻中,如裙带菜(Undaria pinnatifi da)、海带(Laminaria japonica aresch)和马尾藻(Sargassum fulvellum)等提取出来的天然类胡萝卜素。目前已经证实岩藻黄质具有多种生物学活性,包括抗肿瘤、抗炎、抗氧化、减肥等[1–5],其潜在的活性也正在被科学家们积极探求之中,目前己成为当今海洋药物研究与开发的热点之一。然而,由于技术难度等问题,目前国内尚无岩藻黄质标准样品。笔者从海带中提取分离纯化获得高纯岩藻黄质,进行标准样品的研究,为海带及岩藻黄质制剂的后续开发研究提供重要的指标性成分。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:LC–2010AD型,附带二元高压梯度泵、自动进样器、柱温箱、紫外检测器,日本岛津公司;
红外光谱仪:Nicolet Ftir–670 型,美国Thermo Scientifi c 公司;
高分辨质谱仪:Lct PremierTMXE型,美国Waters公司;
天平:AL/104型,瑞士梅特勒–托利多集团;
纯水机:Milli–Q,美国 Millipore公司;
甲醇:色谱纯,德国默克公司;
实验用水均来自Milli–Q纯水系统。
1.2 岩藻黄质样品的制备
以海带为原料,经乙醇提取、硅胶柱层析、高效液相色谱制备分离、浓缩、冷冻干燥得岩藻黄质高纯单体。
1.3 定性分析
采用红外吸收光谱、高分辨质谱及核磁共振谱等对岩藻黄质标准样品进行定性分析。
1.4 定值分析
采用高效液相色谱–紫外检测(HPLC–UV)法进行定值分析。
1.4.1 色谱条件
色谱柱:依利特ODS C18色谱柱(250 mm×4.6 mm,5 μm,大连依利特分析仪器有限公司);流动相:甲醇–水(体积比为90∶10),流速为1.0 mL/min;检测波长:450 nm;检测器:紫外检测器;进样体积:10 mL。
1.4.2 样品配制
打开样品瓶盖子后,精密称取岩藻黄质适量,用甲醇配制成质量浓度约为20 μg/mL的样品溶液,按照1.4.1色谱条件进行纯度检测,每个样品重复进样3次。
1.5 均匀性检验
按照 GB/T 15000.3–2008[6]规定,确定抽样数目为15个,采用单因素多水平试验方差分析法对岩藻黄质标准样品进行纯度均匀性检验,测定方法采用HPLC–UV法,每个样品重复测定3次。检测数据用方差分析法进行分析。
1.6 稳定性检验
为了考察样品的稳定性,确定其有效期,取本标准样品模拟上市包装,进行–18℃条件下的24个月长期试验。分别于0,6,12,18,24个月取样检测,通过考察标准样品纯度的变化来研究样品的稳定性。稳定性检测方法与均匀性检测方法相同,均采用HPLC–UV法,每份样品连续进样两次,然后用归一法求出其纯度的平均值。
2 结果与讨论
2.1 岩藻黄质的定性分析
岩藻黄质通过红外光谱、高分辨质谱及核磁共振谱进行定性分析[7]。
2.1.1 岩藻黄质的红外光谱分析
岩藻黄质的红外光谱数据见表1。红外光谱的数据解析说明结构中含有羟基(—OH),亚甲基 (—CH2—),酯键 (—COO—),α,β-不饱和羰基(—CH=CH—C=O),三元环醚,共轭双键以及反式双键,分别为岩藻黄质上特定的官能团,具体见表1。

表1 岩藻黄质红外光谱数据
2.1.2 岩藻黄质的高分辨质谱分析
岩藻黄质化合物加钠离子[C42H58O6+Na]+的理论精确质量数为681.4131,高分辨质谱测得的精确质量数为681.4137,两者数据一致,可以确认该化合物的分子式为C42H58O6。
2.1.3 岩藻黄质的核磁共振谱分析
化合物岩藻黄质的分子式为C42H58O6,则不饱和度Ω=14。通过分析13C NMR和DEPT谱图可知,14个不饱和度分别是由9个共轭双键、1个酮羰基、1个乙酰氧基、1个环氧和2个六元环组成。进一步对谱图进行分析可知,化合物岩藻黄质含有 11 个 CH3,5 个 CH2,2 个次甲基 (CH),3 个—CH= CH— ,4 个和2个羰基(C=O)以及5个季碳(C)。结合1H NMR和HMQC谱图,岩藻黄质含有 5个亚甲基 (CH2)。δ 2.59和 δ 3.65(d,J=18.4 Hz)可归属于7位碳上的两个质子;δ 1.35~1.41(m,1H)和δ 1.51(1H)可归属于六元环2位碳上的直立键和平伏键质子;δ 1.76(1H),δ 2.31 (1H)可归属于六元环4位碳上的直立键和平伏键质子;δ 1.48(1H),δ 2.00(1H)可归属于另一个六元环2'位碳上的直立键和平伏键质子;δ 1.54(1H),δ 2.30(1H)可归属于另一个六元环4'位碳上的直立键和平伏键质子。化合物含有2个饱和次甲基CH,即δ 3.82归属为3位质子,δ 5.38归属为3'位质子,另外还有11个不饱和双键上的次甲基质子在低场出现峰δ 7.16~6.06(11H),它们分别归属于 10,11,12,14,15,8',10',11',12',14',15'位 的 双 键 氢。10 个 甲 基质子单峰 δ 1.99×2,δ 1.94,δ 1.81(12H,s,CH3×4)和 δ 1.38,δ 1.35,δ 1.22,δ 1.07,δ 1.03,δ 0.96(18H,CH3×6) 分 别 归 属 于 20,20',19,19',18',16',18,17',16,17位的甲基。根据 HMBC 可知,峰 δ 2.04(s,CH3)归属于22'的甲基质子与21'的酯键组成的一个乙酰氧基片段,位于六元环直立键位置上。在13C NMR 和DEPT 中显示岩藻黄质含有11个CH3,5个 CH2,13个 CH 以及 13个季碳。HMQC谱显示11个CH3的碳原子与它们的质子对应,δ 25.0归属为16位碳,δ 28.1归属为17位碳,δ 21.1归属为18位碳,δ 11.8归属为19位碳,δ 12.9 归属为20位碳,δ 29.2归属为16'位碳,δ 32.1归属为17'位碳,δ 31.3归属为18'位碳,δ 14.0归属为19'位碳,δ 12.8归属为20'位碳,δ 21.4归属为22'位碳。5个CH2的碳原子与它们的质子对应,δ 47.1归属为2位碳,δ 41.6归属为4位碳,δ 40.8归属为7位碳,δ 45.4归属为2'位碳,δ 45.2归属为4'位碳。13个CH由2个—O—CH (δ 64.3归属为3位碳,δ 68.0归属为3'位碳)和11个烯碳组成,这11个烯碳是3个—CHCH—(δ 123.4归属为11位碳,δ 129.4归属为12位碳,δ 128.5归属为15位碳,δ 132.5归属为 15'位碳,δ 136.6归属为 11'位碳,δ 132.2 归属为 12'位碳 ),4 个(δ 139.1 归属为10位碳,δ 125.7归属为14位碳,δ 137.1归属为 10'位碳,δ 139.1归属为 14'位碳 )和 1个归属为8'位碳)。13个季碳中,2个为羰基的碳(δ 197.8归属为8位碳,δ 170.5归属为21'位碳);5个为饱和烷烃的季碳(δ 35.1归属为1位碳,δ 66.2归属为5位碳,δ 67.1归属为6位碳,δ 35.8归属为1'位碳,δ 72.6归属为5'位碳);5个为烯烃的季碳(δ 134.5归属为9位碳,δ 135.4归属为13位碳,δ 132.5归属为9'位碳,δ 138.1归属为13'位碳,δ 117.5归属为6'位碳)和1个双烯碳 (δ 202.3 归属为 7'位碳 )。
HMBC谱显示2位碳与16,17位质子有相关;4位碳与3,18位质子有相关;8位碳与7,10,19位质子有相关;11位碳与10,12位质子有相关;1'位碳与 16',17'位质子有相关;20'位碳与 12',14'位质子有相关。其余碳与质子的相关性均证实了前述碳与质子的归属。
综上所述,样品的核磁共振氢谱给出了甲基、亚甲基、次甲基、羰基等信息,各质子的化学位移值与文献一致;核磁共振碳谱、DEPT、HMQC、HMBC谱显示碳的类型与该化学结构相符,相关谱均有合理对应点,各碳的化学位移值与文献一致[8–9],结果见表2。
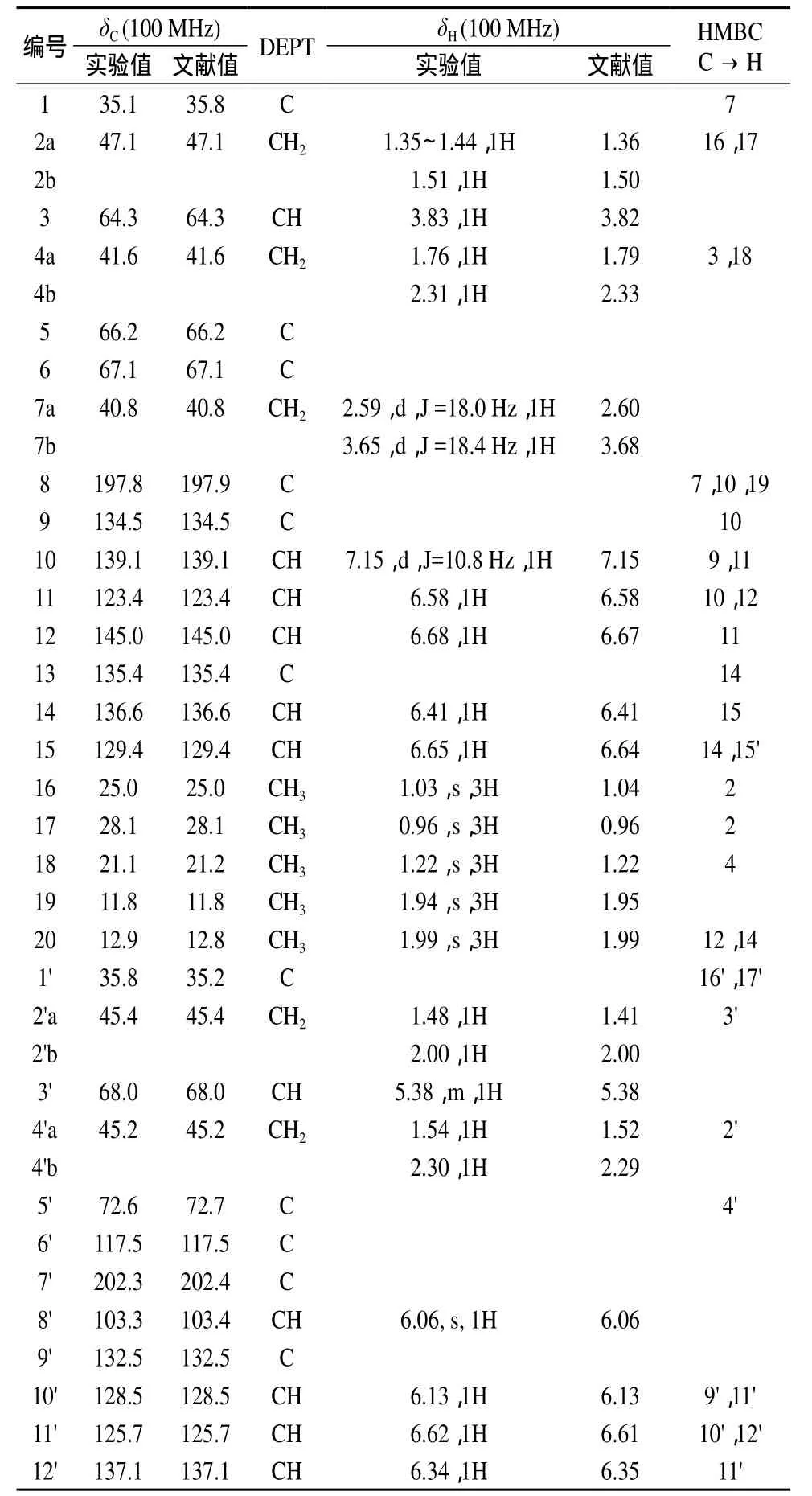
表2 岩藻黄质的核磁共振数据

续表2
综上所述,从样品的红外光谱、高分辨质谱和核磁共振谱证明了所研制的样品是岩藻黄质。
2.2 均匀性试验
标准样品的均匀性检验是标准样品研制过程中不可缺少的程序,因此在对样品进行分装后,对岩藻黄质标准样品进行纯度均匀性检验,均匀性检验结果与方差分析结果分别见表3、表4。

表3 岩藻黄质标准品纯度均匀性检验结果 %

表4 方差分析结果
2.3 稳定性试验
取本标准样品,模拟上市包装,在温度为–18℃的条件下放置 24 个月,分别于 0,6,12,18,24 个月取样,按稳定性重点考察项目检测,试验结果见表5。根据GB/T 15000–2008 《标准样品工作导则(3)标准样品定值的一般原则和统计方法》的要求,采用直线模型作为经验模型,对长期稳定性获得的数据进行分析。

表5 岩藻黄质样品在–18℃储存条件下的稳定性
斜率:

式中:Y = 99.4020,X=12。
截距:b0= Y - b1X = 99.3600。直线上点的标准偏差:
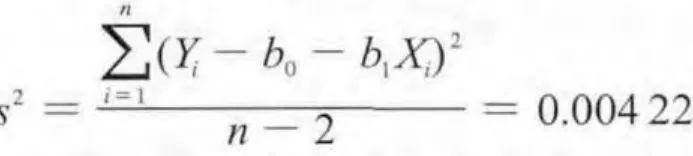
则s=0.064 897%,与斜率相关的不确定度:

自由度为n–2和95%置信水平的t因子t0.95,n-2= 2.776。t0.95,n-2s(b1)= 0.009 556, 由 于,故斜率是不显著的,因而未观测到不稳定性。
长期试验稳定性的不确定度:
usts=s(b1)t=0.003 425×24=0.09%
稳定性试验结果表明,岩藻黄质在–18℃下保存2年仍稳定。
2.4 定值结果及其不确定度评定
岩藻黄质的检测有HPLC–UV法[10]、紫外分光光度法[11]。但是尚无统一的国家标准或行业标准,由于分光光度法灵敏度较低,且主要是检测一类物质,而高效液相色谱法灵敏度较高,且具有较强的专属性,因此采用高效液相色谱–紫外检测法[10]进行定值分析。
2.4.1 定值结果
本标准样品按照GB/T 15000.3–2008标准要求,采用多个实验室协作定值,选择获得国家或部门认可的具备资质的8家实验室进行样品定值。随机抽取8瓶样品,每家实验室送1瓶,采用HPLC–UV法进行测定,应用面积归一法进行定值,定值结果见表6。

表6 定值结果汇总 %
汇集各家实验室的检测数据后,对每家实验室的数据按大小顺序排列,用Grubb’s法和峰度法正态性检验组内数据的异常值,结果没有异常值。所有数据再用Grubb’s法对每家实验室的平均值进行检验,将其看成一组测定值进行异常值检验,结果无异常值。因此将各家实验室测得的数据作为无偏估计值,计算8家测定结果的平均值及标准偏差。然后对各实验室测定结果的标准偏差s进行Cochran检验,计算统计量:

式中:si——各实验室测定结果的标准偏差;
smax——si中的最大值。
C8,6(0.05)=0.668,C > C8,3(0.05),表 明 各 实 验 室间的测量不属于等精度测量,因此计算加权平均值作为岩藻黄质标准样品的定值结果,总平均值x=99.53%。
2.4.2 定值结果的不确定度评定
根据GB/T 15000.3–2008标准规定,定值结果由标准值和不确定度组成。标准样品特性标准值的测量不确定度u由标准值定值试验的不确定度ux、均匀性检验的不确定度ubb、稳定性检验引入的不确定度usts组成。依据全部测定结果,计算岩藻黄质标准样品的特性标准值和不确定度。
(1)标准值定值试验引入的不确定度ux,按照加权法计算得到标准样品定值的不确定度ux=0.05%。
(2)均匀性检验引入的不确定度ubb。瓶间方差:

式中 MSamong,MSwithin来自表 4。
瓶间标准偏差:ubb=sA=0.03%。
(3)稳定性检验引入的不确定度usts。由2.3稳定性检验可知usts=0.09%。标准样品定值结果的不确定度:
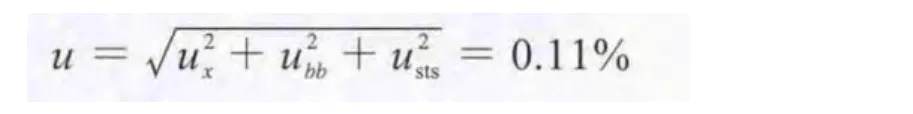
扩展不确定度:U95=ku=1.96×0.11%=0.22%。岩藻黄质标准样品的特性值定值结果:99.53%±0.22%(置信度为95%,k=1.96)
3 结语
研制了岩藻黄质标准样品,对其进行了均匀性检验、稳定性考察,考察结果表明该标准样品符合标准样品均匀性与稳定性的要求。研制的岩藻黄质标准样品对岩藻黄质相关制剂等方面的测量和科学研究提供了技术支撑和量值溯源保证。
[1] 汤洁.用超临界CO2技术制备岩藻黄质的方法[P].中国:200810168283.5,2009–6–3.
[2] Koyagagi S, Tanigawa N, Nakagawa H, et al. Oversulfation of fucoidan enhances its anti-angiogenic and antitumor activities[J].Biochem Pharmacol, 2003,65: 173–179.
[3] Hosokawa M, Kudo M, Maeda H, et al. Fucoxanthin induces apoptosis and enhances the antiproliferative effect of the PPARγligand,troglitazone,on colon cancer cells[J]. Biochim Biophys Acta,2004,1675: 113–119.
[4] Das S K, Hashimoto T, Shimizu K, et al. Fucoxanthin induces cell cycle arrest at G0/G1 phase in human colon carcinoma cells through up—regulation of p21WAF1/Cip1[J]. Biochim Biophys Acta,2005,1 762: 328–335.
[5] Kil N K, Soo J H, Sung M K, et al. Fucoxanthin induces apoptosis in human leukemia HL–60 cells through a ROS-mediated Bcl–xL pathway[J]. Toxicology in Vitro, 2010,24: 1 648–1 654.
[6] GB/T 15000.3–2008 标准样品工作导则(3)标准样品 定值的一般原则和统计方法[S].
[7] 陈晖,方华,张怡评,等.海藻糖标准样品的研制[J].化学分析计量,2015,24(1): 1–4.
[8] Soo J H,Seok C K,Sung M K. Cytoprotective effect of fucoxanthin isolated from brown algae Sargassum siliquastrum against H2O2–induced cell damage [J]. Eur Food Res Technol,2008,228: 145–151.
[9] Jarle A H,Gerhard E,Ernst G,et al. Algal carotenoids 48 structural assignments of geometrical isomers of fucoxanthin [J]. Acta Chemica Scandinavica, 1992, 46: 389–395.
[10] 尹尚军,徐涛,刘丽平,等.羊栖菜岩藻黄质的提取工艺研究[J].食品工业科技,2011,32(4): 272–275.
[11] 肖策.海带中岩藻黄质、岩藻甾醇、甘露醇和褐藻糖胶的综合提取纯化工艺研究[D].西安:西北大学,2008.

