不同血液净化方式对尿毒症患者透析效果的影响
谷 粒,徐秀蓉
(成都大学附属医院肾脏内科,四川成都610081)
不同血液净化方式对尿毒症患者透析效果的影响
谷 粒,徐秀蓉
(成都大学附属医院肾脏内科,四川成都610081)
目的观察3种不同血液净化方式[血液透析(HD)、血液透析滤过(HDF)、HD联合血液灌流(HP)]对维持血液透析(MHD)患者高磷血症的清除效果。方法将2013年6月至2014年5月收治的65例MHD患者按透析方案分为HD组(23例)、HDF组(22例)、HD联合HP组(20例),以透析12周为1个疗程,分别检查入选时及透析4、12周各组患者全段甲状旁腺素、血磷、血钙、血肌酐等指标变化。结果透析4、12周后HDF组、HD联合HP组患者血磷显著下降,差异均有统计学意义(P<0.05),两组患者透析后同时间点比较,差异均无统计学意义(P>0.05);透析后HD组患者血磷无明显变化,差异无统计学意义(P>0.05)。结论HDF、HD联合HP清除MHD患者高磷效果显著,而HD效果则不佳。
高磷血症; 肾透析; 血液透析滤过; 血液灌注
随着透析技术的发展,尿毒症患者存活期不断延长。随患者肾脏功能的进行性下降,肾小球滤过率降低导致钙、磷代谢紊乱,骨代谢异常,以致继发性甲状旁腺功能亢进,如不及时处理,可进一步引起潜在心血管事件风险增加。对维持血液透析(maintenance hemodialysis,MHD)患者进行调查后发现,心、脑血管疾病是该类患者的主要死因,其中心血管系统钙化是引起心血管疾病高发和患者死亡的重要因素之一[1]。血磷水平是预测心脏瓣膜钙化、颈动脉内膜-中膜增厚和冠状动脉钙化的独立危险因素[2]。因此,维持适当血钙、血磷、甲状旁腺素水平可降低左心室质量指数,已成为改善MHD患者生活质量和延长寿命的重要方法[3]。当前,控制高磷血症通常采取以下方法:(1)限制饮食中磷的摄入;(2)口服肠道磷螯结合剂;(3)通过透析清除磷。然而,临床工作中观察到通过限制饮食中磷含量和(或)使用肠道磷螯结合剂,患者血磷控制仍不理想。因此,应根据患者情况采取不同透析方式促进磷的排出。本研究回顾性分析了2013年6月至2014年5月本科血液净化中心收治的65例MHD患者临床和透析资料,观察不同血液净化方式清除血磷的效果,现报道如下。
1 资料与方法
1.1 一般资料 选择2013年6月至2014年5月本科血液净化中心收治的MHD患者65例,维持血液透析时间均大于或等于4个月,患者均有不同程度皮肤瘙痒、骨痛。其中男42例,女23例;年龄33~86岁,平均(59.4± 13.9)岁。行血液透析时间4~96个月,平均(19.6±18.7)个月。慢性肾小球肾炎10例,高血压小动脉性肾硬化15例,糖尿病肾病19例,梗阻性肾病2例,尿酸性肾病1例,原因不明18例。其中51例患者口服阿法骨化醇(以色列梯瓦制药工业有限公司,批号:A48083)0.5 μg,每天1次;碳酸钙(商品名:钙尔奇,惠氏制药有限公司,批号:J02899)1片,每天1次;根据病情口服降压药及纠正贫血、营养支持等。
1.2 研究方法 对65例患者透析资料进行相关分析。本研究血液透析(hemodialysis,HD)、血液透析滤过(hemodiafiltration,HDF)均采用一次性高通量聚醚砜膜透析器,膜面积1.5 m2;血液灌流(hemoperfusion,HP)采用雪净一次性使用血液灌流器。患者入选前均每周行3次HD,将65例患者按透析方案随机分为HD组(23例,每周行3次HD)、HDF组(22例,每2周行5次HD及1次HDF)、HD联合HP组(20例,每周行6次HD,每2周行1次HP串联HD)。HD与HDF每次透析治疗4.0 h,HD联合HP每次透析治疗2.0h。血流量200~280mL/mim,平均(242.3±25.8)mL/min;透析液流量500 mL/min。透析用水采用高纯度离子反渗水,采用碳酸氢盐透析,用低分子肝素钙抗凝,透析器不复用。透析12周为1个疗程,观察入选时,透析4、12周各组患者全段甲状旁腺素(intact parathyroid hormone,iPTH)、血钙、血磷等指标变化。
1.3 统计学处理 应用SPSS10.0统计软件进行数据分析,计量资料以±s表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 三组患者入选时各检测指标比较 三组患者入选时iPTH、血钙、血磷等检测指标比较,差异均无统计学意义(P>0.05),见表1。
表1 三组患者入选时各检测指标比较(±s)
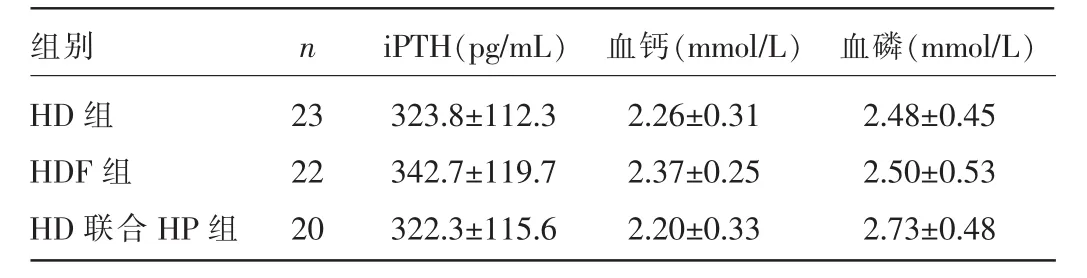
表1 三组患者入选时各检测指标比较(±s)
组别HD组HDF组HD联合HP组n iPTH(pg/mL) 血钙(mmol/L) 血磷(mmol/L)23 22 20 323.8±112.3 342.7±119.7 322.3±115.6 2.26±0.31 2.37±0.25 2.20±0.33 2.48±0.45 2.50±0.53 2.73±0.48
2.2 三组患者透析4、12周后各检测指标变化比较 透析4、12周后HD组患者iPTH、血钙、血磷无明显变化,差异均无统计学意义(P>0.05)。HDF组、HD联合HP组患者iPTH、血磷显著下降,差异均有统计学意义(P<0.05),而血钙无明显变化,差异均无统计学意义(P>0.05),两组患者透析后同时间点各检测指标比较,差异均无统计学意义(P>0.05)。HDF组、HD联合HP组同时间点iPTH、血磷比较,差异有统计学意义(P<0.05),见表2。3讨 论
表2 三组患者入选时,透析4、12周各检测指标比较(±s)

表2 三组患者入选时,透析4、12周各检测指标比较(±s)
注:与同组入选时比较,aP<0.05,bP<0.01;与HD组同同时点比较,cP<0.05。
组别HD组入选时透析4周透析12周HDF组入选时透析4周透析12周HD联合HP组入选时透析4周透析12周iPTH(pg/mL) 血钙(mmol/L) 血磷(mmol/L)323.8±112.3 327.5±116.3 330.8±120.6 2.26±0.31 2.24±0.29 2.29±0.31 2.48±0.45 2.50±0.37 2.52±0.35 342.7±119.7 305.1±104.2ac268.7±99.8bc2.37±0.25 2.35±0.24 2.35±0.31 2.50±0.53 2.03±0.23ac1.82±0.16bc322.3±115.6 286.4±97.6ac252.1±86.2bc2.20±0.33 2.22±0.31 2.25±0.29 2.73±0.48 2.16±0.28ac1.75±0.12bc
正常情况下,人体血磷处于稳定状态,通过肾脏排泄70%,肠道排泄30%。肾小球滤过率下降,肾小管将代偿性对磷重吸收减少,促使磷排出增加,进而维持正常血磷水平,但当肾功能进一步下降(肾小球滤过率小于25 mL/min),肾脏将不能进一步增加磷的排出,出现高磷血症[4]。高磷血症在肾性骨病、继发性甲状旁腺功能亢进的发病机制中具有重要作用,其还可以使骨外软组织出现钙化,特别是血管、心肌、冠状动脉系统,进一步导致心血管事件的发生。在对MHD患者的调查研究中发现,高血磷与MHD患者病死率密切相关。Mccullough等[5]对20年来 30例慢性肾脏病(chronic kidney disease,CKD)及软组织钙化患者相关临床研究的系统回顾性分析发现,血管钙化在CKD患者中非常常见,主要与透析持续时间和高龄有关。Block等[6]对36 407例HD患者回顾性分析发现,血磷每上升0.32 mmol/L,CKD患者相对死亡危险性增加6%,通过校正患者合并疾病、顺应性差和营养参数、尿素清除指数等指标后,血磷大于2.1 mmol/L患者较血磷0.8~2.1 mmol/L患者的死亡危险性增加27%。
CKD 4~5期患者血磷水平逐渐升高,CKD 5期后清除磷的有效方法之一就是透析。但在透析过程中对磷清除的速度远快于磷从细胞内释放进入血的速度,因此,常规HD不能充分清除磷,HD平均4 h仅能清除700~1 000 mg磷[7]。日常摄入磷的总量远高于透析清除的磷,故透析效果有限。Achinger等[8]指出,短时间进行每天透析(每周透析5~6次,每次透析1.5~2.5 h)或夜间透析(每周透析5~7次,每次透析6.0~8.0 h)均能控制血磷达到目标水平。但以上透析方式均还在试验阶段,未大规模应用于临床。
本研究采取HD、HDF、HD联合HP 3种不同血液净化方式降血磷,比较了三者降磷效果。HDF组、HD联合HP组患者透析4周后iPTH、血磷均显著下降,差异均有统计学意义(P<0.05),12周后下降更加明显,差异有统计学意义(P<0.01);两组患者透析后同时间点各检测指标比较,差异均无统计学意义(P>0.05),两组患者透析后同时间点各检测指标与HD组比较,差异均有统计学意义(P<0.05)。表明HD清除血磷效果欠佳,而采用HDF及HD联合HP能有效降低血磷。有学者曾指出,HDF主要是通过对流的方式清除中、大分子物质,采取后稀释法可进一步提高溶质的清除[9-10]。HP降低血磷是因为活性炭吸附了磷,因此,在临床应用中能显著清除透析患者体内的中、大分子物质。因此,HDF和HD联合HP均能显著清除血磷。
CKD患者,尤其是MHD患者高磷血症是常见、难治的并发症之一,其与肾性骨病、继发性甲状旁腺功能亢进症、心瓣膜钙化、冠状动脉病变等多种并发症密切相关,大大降低了CKD患者的生活质量,是病死率增加的重要原因之一[11-12]。本研究结果虽显示HDF和HD联合HP均能有效清除血磷,但活性炭也可能吸附营养素,导致营养素丢失,因此,长期使用活性炭的影响尚需进一步评估[13]。
[1]王梦婧,陈靖.磷代谢与慢性肾脏病[J].肾脏病与透析肾移植杂志,2011,20(6):548-553.
[2]Ishimura E,Taniwaki H,Tabata T,et al.Cross-sectional association of serum phosphate with carotid intima-medial thickness in hemodialysis patients[J].Am J Kidney Dis,2005,45(5):859-865.
[3]Meeus F,Kourilsky O,Guerin Ap,et al.Pathophysiology of cardiovascular disease in hemodialysis patients[J].Kidney Int Suppl,2000,76:S140-147.
[4]罗群.终末期肾功能衰竭患者高磷血症治疗进展[J].现代实用医学,2014,16(12):697-698.
[5]Mccullough PA,Sandberg KR,Dumler F,et al.Determinants of Coronary vascular calcification in patients with chroaic kidney disease and end-stage rend disease:a systematic review[J].J Nephrol,2004,17(2):205-215.
[6]Block GA,Hulbert-shearon TE,Levin NW,et al.Association of Serum phosphorus and calcium X phosphate product with mortality risk in chronic hemodialysis patients:a national study[J].Am J Kidney Dis,1998,31(4):607-617.
[7]Kuhlmann MK.Management of hyperphosphatemia[J].Hemodial Int,2006,10(4):338-345.
[8]Achinger SG,Ayus JC.The role of daily dialysis in the control of hyperphospatemia[J].Kindney Int Suppl,2005(95):S28-32.
[9]尹道馨,张东亮,刘文虎.血液透析滤过在维持性透析患者中的临床应用[J].首都医科大学学报,2009,30(2):154-160.
[10]Davenport A,Gardner C,Delaney M,et al.The effect of dialysis modality on Phosphate control:haemodialysis compared to heemodiafiltration[J]. The Pan Thames Renal Audit[J].Nephrol Dial Transplant,2010,25(3):897-901.
[11]Foley RN,Collins AJ,Herzog CA,et al.Serum Phosphorus levels associate with coronary atherosclerosis in yong a-dults[J].J Am Soc Nephrol,2009,20(2):397-404.
[12]Isakova T,Gutierrez OM,Chang Y,et al.Phosphorus binders and survival on hemodialysis[J].J Am Soc Nephrol,2009,20(2):388-396.
[13]左力.怎样控制透析患者的血磷水平[J].中国血液净化,2011,10(3):117-118.
Different hemopurification's influence on dialysis result of uremia patients
Gu Li,Xu Xiurong
(Department of Nephrology,Affiliated Hospital of Chengdu University,Chengdu,Sichuan 610081,China)
ObjectiveTo observe 3 different ways of hemopurification′s[hematodialysis(HD),hemodiafiltration(HDF),HD combining hemoperfusion(HP)]clearing effect on maintaining hematodialysis(MHD)patients′hyperphosphatemia.MethodsDivided 65 MHD patients into HD group(n=23),HDF group(n=22),HD combining HP group(n=20)according to dialysis plan. Set 12 weeks as 1 course of dialysis treatment.Examined patients′intact parathyroid hormone,serium inorganic phosphorus,blood calcium,and serum creatinine when they were selected and on 4,12 weeks.ResultsHDF group and HD combining HP group′s serium inorganic phosphorus notably reduced after 4 and 12 weeks of dialysis,differences showing statistical significance (P<0.05).Compared 2 groups at the same time after dialysis,differences showing no statistical significance(P>0.05).HD group′s serium inorganic phosphorus had no significant change,differences showing statistical significance(P<0.05).ConclusionUsing HDF and HD combining HP can remarkably clear MHD patients′hyperphosphate,while HD has poor effect.
Hyperphosphatemia; Renal dialysis; Hemodiafiltration; Hemoperfusion
10.3969/j.issn.1009-5519.2015.12.009
:A
:1009-5519(2015)12-1785-02
2015-02-09)
谷粒(1980-),女,四川内江人,主治医师,主要从事肾脏内科临床/血液透析工作;E-mail:19040489@qq.com。

