磷脂跨膜交换机制的研究
薛永培, 梁化兰, 尼亚孜别克, 蒋中英,2
(1. 伊犁师范学院电子与信息工程学院, 伊宁 835000; 2. 新疆大学物理科学与技术学院, 乌鲁木齐 830046)
磷脂跨膜交换机制的研究
薛永培1, 梁化兰1, 尼亚孜别克1, 蒋中英1,2
(1. 伊犁师范学院电子与信息工程学院, 伊宁 835000; 2. 新疆大学物理科学与技术学院, 乌鲁木齐 830046)
膜间磷脂交换是一项重要的生理活动, 其对药物运输及膜功能研究有重要意义. 本文用石英晶体微天平及耗散系数测试仪研究囊泡与囊泡、囊泡与支撑膜间磷脂交换行为, 荧光光谱仪用来测量膜表面电性与膜组分对磷脂交换的影响. 实验结果表明: 磷脂跨膜交换速率与交换时间成反比, 膜表面异电性磷脂的增加会加速膜内相互作用和磷脂跨膜交换速率, 以及改变膜表面组分会对囊泡与支撑膜间的磷脂交换产生影响. 本文研究有助于加深理解磷脂跨膜交换机制, 并对药学研究提供参考.
石英晶体微天平; 支撑膜; 带电磷脂; 交换速率
1 引 言
细胞是一切生物体的基本组成单元, 而细胞膜在其中起着重要的作用, 它与许多生命现象和生命活动都息息相关, 是能量转换、物质运输、生物传感和信号传导得以进行的重要场所. 然而由于细胞膜的结构较为复杂, 实验通常建立结构简单的模型用来研究其结构, 这些模型包括小单层囊泡(SUVs), 大单层囊泡(GUVs)[1]支持磷脂双层膜等. 生物膜中、不同的磷脂组分直接影响不同的膜功能, 为了维持膜内磷脂组分的恒定, 需要在生物膜之间进行磷脂跨膜交换. 磷脂的跨膜交换是保持膜功能的一项重要生命活动. 此外, 膜内磷脂跨膜交换也运用于药物传递, 这些以磷脂为基的药物传递系统与膜间相互作用及磷脂交换紧密联系.
研究不同的生物膜体系有助于理解磷脂跨膜交换机制, 异电性磷脂膜间的平衡磷脂交换量与磷脂交换速率已被深入研究, 之前的研究中, 采用吸附囊泡与支撑膜体系, 也对磷脂跨膜交换有了一定的理解. 早在1960年, Mueller等[2]开发了平面磷脂是双层膜电学性质的研究体系, Saeki等[3]发现异电性膜间的静电吸引作用是实现磷脂交换的主要因素, MacDonald等[4]已通过使用荧光显微镜和离子谱用来研究磷脂在囊泡间交换的动力学过程, 实验研究正、负电性磷脂膜间的平衡交换量和磷脂交换的速率, 并首次引入半融合膜结构解释膜之间的磷脂交换行为. Parikh等人使用盐离子强度调节器改变胶体磷脂双层间的静电相互作用[5]和磷脂交换程度. 虽然前人的研究结果提出了许多有价值的结论, 但是磷脂跨膜交换机制仍然存在很多疑问. 例如, 磷脂膜间的接触实验的研究仍处于初级阶段, 对于磷脂跨膜交换过程中的膜结构认识也有待提高, 除此之外, 膜曲率的影响机制及磷脂相对跨膜机制也有待深入的探索.
本实验中, 我们使用石英晶体微天平及耗散系数测量仪(QCM-D)表征膜表面电性及膜组分对磷脂跨膜过程的影响. 石英晶体微天平是一种新型的超微量分析仪器, 它具有灵敏度高、实时、快捷、简便等特点, 可以用以表征膜表面吸附量、膜表面分子的相互作用以及膜体系形貌的变化过程, 广泛应用于生物化学等各个领域. 荧光光谱仪具有灵敏度高、选择性强、样品用量少和方法简便等优点, 是基础研究和实际应用的有效工具. 在此用来测量膜表面电性和组分对磷脂跨膜交换的影响. 实验阐述了磷脂交换过程中支撑膜与囊泡之间的最大膜接触面积的控制机制. 本研究有助于理解磷脂跨膜交换与运输的行为, 对脂质体作为药物传输载体提供了参考, 有助于深入理解生物膜的特殊功能.
2 实验部分
2.1 实验材料
实验用的二油酰基磷脂酰胆碱(DOPC)、二棕榈酰磷脂酰胆碱(DPPC)、二油酰基磷脂酰丝氨酸(DOPS)与二油酰基三甲氨基丙烷(DOTAP)均购于Avanti Polar Lipids公司. DOPC, DPPC均为双电性磷脂. DOTAP, DOPS分别为带正电和带负电的磷脂. 其分子结构式如图1所示. 所使用化学试剂均属于分析纯级, 且在使用前都未被进一步提纯. 在25℃条件下制备100nM TRIS缓冲溶液, 逐滴滴加100nM NaCl的盐酸水溶液调节PH值至7.4. 实验用水为经过Milli-Q (购于美国Millipore Co)离子交换净化系统所得的超纯水, 其最小电阻率为18.
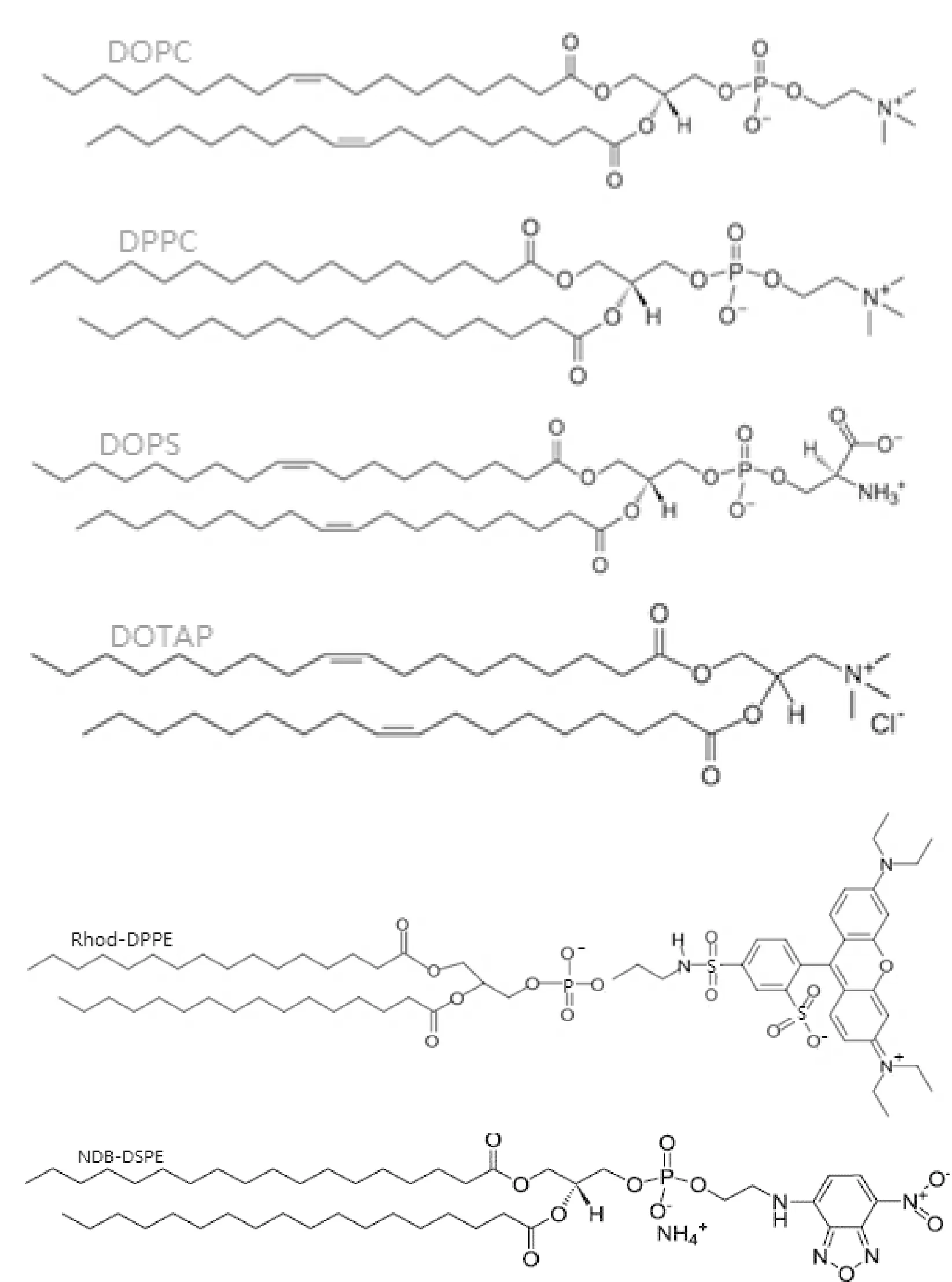
图1 DOPC, DPPC, DOPS, DOTAP, Rhod-DPPE, NOB-DSPE的分子式Fig.1 Formulas of DOPC, DPPC, DOPS, DOTAP, Rhod-DPPE, and NOB-DSPE
2.2 囊泡制备
实验通过挤出法制备囊泡. 氮气通入通风厨内, 通过在容器内蒸发磷脂(200(L)氯仿溶液(3.5 mg/mL)制备磷脂膜. 室温条件下容器被储藏在真空干燥箱一夜以去除氯仿杂质. 为了制备脂质体, 实验温度增加至50℃且通过增加1 mL缓冲液并不时摇动3 h达到再水化. 使用挤压器(Avanti Polar Lipids)挤压悬浮液. 使用滤膜孔径为100 nm或30 nm的挤压器并循环挤压50次得到单层囊泡溶液, 将其放置在新的容器内, 温度保持为4℃, 使用前稀释, 溶液在两天内使用.
2.3 测量囊泡尺寸
纳米粒度分析仪 (NanoSight LM10公司)测量囊泡尺寸. 实验在20℃条件下进行. 测量得到由100nm孔径的滤膜挤出的囊泡, 其流体力学半径为56±6 nm(标准误差), 然而由30 nm孔径的滤膜挤出的囊泡, 其流体半径为17±4 nm(图2).
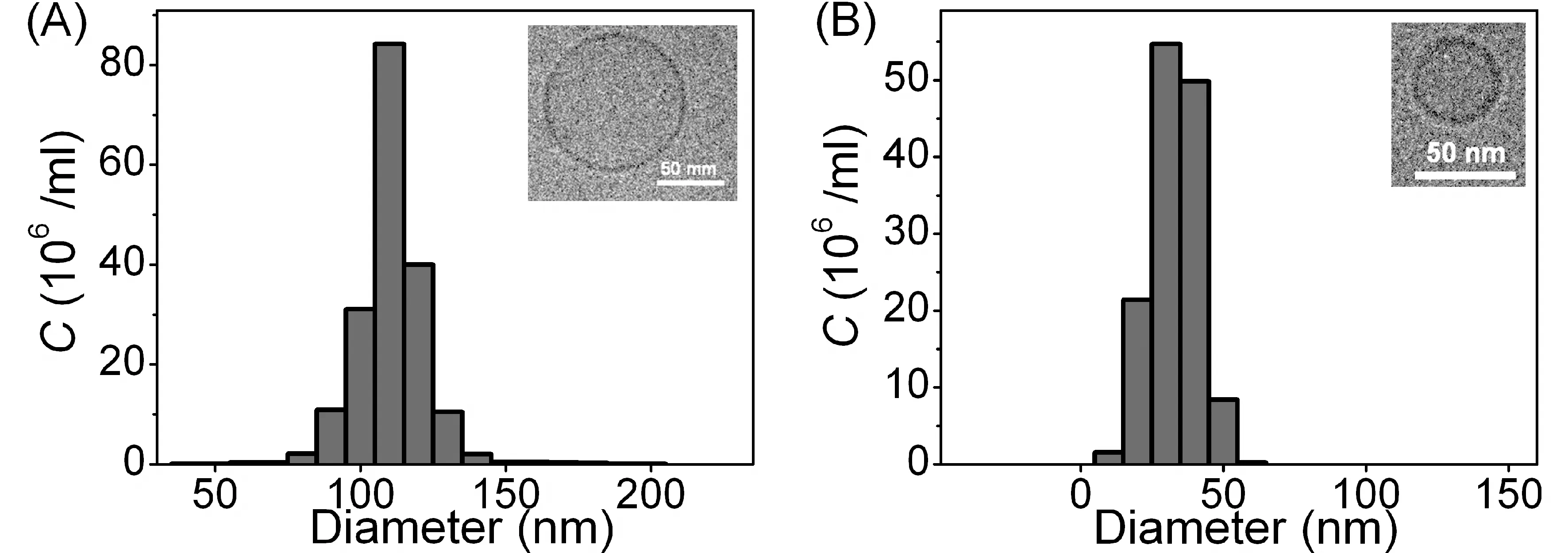
图2 纳米粒度分析仪测量的囊泡, 其尺寸(直径)作为浓度(C)的函数.挤出孔径滤膜分别为(A)100 nm和(B)30 nm.相应的冷冻电镜显微图如右上方所示Fig.2 Nanometer particle size of vesicle measured by the nanometer particle size analyzer, its size (diameter) is seen as a function of the concentration (C). Extrusion aperture membrane are, respectively, (A) 100 nm and (B) 30 nm. The corresponding frozen electron microscopy micrographs are shown in the upper right
2.4石英晶体微天平耗散测试仪
石英晶体微天平耗散测试仪(QCM-D)测量了吸附物的共振频率偏移值(Δf)和能量耗散偏移值(ΔD). 与吸附物质量(Δm)符合Sauerbrey关系[6]:
Δm=CQCMΔf=CQCMΔfn/n
(1)
其中是Δfn晶体质量感应常数, 是在n次倍频后的共振频率偏移值, 与吸附物的粘滞系数有关. 如果吸附物的力学性质与牛顿流体性质相似(如小单层囊泡SUV), 则值较大.如果其物理性质趋近于固体性质(如磷脂支撑膜SLB), 则值较小.
在25℃时, 磷脂交换实验在QCM-D流动仓E1(QsenseAB)内进行. 实验使用基频为5MHz的SiO2涂层传感晶体. 首先, 缓冲液注入舱内直到保持稳定; 其次, 正电性磷脂膜形成支撑膜; 再次, 通过缓冲液冲洗剩余的囊泡; 然后, 正电性磷脂支撑膜与负电性囊泡在静电吸引膜上进行跨膜交换. 交换之后, 再次通入缓冲溶液. 至少重复三次直至误差为标准偏差. 实验中所有和的倍频数均为7.
2.5 荧光光谱仪测量
荧光光谱仪(PerkinElmer LS 55)基于荧光共振能量转移技术测量能量供体(NBD-DSPE)与能量受体(Rhod-DPPE)间的平衡磷脂交换量[7]. 实验中所用囊泡有二种, 一种以0.5 mol%NBD-DSPE和0.5 mol%Rhod-DPPE标记, 另一种囊泡未用荧光标记. 激发波长为460 nm. 测量20 μL, 1 mM未标记的囊泡溶液滴加至2 mL, 0.001 mM的标记溶液滴加80 mins之后的荧光行为. 计算反应磷脂交换量的能量转移效率(E), 基于公式: E=IR/IN, 其中, IR和IN分别为Rhod-PE (λem= 589 nm)和NBD-DSPE (λem= 543 nm)的荧光峰值. 磷脂之间的膜交换会增加标记供体和受体探针的平均距离, 能量效率E也随之增加. 实验条件与QCM-D的实验条件保持一致, 被标记囊泡对应支撑膜, 未标记囊泡对应囊泡.
3 结果与讨论
3.1 膜内磷脂交换速率与最大总接触面积
通过QCM-D表征正电性支撑膜和带负电的囊泡之间的交换行为. 图3为Δf和ΔD随时间t变化的曲线图. 支撑膜形成过程(Ⅰ), 首先-Δf和ΔD增加, 表示囊泡吸附在SiO2表面. 随后-Δf和ΔD降低, 表明囊泡破裂形成刚性片状磷脂双层. 最后, 作为完整囊泡的标准值, 分别平衡在(-22.0±1.5)Hz和(3.4±1.8)×10-7Hz. 磷脂交换过程(Ⅱ), 首先-Δf和ΔD增加, 表明带负电的囊泡开始吸附在支撑膜上. 随后-Δf和ΔD降低, 表明在支撑膜与囊泡交换之后支撑膜与囊泡之间的静电吸引作用逐渐降低, 吸附质量由囊泡的解析附过程主导. 最后, 值稳定在(-22.3±2.0) Hz和(5.4±2.6)×10-7Hz. 大部分囊泡在磷脂交换最后被解吸附. Kasemo等人已通过QCM-D, 反射计法及荧光显微镜研究了支撑膜-吸附-诱导磷脂交换的过程.
实验中定义的tint与-Δfmin分别与磷脂交换的动力学条件和物理条件有关, 如图3所示. tint表示支撑膜与囊泡在磷脂跨膜过程中作用的时间. 固定磷脂交换量, tint与膜内磷脂交换速率成反比. 由于表征支撑膜与囊泡间的磷脂交换量较为困难, 实验通过荧光光谱仪测量正电性与负电性囊泡之间的磷脂交换量而不考虑交换的程度. -Δfmin表示过程(Ⅱ)中的最大值即囊泡吸附到支撑膜上的最大量. 假设与单一囊泡吸附的质量增量成正比, 与膜内囊泡吸附的接触面积的增量成正比, -Δfmin反映当囊泡尺寸恒定时, 磷脂交换过程中支撑膜与囊泡之间的最大接触面积. 图4 显示了磷脂交换过程的示意图以及两种类型的囊泡交换前和80 mins之后的相应能量E值. 能量值E在交换后下降的很快, 表明磷脂交换发生在膜之间.
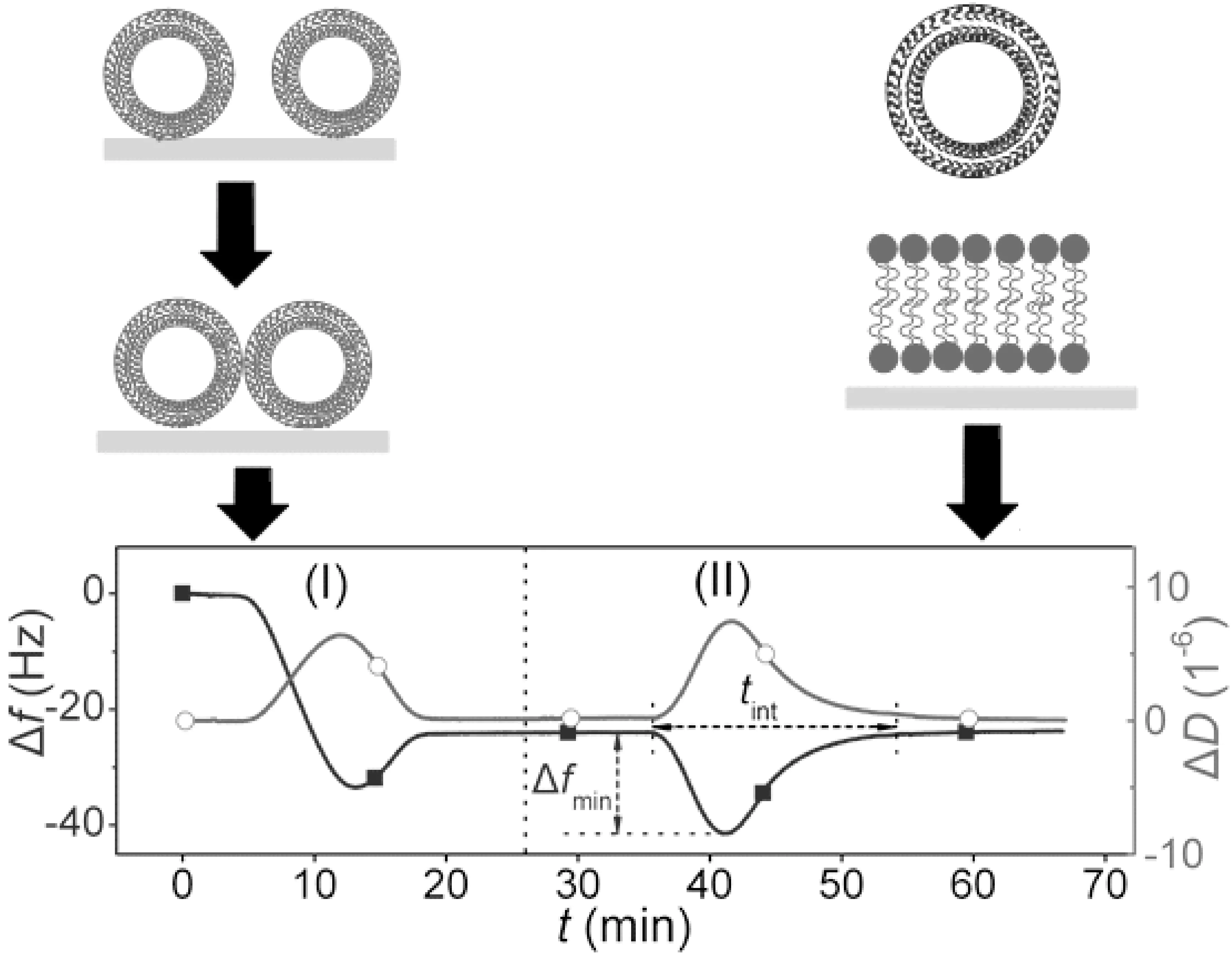
图3 实验用QCM-D法测量磷脂交换的Δf-t, ΔD-t的曲线. 曲线(Ⅰ)表明正电荷磷脂囊泡吸附在SiO2表面从而形成支撑膜. 曲线(Ⅱ)表明负电性囊泡与之前的支撑膜交换磷脂, 阐明了相应的磷脂组装在SiO2表面及定义了Δfmin和tint Fig. 3 Δf-t and ΔD-t curves of phospholipids exchange measured by QCM method, Where Curve (Ⅰ) shows that positive charge phospholipid vesicles are adsorpted on the surface of SiO2,which form to the supporting membrane,and Curve (Ⅱ) shows electronegative vesicles exchange phospholipids with the supporting membrane, illustrating the corresponding phospholipid assembles on the surface of SiO2 and defining Δfmin and tint
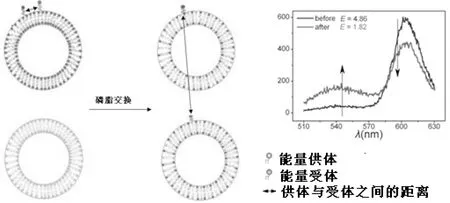
图4 磷脂交换示意图及两种类型的囊泡混合前与混合80 mins之后的荧光光谱图Fig. 4 Phospholipids exchange figure and fluorescence spectrum figure of two types of vesicles which are before mixing and after mixing for 80 mins
3.2 膜表面电荷效应
通过改变DOTAP/DOPC与支撑膜混合及DOPS/DOPC与囊泡混合的带电磷脂组分比率研究膜表面电性对磷脂交换的影响. 如图5所示, 能量值E随着带电磷脂组分的增加而增加. 这表明增加膜表面电荷可以增加平衡磷脂交换量, 也就是说异电性磷脂膜可以中和膜表面势垒以致达到交换平衡. 如图6所示, 支撑膜或囊泡的带电磷脂组分增加30%, 使得tint缩短10-68%, 说明了膜表面电荷的增加会加速支撑膜与囊泡之间的磷脂交换速率. 这一结果与MacDonald, Brinker等[8]人得出的实验结果一致, 他们的实验表明增加异电性磷脂能够提升膜间相互作用和胶体磷脂双层与细胞内磷脂的交换能力.
支撑膜或囊泡的带电磷脂组分增加30%, 致使-Δfmin降低31-47%, 如图6所示. 也就是说, 膜表面带电量越高导致支撑膜与囊泡之间的最大接触总面积减小. 然而, tint随着膜表面带电量的增加而减小, 因此不能推断出接触总面积越大膜内磷脂交换速率越大.
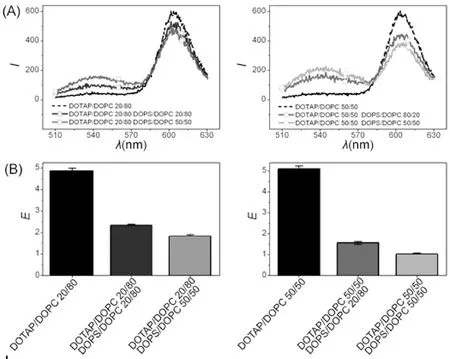
图5 荧光光谱实验, 膜表面电性对荧光标记的DOTAP/DOPC与囊泡混合(DOTAP组分比为20%或50%,Rh = 56 nm)及未标记的DOPS/DOPC与囊泡混合(DOPS组分比为20%或50%, Rh= 56 nm)磷脂交换的影响. (A)荧光光谱; (B)计算值EFig.5 The experiment of fluorescence spectrum, the membrane surface electric properties have effects on phospholipids exchange, which are DOTAP/DOPC with fluorescent tags mixing with vesicles (DOTAP component ratio is 20% or 50%, Rh = 56 nm) and DOPS/ DOPC without fluorescent tags mixing with vesicles (DOPS component ratio is 20% or 50%, Rh = 56 nm). (A) fluorescence spectrum; (B) E which is the calculated value
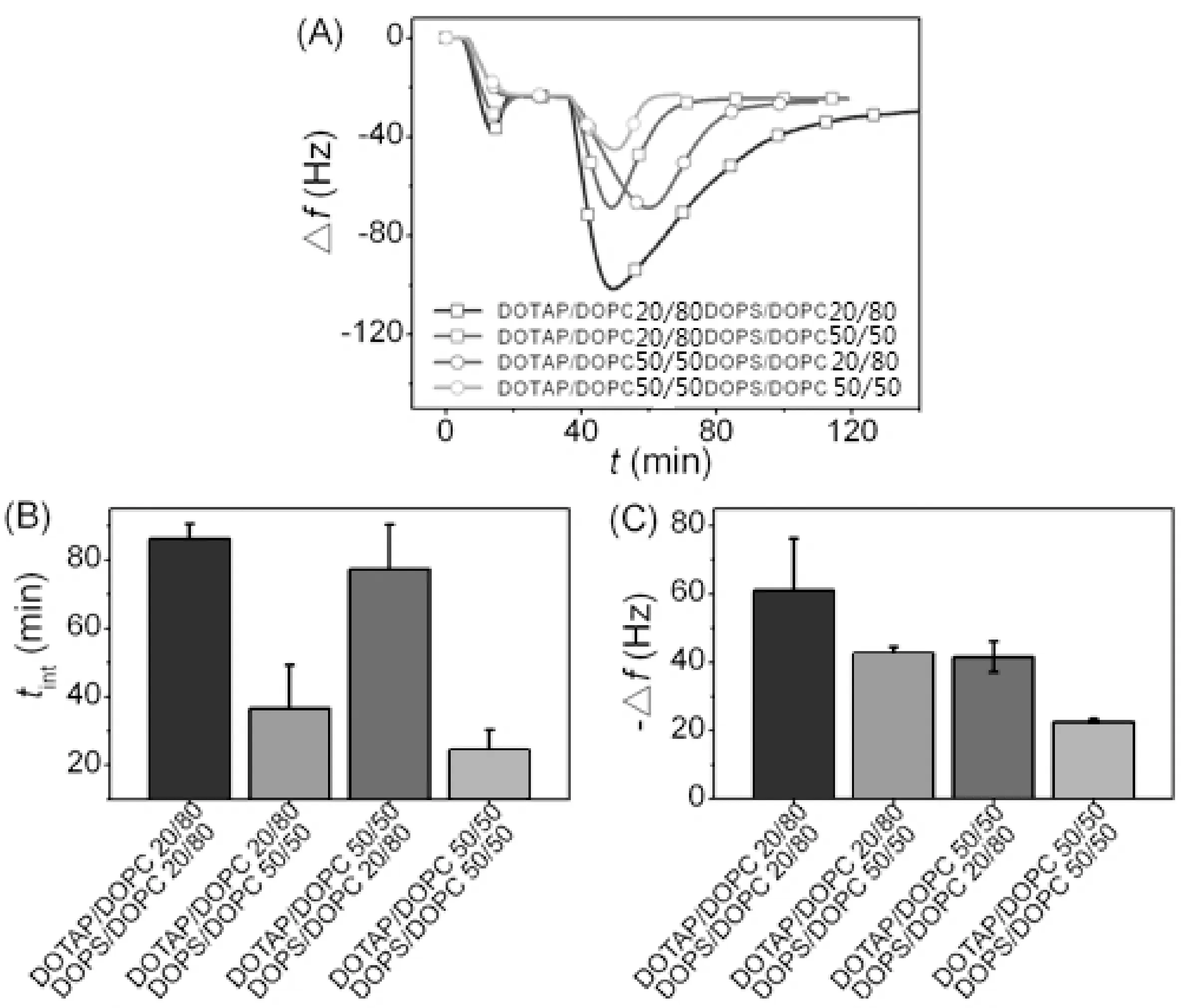
图6 QCM-D实验关于带电表面的影响. (A) Δf-t曲线, 曲线表示DOTAP/DOPC与支撑膜混合之间(DOTAP组分比为20%或50%)及DOPS/DOPC与囊泡混合之间 (DOPS组分比为20%或50%, Rh = 56 nm)的磷脂交换曲线.(B)(C)为不同膜表面带电情况下的 tint, -Δfmin变化Fig.6 The effects of the charged surface in the QCM- D experiment. (A) The Δf-t curves, which show the curves of phospholipids exchange, which say that DOTAP/DOPC and the supporting membrane are mixed up (DOTAP component ratio is 20% or 50%), and the DOPS/DOPC and vesicles are mixed up (DOPS component ratio is 20% or 50%, Rh = 56 nm).(B) (C) The changes of tint and -Δfmin which are conditions of charge on the different membrane surface
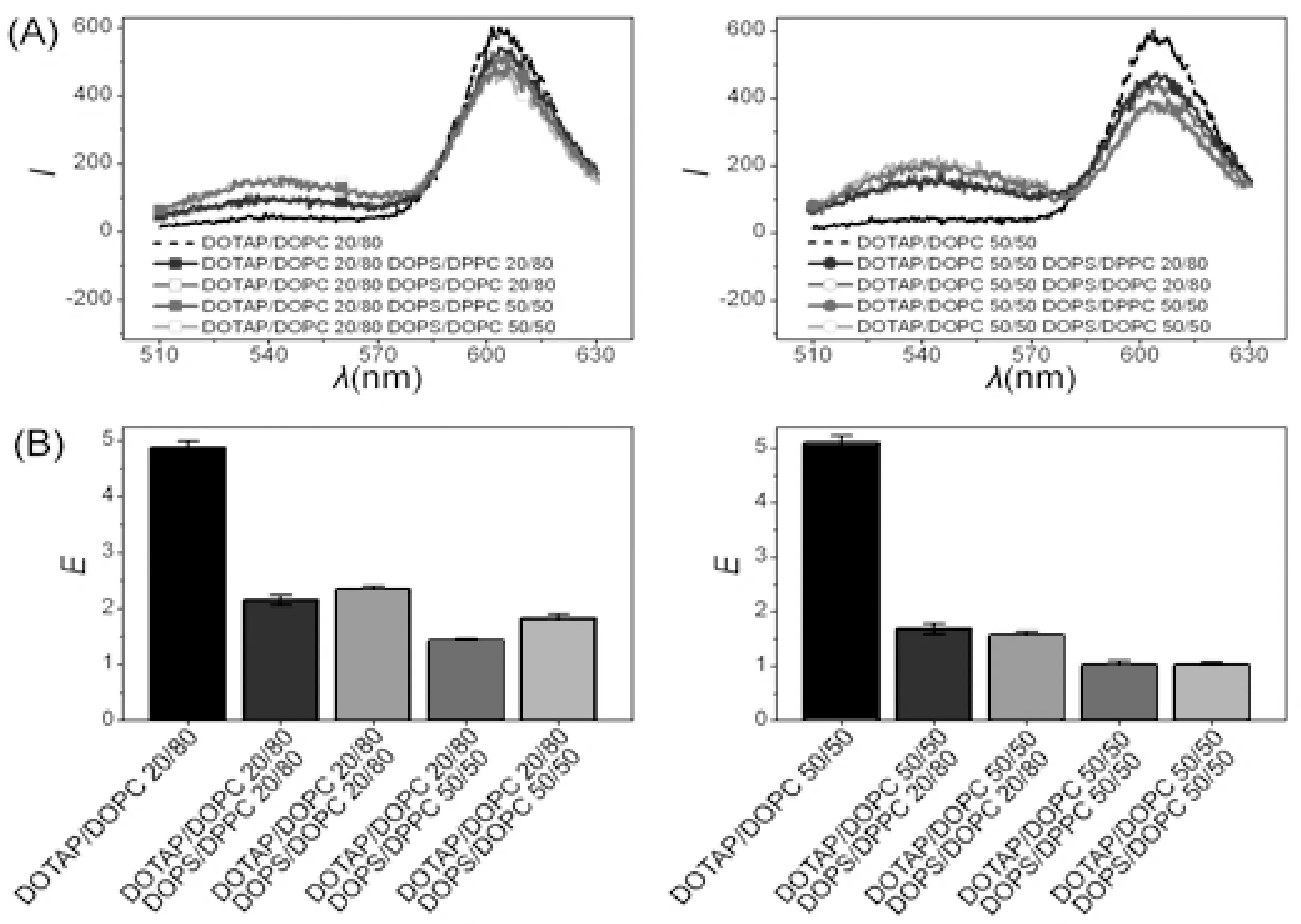
图7 荧光光谱实验. 荧光标记的DOTAP/DOPC与囊泡混合(DOTAP组分比为20%或50%, Rh为56 nm)及未标记的DOPS/DOPC与囊泡混合(DOPS组分比为20%或50%, Rh为56 nm)膜组分对磷脂交换的影响. (A)荧光光谱; (B)计算值EFig.7 The experiment of fluorescence spectrum. The membrane components, that DOTAP/DOPC with fluorescent tags and vesicles are mixed up (DOTAP component ratio is 20% or 50%, Rh is 56 nm), and DOPS/DOPC without fluorescent tags and vesicles are mixed up (DOPS component ratio is 20% or 50%, Rh is 56 nm), have effects on phospholipids exchange. (A) Fluorescence spectrum; (B) E which is the calculated value
3.3 膜组分效应
改变囊泡上双电性磷脂组分DOPC为DPPC, 研究膜组分对膜内磷脂交换的作用. 实验温度为25℃, DOPC, DOTAP, DOPS均为液晶态, 而DPPC为凝胶相. 由QCM-D和荧光光谱得到的实验数据, 如图7和图8所示. 磷脂组分的改变不影响E的变化, 而使时间tint延长2-70%. 凝胶相的DPPC组分并不会改变平衡磷脂交换量, 但是它致使带异电性膜之间的磷脂交换速率下降. 以前的研究给出了磷脂组分对中性电荷和液晶囊泡之间磷脂自发交换的影响. 结果发现调节脂肪酰链对磷脂交换速率有较强的影响. 磷脂交换速率随着双键的数目的增加而增加, 随着酰基链上亚甲基数目的减少而增加. 增加胆固醇会降低磷脂交换速率[9]. 然而, 本次实验首次使用不同相磷脂研究异电性磷脂膜之间的磷脂交换.
囊泡上的双电性离子从液晶相DOPC转为凝胶相DPPC时[10], 由于含有DPPC的囊泡流动性差,硬度强, 这就导致其接触面积小, 膜内交换变慢, 使得囊泡吸附量增加, 得到-Δfmin增加25-84%, 如图8所示. 这与膜表面带电量的影响一致. 膜内磷脂交换速率越低, 支撑膜与囊泡之间的最大接触总面积就越大.
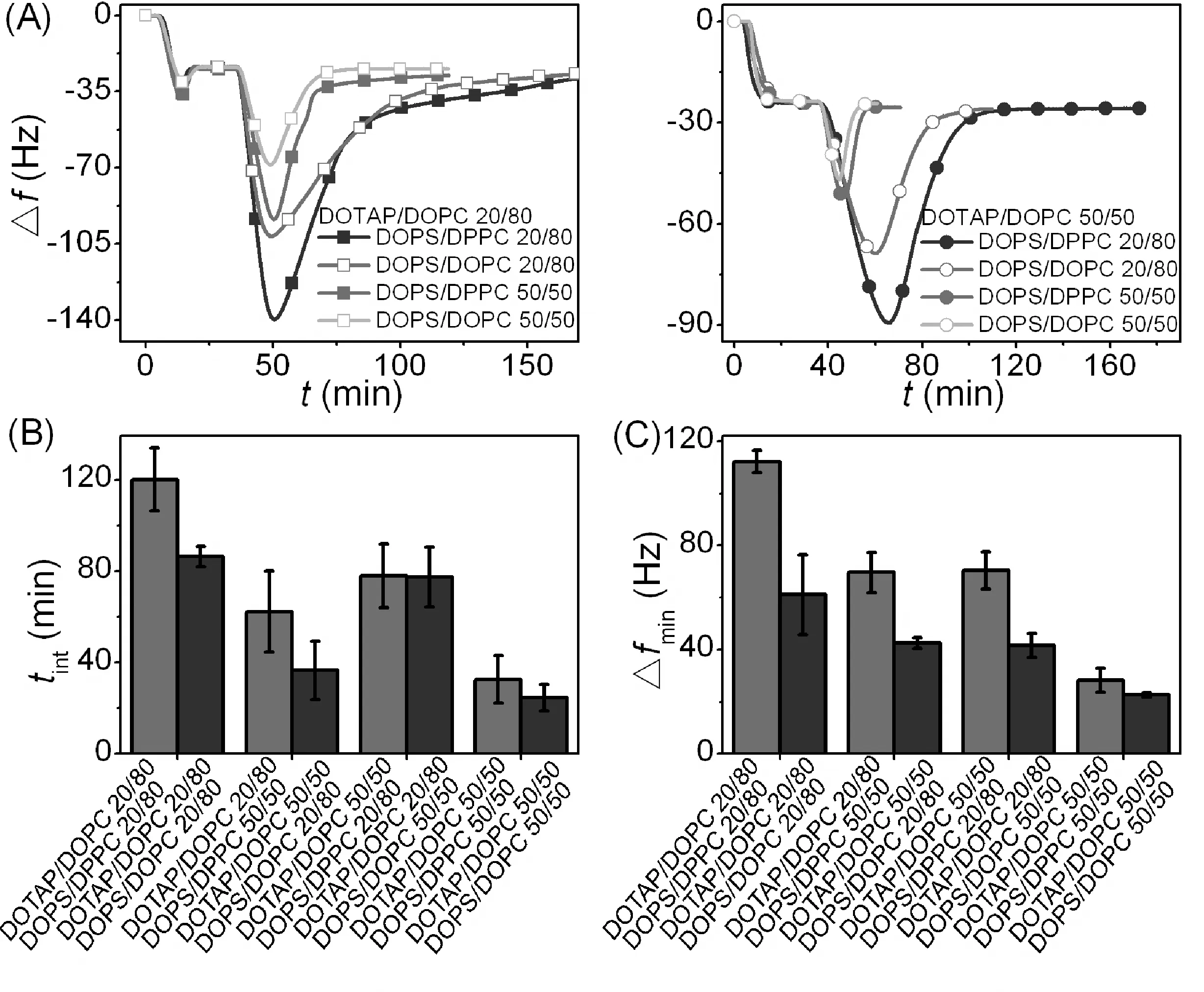
图8 QCM-D实验(A) Δf-t曲线,ΔD-t曲线表示DOTAP/DOPC与支撑膜混合之间(DOTAP组分比为20%或50%)及DOPS/DPPC或DOPS/DOPC与支撑膜混合之间 (DOPS组分比为20%或50%, Rh为56 nm)的磷脂交换曲线. (B)(C)不同膜组分条件下tint和-ΔfminFig.8 The QCM-D experiment, (A) Δf-t and ΔD-t curves, which show the curves of phospholipids exchange, which say that DOTAP/DOPC and supporting membrane are mixed up (DOTAP component ratio is 20% or 50%), and DOPS/DPPC or DOPS/DOPC and supporting membrane are mixed up (DOPS component ratio is 20% or 20%, Rh is 56 nm). (B) (C) tint and -Δfmin, which are conditions of different membrane component
4 讨 论
磷脂在支撑膜与异电性囊泡间的交换分为三步. 首先, 囊泡吸附在支撑膜表面[11]. 然后, 支持膜与囊泡发生交换. 最后, 囊泡从支撑膜上解析附. 在此, 讨论交换过程有助于深入理解磷脂跨膜的交换行为.
异电性磷脂的静电吸引作用是囊泡吸附到支撑膜表面的主要动力. 然而, 在离子浓度强的缓冲溶液中静电相互作用被屏蔽. 100 nM 的NaCl缓冲液中Debye半径约为0.9 nm, 表明静电相互作用诱导的沉积效应仅在囊泡紧邻支撑膜时才起作用. 因此, 尽管带电磷脂之间的长程静电相互吸引作用对于囊泡吸附在支撑膜上的行为致关重要, 但由于是短程静电相互作用起作用, 所以静电吸引作用对囊泡吸附速率的作用较小.
通过荧光标记实验[12]验证了静电吸引膜之间的磷脂交换依赖于半融合中间结构. 如图9 所示,这一结构首次被提出作为茎和孔之间的中间结构而存在, 其缓解了膜表面的张力. MacDonald等[13]人首次引入这一结构解释膜之间的磷脂交换行为.
膜表面吸附引起磷脂与磷脂组装的介质之间的交换, 形成过渡磷脂结构. 膜间磷脂交换结构分为四种(图9): (a) 单体转变; (b) 瞬时碰撞; (c) 嵌入; (d) 半融合. 单体转变结构和瞬时碰撞结构是早在1980s提出的两种磷脂跨膜交换方式[14], 这两种方法也适用于较低和较高浓度时不带电膜之间的自发磷脂交换行为. 嵌入式结构是从理论上提出的磷脂交换方式[14]. 磷脂直接从供体膜嵌入受体膜而不改变其方向. 早期的研究中, 半融合方法应用于异电性膜间的磷脂交换[15]. 交换过程中激活能与半融合结构的形成有关. 从QCM-D和荧光实验的尺度上判断, 前三种都不是最主要的模式, 其交换时间都比较长, 只有半融合模式对交换过程其主导作用, 这与前人的研究一致[16].
5 结 论
磷脂的跨膜运输和交换过程较为复杂, 本文用QCM-D方法和荧光光谱仪研究磷脂在正电性支撑膜和异电性囊泡间交换的速率与膜最大接触面积, 膜表面电性, 膜组分效应. 实验结果发现, 支撑膜与囊泡在磷脂交换膜之间所用的时间与交换速率成反比, 增加带电磷脂组分比率和减小囊泡尺寸可以提高囊泡吸附速率, 以致加速膜内磷脂跨膜交换. 改变膜组分从DOPC到DPPC会抑制磷脂侧向融合, 从而降低磷脂交换速率. 结果表明, 最大膜接触面积随着膜表面电荷的降低, 囊泡尺寸的降低以及磷脂组分的改变而改变. 囊泡吸附速率和膜内磷脂交换速率的竞争与最大膜接触面积有关.

图9 半融合结构图Fig.9 Semi-fusion structure figures
本次试验有助于解释一些生理学现象, 为药学的研究提供了指导, 并为进一步探索磷脂跨膜交换机制等复杂问题提供了参考.
[1] Li L.Lateralphaseseparationandbuddinginmulticomponentlipidvesicles[D]. Shanghai: Fu Dan University, 2005: 51(in Chinese)[李莉. 多组分脂质囊泡的侧向相分离与出芽[D]. 上海: 复旦大学, 2005: 51]
[2] Mueller P, Rudin D O, Tien H T. This lipid solution spontaneously thins to form a bilayer membrane[J].Nature, 1962, 194: 979.
[3] Saeki D, SugiuraS, Baba T,etal. Dynamic interaction between oppositely charged vesicles: Aggregation, lipid mixing, and disaggregation[J].ColloidInterfaceSci., 2008, 320: 611.
[4] Pantazatos D P, Pantazatos R C, MacDonald R C. Bilayer mixing, fusion, and lysis following the interaction of populations of cationic and anionic phospholipid bilayer vesicles[J].MembraneBiology, 2003, 194: 129.
[5] Shirahama K, Tsujiik, Takagi T. Free-houndary electrophoresis of sodium dodecyl sulfate-protein polypetide complex with special reference to SDS-Polyaruyla mide gel electrophoresis[J].J.Biochem., 1974, 75: 309.
[6] Sauerbrey G Z, Angew. Interaction of quartz crystal microbalance study of imidazole ionic liquid and gas molecule[J].Physics, 1959, 155: 206.
[7] Chen T S, Ceng S Q, Luo Q M.Directly the emission spectrum fitting of the donor receptor calculates fluorescence resonance energy transfering efficiency[J].JournalofPhoton, 2001, 30(3): 300 (in Chinese)[陈同生, 曾绍群, 骆清铭. 由供体受体对的发射谱直接拟合计算荧光共振能量转移效率[J]. 光子学报, 2001, 30(3): 300]
[8] Liu J, Jiang X, Ashley C. Electrostatically mediated liposome fusion and lipid exchange with a nanoparticle-supported bileyer for control of surface charge[J].J.Am.Chem.Soc., 2009, 131: 7567.
[9] Jiang Z Y, Zhang G L, Ma J,etal. Lipid exchange between membranes: effects of temperature and ionic strength [J].ActaPhys.Sin., 2013, 62(1): 018701 (in Chinese) [蒋中英, 张国梁, 马晶, 等. 磷脂在膜结构间的交换: 温度和离子强度的影响[J]. 物理学报, 2013, 62(1): 018701]
[10] Reviakine I, Brisson A. Formation of supported phospholipid bilayers from unilamellar vesicles investigated by atomic force microscopy[J].Langmuir, 2000, 16: 1806.
[11] Yang F Y, Ha Li Dan·J M H, Jiang Z Y. Phase structure of multicomponent phospholipids giant vesicle and cholesterol have effects on the micro domain growth [J].J.At.Mol.Phys., 2014, 31(4): 677 (in Chinese)[杨方源, 哈丽旦·居马汗, 蒋中英. 多组分磷脂巨囊泡的相结构和胆固醇对微畴成长的影响[J]. 原子与分子物理学报, 2014, 31(4): 677]
[12] Cho E C, Zhang Q, Xia Y N. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles [J].Nat.Nanotechnol., 2011, 6(6): 385.
[13] MacDonald R C, Pantazatos S P. The energetics of membrane fusion from binding, through hemifusion, pore formation, and pore enlargement[J].MembraneBiol., 2003, 194: 129.
[14] Pornpattananangkul D, Olson S, Aryal S,etal. Stimuli-responsive liposome fusion mediated by gold nanoparticles [J].ACSNano, 2010, 4(4): 1935.
[15] Zhu T, Jiang Z Y, Nurlybaeva E M R,etal. Effect of osmotic stress on membrane fusion on solid substrate[C].Langmuir, 2013, 29 (21): 6377.
[16] Hunt K L C, Liang Y Q, Sethuraman S J. High-frequency interaction-induced rototranslational wings of molecular spectra[J].Chem.Phys., 1988, 89(12): 7126.
The research of phospholipids exchange mechanism across membrane
XUE Yong-Pei1, LIANG Hua-Lan1, NI Ya-Zi-Bie-Ke1,JIANG Zhong-Ying1,2
(1. School of Electronic and Information Engineering, Yili Normal University, Yining 835000, China;2. School of Physics Science and Technology, Xinjiang University, Urumqi 830046, China)
Inter-membrane lipid exchange is an important physiological activity, which is important in drug delivery and the study of function of membrane. In this paper, quartz crystal microbalance with dissipation monitor(QCM-D) was applied to study the lipid exchange of vesicles-vesicles, small unilamellar vesicles(SUVs) and the supported lipid bilayers(SLBs), and fluorescence spectrometer was used to moniter the effects of membrane surface charge and membrane composition on the lipid exchange. It was found that lipids exchange time is inversely proportional to the inter-membrane lipid exchange rate, the addition of oppositely charged lipids in membranes improves the inter-membrane interaction and lipid exchange, and the changes of membrane composition have effect on the inter-membrane lipid exchange. The study may be helpful to understanding the mechanism of lipid exchange deeply and it also provides guidelines about the pharmaceutical research.
Quartz crystal microbalance; Supported lipid bilayers; Charged phospholipids; Exchange rate
2014-04-02
国家自然科学基金(21264016, 21364016)
薛永培 (1991—),女, 安徽阜阳市, 在读研究生, 主要研究领域为生物膜与纳米材料复合体系的自组装.
蒋中英 (1966—). E-mail: jiangzhongying@163.com
103969/j.issn.1000-0364.2015.08.024
0485
A
1000-0364(2015)08-0660-09

