MDV感染B19、B21单倍型SPF鸡外周血淋巴细胞BLec1、BNK及细胞因子基因转录水平比较
宁官保,田文霞,张园华,,张 鼎,张晓娜,韩凌霞*
(1.山西农业大学动物科技学院,太谷 030801;2.中国农业科学院哈尔滨兽医研究所实验动物与比较医学创新团队中心/兽医生物技术国家重点实验室,哈尔滨 150001;3.华中农业大学动物医学院,武汉 430070)
MDV感染B19、B21单倍型SPF鸡外周血淋巴细胞BLec1、BNK及细胞因子基因转录水平比较
宁官保1,田文霞1,张园华1,2,张 鼎3,张晓娜2,韩凌霞2*
(1.山西农业大学动物科技学院,太谷 030801;2.中国农业科学院哈尔滨兽医研究所实验动物与比较医学创新团队中心/兽医生物技术国家重点实验室,哈尔滨 150001;3.华中农业大学动物医学院,武汉 430070)
本研究旨在揭示BLec1、BNK及细胞因子在B21和B19两种单倍型鸡对马立克病(MD)抗性差异中的可能机制。分别对B21和B19单倍型1日龄鸡腹腔接种马立克病毒(MDV)超强毒株,在攻毒后不同时间检测鸡外周血淋巴细胞中BLec1、BNK及IFN-γ、IL-4、IL-10和IL-18的基因转录水平。结果显示,在第4、7 天,两种鸡BNK、BLec1和4种细胞因子水平表现出不同程度的降低。在第10天,B21单倍型鸡中BNK、BLec1、IFN-γ、IL-4和IL-18基因转录量出现不同程度的升高,而B19单倍型鸡中细胞因子转录水平有所下降。在第13天,B21单倍型鸡中BNK、BLec1、IL-18和IL-10基因转录量表现出不同程度的升高,而B19单倍型鸡中则有所下降。以上结果总体表明,MD耐受型鸡在感染沉默期BNK、BLec1和细胞因子转录量高于敏感型,不同遗传基因型鸡对MD的抗性差异与耐受基因及细胞因子的转录情况有着密切的关系。
细胞因子;BLec1;BNK;基因转录
鸡马立克病(MD)是由马立克病毒(MDV)引起的淋巴组织增生性疾病。MD的发病过程涉及第一次溶细胞感染期(2~7 dpi)、潜伏期(7~10 dpi)、第二次溶细胞感染期(13~21 dpi)和肿瘤细胞增生期等四个阶段。在第一次溶细胞感染期,MDV产生核内包涵体并引起细胞崩解,形成渐进性坏死,机体随后出现淋巴器官的萎缩,引起免疫抑制。进入潜伏期后,细胞出现免疫应答,机体开始产生免疫反应。到第二次溶细胞感染期时,机体的免疫应答效果主要取决于鸡的遗传背景,通常遗传耐受鸡不会从潜伏期发展到第二次溶细胞感染期。而遗传易感鸡则继续发生溶细胞感染,使淋巴器官严重萎缩,引起持久的免疫抑制[1-2]。所以,宿主遗传背景对MD感染鸡的死亡率和肿瘤形成分布有着重要的影响[3]。研究表明,鸡对MD的易感或耐受性与鸡主要组织相容性复合体(MHC)有关[2]。鸡MHC长期以来被认为是影响疾病易感或耐受的免疫反应系统[4]。BNK和BLec1基因位于鸡MHC核心区域,参与C型凝集素区域的编码[5]。BNK是被唯一证明表达于鸡NK细胞上的C型凝集素样蛋白,有可能是鸡NK细胞的受体。不同MHC单倍型鸡的BNK等位基因具有高度多态性,从序列特征上推论,BLec1编码蛋白是鸡BNK的配体。
研究表明,MD耐受或易感鸡在MDV感染过程中细胞因子表达情况存在差异。MDV感染鸡脾中IFN-γ、IL-6、IL-18基因的表达水平与病毒在鸡脾中的积聚有关[5]。B.J.Baaten等发现IFN-γ在MD耐受鸡上的表达量会显著增高[6]。P.Parvizi等研究也发现IL-10和IL-18在MD易感鸡T细胞中的表达显著上升,而IL-6在耐受鸡中的表达非常高[7]。
中国农业科学院哈尔滨兽医研究所根据MHC-B 核心区域中的4个微卫星位点等位基因[8],在国内首次选育成功B13、B15、B2、B5、B21 和 B19等六种单倍型无特定病原体(SPF)鸡群[9]。其中B21单倍型鸡对MD的抗性最强,B19单倍型鸡对MD的抗性最弱。为了了解B21和B19单倍型鸡对MD耐受差异的可能机制,选择多种与鸡疾病易感或耐受相关的基因,通过检测MDV处理后B21和B19单倍型鸡淋巴细胞中BNK、BLec1及多种细胞因子基因转录水平,揭示这些基因在鸡MD抗性过程中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 1日龄B19、B21单倍型SPF鸡由中国农业科学院哈尔滨兽医研究所实验动物中心提供,生产许可证编号为黑SCXK-2011。MDV Md5病毒由本课题组保存。T-IFN-γ、T-IL-4、T-IL-10、T-IL-18和T-28S rRNA重组质粒由本课题组构建。
1.1.2 主要试剂 质粒小量提取试剂盒购自AXYGEN公司;RNAiso Plus、M-MLV、Premix Ex TaqTM购自宝生物工程(大连)有限公司;鸡外周血淋巴细胞分离液、Concanavalin A(ConA)购自北京索莱宝科技有限公司;改良型RPMI-1640 培养基、优级胎牛血清(FBS)购自赛默飞世尔生物化学制品(北京)有限公司;DMEM细胞培养基购自GIBCO公司。
1.2 MDV感染B19和B21单倍型SPF鸡
1日龄B19单倍型和B21单倍型SPF鸡各20羽,分为攻毒组和对照组,分别饲养于负压隔离器内。攻毒组腹腔感染MDV Md5细胞毒,每羽800 PFU;对照组鸡接种等体积的无菌的PBS溶液。分别在攻毒后第4、7、10、13、19 天(dpi)时翅静脉采集所有试验鸡枸橼酸钠抗凝血,用于提取总RNA及细胞因子转录量的检测。20 dpi结束试验。所有存活鸡均按照本单位的动物管理与使用委员会规定的要求采用安乐术致死。
1.3 鸡外周血淋巴细胞总RNA的提取及cDNA合成
参考产品说明书分离鸡外周血淋巴细胞。将淋巴细胞用含10%FBS的RPMI-1640培养基重悬,加入到6孔细胞培养板中,每孔2 mL。2 h后向细胞培养液中加入终质量浓度为25 μg·mL-1的ConA,置于含5% CO2的37 ℃恒温培养箱中继续培养48 h,此期间每隔4 h晃动培养板一次。参考RNAiso Plus试剂说明书提取鸡外周血淋巴细胞总RNA,参照M-MLV说明书利用随机引物反转录、合成cDNA。
1.4 双重实时荧光定量PCR的建立
根据GenBank 检索的GallusGallusBLec1 基因序列(AM950193),利用 Oligo 6 设计特异性引物。以鸡外周血淋巴细胞cDNA为模板,分别扩增BLec1、BNK19和BNK21基因。各基因引物和探针设计见表1。反应条件:95 ℃5 min;94 ℃20 s,55 ℃30 s,72 ℃30 s,30个循环;72 ℃10 min。参照pMD®18-T Simple Vector说明书将回收产物克隆入pMD®18-T Simple Vector载体,构建重组质粒T-ChBLec、T-BNK19、T-BNK21。参照AXYGEN质粒提取试剂盒使用说明书提取T-ChBLec、T-BNK19、T-BNK21、T-28S rRNA质粒。将各质粒分别与T-28S rRNA混匀,10倍倍比稀释至1.0×101拷贝·μL-1,以101~109拷贝·μL-1的质粒作为标准品绘制标准曲线。以28S rRNA为内参基因。目的基因/内参基因混合质粒模板2 μL,2×Premix ExTaq12.5 μL,上、下游引物各10 pmoL,探针8 pmoL,ddH2O 4.9 μL。使用Bio / Rad IQ5定量PCR仪进行扩增,总反应体系25 μL。反应条件:95 ℃30 s;94 ℃20 s,60 ℃1 min,40个循环。IFN-γ、IL-4、IL-10和IL-18等基因的双重实时荧光定量PCR检测方法按照先前建立的方法进行[11]。
1.5 鸡外周血淋巴细胞中各基因转录产物的定量PCR检测
按照1.4建立的条件对鸡外周血淋巴细胞中各目的基因的转录产物进行定量PCR检测。

表1 双重实时荧光定量PCR的引物及探针序列
2 结 果
2.1 B19和B21单倍型鸡外周血淋巴细胞中BLec1转录水平的比较
10 dpi时,BLec21对照组高于BLec19对照组;7、13、19 dpi时,BLec21对照组极显著低于BLec19对照组(P<0.01)。4 dpi时,BLec21攻毒组显著高于BLec19攻毒组(P<0.05);7、10、19 dpi时,BLec21攻毒组极显著低于BLec19攻毒组(P<0.01)。B19单倍型在4、13 dpi时,BLec19对照组极显著高于BLec19攻毒组(P<0.01);10 dpi时,BLec19对照组极显著低于BLec19攻毒组(P<0.01);19 dpi时,BLec19对照组显著高于BLec19攻毒组(P<0.05)。B21单倍型在7、19 dpi时,BLec21对照组极显著高于BLec21攻毒组(P<0.01);13 dpi时,BLec21对照组极显著低于BLec21攻毒组(P<0.01)(图1)。

a.BLec21对照组/BLec19对照组差异显著(P<0.05);a*.BLec21对照组/BLec19对照组差异极显著(P<0.01);b.BLec21攻毒组/BLec19攻毒组差异显著(P<0.05);b*.BLec21攻毒组/BLec19攻毒组为极显著(P<0.01);c.BLec21对照组/BLec21攻毒组差异显著(P<0.05);c*.BLec21对照组/BLec21攻毒组差异极显著(P<0.01);d.BLec19对照组/BLec19攻毒组差异显著(P<0.05);d*.BLec19对照组/BLec19攻毒组差异极显著(P<0.01) a.BLec21 control group/BLec19 control group,P<0.05;a*.BLec21 control group/BLec19 control group,P<0.01;b. BLec21 attack drug group/BLec19 attack group,P<0.05,b*. BLec21 attack drug group/BLec19 attack group was very significant,P<0.01;c. BLec21 control group/BLec21 attack drug group,P<0.05;c*. BLec21 control group/BLec21 attack group,P<0.01;d.BLec19 control group /BLec19 attack drug group,P<0.05;d*.BLec19 control group/BLec19 attack drug group,P<0.01图1 B19和B21单倍型鸡PBL在不同时间点BLec1转录水平的比较Fig.1 Comparison of BLec1 transcription of B19 and B21 haplotype PBL
2.2 B19和B21单倍型鸡外周血淋巴细胞在不同时间BNK转录水平的比较
7、10、13、19 dpi时,BNK21对照组显著低于BNK19对照组(P<0.01或P<0.05)。4 dpi时,BNK21攻毒组极显著高于BNK19攻毒组(P<0.01);7、10 dpi时,BNK21攻毒组显著低于BNK19攻毒组(P<0.05或P<0.01)。B19单倍型在4 dpi时,BNK19对照组显著高于BNK19攻毒组(P<0.05);10 dpi时,BNK19对照组显著低于BNK19攻毒组(P<0.05);13 dpi时,BNK19对照组极显著高于BNK19攻毒组(P<0.01)。B21单倍型在7 dpi时,BNK21对照组极显著高于BNK21攻毒组(P<0.01);13 dpi时,BNK21对照组显著低于BNK21攻毒组(P<0.05)(图2)。

a.BNK21对照组/BNK19对照组差异显著(P<0.05);a*.BNK21对照组/BNK19对照组差异极显著(P<0.01);b.BNK21攻毒组/BNK19攻毒组差异显著(P<0.05);b*.BNK21攻毒组/BNK19攻毒组为极显著(P<0.01);c.BNK21对照组/BNK21攻毒组差异显著(P<0.05);c*.BNK21对照组/BNK21攻毒组差异极显著(P<0.01);d.BNK19对照组/BNK19攻毒组差异显著(P<0.05);d*.BNK19对照组/BNK19攻毒组差异极显著(P<0.01)a.BNK21 control group/BNK19 control group,P<0.05;a*.BNK21 control group/BNK19 control group,P<0.01;b. BNK21 attack drug group/BNK19 attack group,P<0.05,b*. BNK21 attack drug group/BNK19 attack group was very significant,P<0.01;c. BNK21 control group/BNK21 attack drug group,P<0.05;c*. BNK21 control group/BNK21 attack group,P<0.01;d.BNK19 control group /BNK19 attack drug group,P<0.05;d*.BNK19 control group/BNK19 attack drug group,P<0.01图2 B19和B21单倍型鸡PBL在不同时间点中BNK转录水平的比较Fig.2 Comparison of BNK transcription of B19 and B21 haplotype PBL
2.3 B19和B21单倍型鸡外周血淋巴细胞在不同时间IFN-γ转录水平的比较
IFN-γ转录在4、13 dpi时B21单倍型对照组极显著高于B19单倍型对照组(P<0.01),在7、10 dpi时显著低于B19单倍型对照组(P<0.01或P<0.05);而攻毒后4、10和19 dpi时B21单倍型攻毒组高于B19单倍型攻毒组,7、13 dpi 时B21单倍型攻毒组低于B19单倍型攻毒组,其中4、7、10、13 dpi时具有显著性(P<0.01)(图3)。
2.4 B19和B21单倍型鸡外周血淋巴细胞在不同时间IL-4转录水平的比较
IL-4转录在4 dpi时B21单倍型对照组极显著高于B19单倍型对照组(P<0.01),7、10、13和19 dpi时B21单倍型对照组显著低于B19单倍型对照组(P<0.01或P<0.05);攻毒后4 dpi时B21单倍型攻毒组极显著高于B19单倍型攻毒组(P<0.01),7、13和19 dpi时显著低于B19单倍型攻毒组(P<0.01或P<0.05)(图4)。
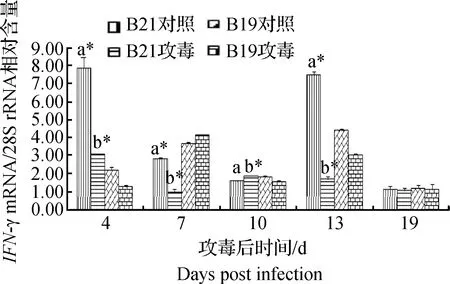
a.B21对照组/B19对照组差异显著(P<0.05);a*.B21对照组/B19对照组差异极显著(P<0.01);b.B21攻毒组/B19攻毒组差异显著(P<0.05);b*.B21攻毒组/B19攻毒组为极显著(P<0.01) 。下图同a.B21 control group/B19 control group,P<0.05;a*.B21 control group/B19 control group,P<0.01;b. B21 attack drug group/B19 attack group,P<0.05,b*. B21 attack drug group/B19 attack group was very significant,P<0.01.The same as below图3 B19和B21单倍型PBL中IFN-γ的转录水平Fig.3 IFN-γ transcript levels in B19 and B21 haplotype PBL

图4 B19和B21单倍型PBL中IL-4的转录水平Fig.4 IL-4 transcript levels in B19 and B21 haplotype
2.5 B19和B21单倍型鸡外周血淋巴细胞在不同时间IL-10转录水平的比较
IL-10转录在4、10 dpi时B21单倍型对照组极显著高于B19单倍型对照组(P<0.01),13 dpi时B21单倍型对照组极显著低于B19单倍型对照组(P<0.01),而攻毒后4 dpi时B21单倍型攻毒组极显著高于B19单倍型攻毒组(P<0.01),7、13和19 dpi时极显著低于B19单倍型攻毒组(P<0.01)(图5)。

图5 B19和B21单倍型PBL中IL-10的转录水平Fig.5 IL-10 transcript levels in B19 and B21 haplotype PBL
2.6 B19和B21单倍型鸡外周血淋巴细胞在不同时间IL-18转录水平的比较
IL-18转录在4 dpi时B21单倍型对照组极显著高于B19单倍型对照组(P<0.01),7、10、13和19 dpi时B21单倍型对照组显著低于B19单倍型对照组(P<0.01或P<0.05);而攻毒后4和10 dpi时B21单倍型攻毒组显著高于B19单倍型攻毒组(P<0.01或P<0.05),7 dpi时极显著低于B19单倍型攻毒组(P<0.01)(图6)。
3 讨 论
本研究主要通过检测不同单倍型鸡外周血淋巴细胞中BNK、BLec1及多种细胞因子的基因转录水平,揭示这些基因在介导B21和B19单倍型鸡MD抗性过程中的作用。C型凝集素是免疫应答中具有多种功能的蛋白质,它参与机体的免疫应答,与细胞因子一样在机体的免疫应答中起着非常重要的作用。而BNK和BLec1是C型凝集素上的两个受体[10]。本试验结果显示,B19和B21单倍型MD鸡在第一次溶细胞感染期内BNK和BLec1的转录量均低于正常组,这可能就是由于患鸡淋巴器官萎缩导致的免疫抑制引起的。MD患鸡常伴随着大面积的淋巴器官萎缩,导致机体出现严重的免疫抑制,这一过程尤其在第一次溶细胞感染期和第二次溶细胞感染期表现最为明显。研究表明,MD耐受品系鸡通常不会从第一溶细胞感染期发展到第二期,而且可能在攻毒后8~14 d淋巴器官得到逐渐恢复[11]。本试验中10、13 dpi两个时间点B21型MD患鸡BNK和BLec1的分泌量出现上升,这可能是因为B21单倍型鸡属于MD耐受鸡,患鸡在度过第一溶细胞期后淋巴器官功能逐渐恢复,机体免疫抑制减弱,免疫力得到增强。而B19属于MD敏感型鸡,B19单倍型鸡在感染MDV后总体持续保持免疫抑制,BNK和BLec1的转录量未出现增加。从以上研究结果可以看出,BLec1和BNK的表达与鸡MD耐受性有着密切的关系,但对其调控机制的研究还有待进一步深入展开。
机体免疫应答主要是通过Th1和Th2细胞分泌的细胞因子来保持动态平衡[12-13]。本研究中,IFN-γ和IL-18属于Th1细胞分泌的细胞因子,主要功能是促进Th1细胞的分化和促炎症因子表达,最终引起机体炎症反应增强。IL-4和IL-10属于Th2细胞分泌的细胞因子,主要功能是抑制Th1细胞产生细胞因子,产生抗免疫反应作用。本试验研究结果显示,B19和B21单倍型鸡在受到MDV攻毒后,4种细胞因子的基因转录水平在第一次溶细胞感染期时明显低于正常组,这可能与病鸡淋巴器官萎缩有关。MDV攻毒10、13 d后B21单倍型MD鸡细胞因子基因转录量均高于对照组,这又可能得益于病鸡淋巴器官功能的恢复。B21单倍型鸡感染MDV后细胞因子的变化趋势与BLec1、BNK基因基本一致,这提示B21单倍型鸡是通过提高病鸡免疫系统功能,进而引起增加机体免疫应答来对抗MDV感染。
特别值得注意的是,MDV感染后10 d时(潜伏期),B21单倍型鸡外周血淋巴细胞中IFN-γ(19%)、IL-4(5%)和IL-18(32%)的转录水平均有所增加,而在B19单倍型中上述3种细胞因子的转录量都表现出不同程度的降低(-16%、-29%、-23%)。这与其他文献中描述的在感染后8~14 d内抗性鸡淋巴组织功能逐渐恢复、细胞因子表达量出现上升的结论相吻合[11]。这一结果进一步证明了细胞因子的分泌量与遗传背景有一定的关系,并共同影响着鸡的疾病耐受性。
4 结 论
基因转录水平的研究表明B21单倍体型MD抗性鸡在MDV感染过程中BLec1、BNK以及细胞因子(IFN-γ、IL-4、IL-10和IL-18)转录量总体高于B19型MD敏感鸡。不同遗传基因型鸡耐受基因及细胞因子的转录情况与鸡的MD抗性差异有着密切的关系。后续阶段可以就每个MDV感染阶段这些基因在鸡免疫应答中所起的作用展开进一步研究。
[1] CALNEK B W.Pathogenesis of Marek’s disease virus infection[M]//Marek’s Disease.Springer Berlin Heidelberg,2001:25-55.
[2] 高彩霞.不同 MHC 单倍型 SPF 鸡 MHC I 类和 II 类分子的差异表达与 MD 致病性的相关研究[D].兰州:甘肃农业大学,2012. GAO C X.The association study of differential expression of MHC class I and II molecules with pathogenicity of MD in SPF chickens carrying different MHC haplotypes[D].Lanzhou:Gansu Agricultural University,2012.(in Chinese)
[3] MILLER M M,BACON L D,HALA K,et al.Nomenclature for the chicken major histocompatibility (B and Y) complex[J].Immunogenetics,2004,56(4):261-279.
[4] TAYLOR R L Jr.Major histocompatibility (B) complex control of responses against Rous sarcomas[J].PoultSci,2004,83(4):638-649.
[5] ROGERS S L,KAUFMAN J.High allelic polymorphism,moderate sequence diversity and diversifying selection for B-NK but not B-lec,the pair of lectin-like receptor genes in the chicken MHC[J].Immunogenetics, 2008,60(8):461-475.
[6] BAATEN B J,STAINES K A,SMITH L P,et al.Early replication in pulmonary B cells after infection with Marek’s disease herpesvirus by the respiratory route[J].ViralImmunol,2009,22(6):431-444.
[7] PARVIZI P,READ L R,ABDUL-CAREEM M F,et al.Cytokine gene expression in splenic CD4+ and CD8+ T cell subsets of genetically resistant and susceptible chickens infected with Marek’s disease virus[J].VetImmunolImmunopathol,2009,132(2-4):209-217.
[8] GAO C X,HAN L X,QU L D,et al.Specific TaqMan probed real-time quantitative RT-PCR methods and their application to differentiate the transcripts of duplicated BF or BLB genes in chicken MHC[J].VetImmunolImmunopathol,2012,145(3-4):590-596.
[9] GAO C,HAN L,HAN J,et al.Establishment of six homozygous MHC-B haplotype populations associated with susceptibility to Marek’s disease in Chinese specific pathogen-free BWEL chickens[J].InfectGenetEvol, 2015,29:15-25.
[10] ROGERS S L,KAUFMAN J.High allelic polymorphism,moderate sequence diversity and diversifying selection for B-NK but not B-lec,the pair of lectin-like receptor genes in the chicken MHC[J].Immunogenetics,2008,60(8):461-475.
[11] 常 爽.非主要组织相容性复合体宿主遗传变异对马立克氏病疫苗效力的影响[D].吉林:吉林大学,2010. CHANG S.Assessment of non-MHC host genetic variation effects on Marek’s disease vaccine efficacy[D].Jilin:Jilin University,2010.(in Chinese)
[12] COOK A L,ROCHE M,RAMADAS R,et al.The role of carma1 in Th1 and Th2 polarization of T lymphocytes[J].AmJRespirCritCareMed,2014,189:A4182.
[13] TORRES-MORALES E,TABORDA L,CARDONA N,et al.Th1 and Th2 immune response to P30 and ROP18 peptides in human toxoplasmosis[J].MedMicrobiolImmunol,2014,203(5):315-322.
(编辑 白永平)
Gene Transcription Comparison ofBLec1,BNKand Cytokines in PBLs of B19 and B21 Haplotype SPF Chickens Infected with MDV
NING Guan-bao1,TIAN Wen-xia1,ZHANG Yuan-hua1,2,ZHANG Ding3,ZHANG Xiao-na2,HAN Ling-xia2*
(1.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China;2.UnitofLaboratoryAnimalandComparativeMedicine,StateKeyLaboratoryofVeterinaryBiotechnology,HarbinVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Harbin150001,China;3.CollegeofVeterinaryMedicine,HuazhongAgriculturalUniversity,Wuhan430070,China)
This study was undertaken to reveal the possible resistance mechanism of B19 and B21 haplotype SPF chickens against MDV.One day-old B19 and B21 haplotype chickens were infected with MDV Md5 strain by intramuscular as 800 PFU per feather.The transcription levels of targets genes includingBNK,BLec1,IFN-γ,IL-4,IL-10 andIL-18 were measured at different time points after MDV treatment.Results showed that gene transcription levels ofBNK,BLec1 and the four cytokines in B19 and B21 chickens decreased compared to the control group on the 4th and 7th day post infection (dpi).On the 10th dpi,BNK,BLec1,IFN-γ,IL-4 andIL-18 gene transcriptions highly increased in B21 chicken in different levels,while decreased in B19 chickens.On the 13th dpi,gene transcriptions ofBNK,BLec1,IL-18 andIL-10 in MDV treated B21 chickens also rose in different levels compared to the control group,while decreased in MDV treated B19 chickens.In conclusion,the present study demonstrate that B21 haplotype SPF chickens express high levels ofBNK,BLec1 and cytokines than B19 ones and the resistant difference against MD between MD tolerant and sensitive chickens is related to the gene transcriptions ofBNK,BLec1 and cytokines.
cytokines;BLec1;BNK;gene transcription
10.11843/j.issn.0366-6964.2015.07.015
2015-01-26
山西省自然科学基金(2014011028-1);科技部支撑项目(2013BAK11B02)
宁官保(1961-),男,山西闻喜人,副教授,主要从事生物技术在动物传染病学与免疫中的应用研究,E-mail:ningguanbao034@163.com
*通信作者:韩凌霞,E-mail:hlx1993@126.com
S852.659.1;S813.2
A
0366-6964(2015)07-1184-07

