牛囊胚ICM克隆多能性标记基因与表面标记的研究
崔莉莎,赵学明,郝海生,杜卫华,马友记,朱化彬*,王宗礼*
(1.甘肃农业大学动物科学技术学院,兰州 730070; 2.中国农业科学院北京畜牧兽医研究所,北京 100193)
牛囊胚ICM克隆多能性标记基因与表面标记的研究
崔莉莎1,2,赵学明2,郝海生2,杜卫华2,马友记1,朱化彬2*,王宗礼1*
(1.甘肃农业大学动物科学技术学院,兰州 730070; 2.中国农业科学院北京畜牧兽医研究所,北京 100193)
本研究旨在探究牛类胚胎干细胞(Embryonic stem cells,ES)的多能性标记基因与表面标记,为优化牛类ES细胞培养条件和相关研究提供依据。利用2i/LIF培养液,通过全胚接种及机械传代法分离培养牛囊胚内细胞团(Inner cell mass,ICM),免疫荧光染色法检测其多能性标记基因与表面标记;qRT-PCR检测免疫磁珠法分选的牛囊胚ICM和滋养层细胞(Trophectoderm cell,TE)的多能性标记基因的差异表达结果。试验成功分离出了牛囊胚ICM克隆,并体外培养至第10代,且各代克隆均呈现出了典型的干细胞形态。结果表明,ICM表面标记SSEA1、SSEA4和TRA-1-60染色为阳性,且多能性标记基因OCT4、SOX2和NANOG在其中均有表达;OCT4、SOX2和NANOG在牛囊胚ICM和TE中的表达存在差异(P<0.05),其中SOX2 的差异极显著(P<0.01)。综上表明,2i/LIF培养液有助于牛囊胚ICM的培养;SOX2可能成为牛ICM克隆的候选多能性标记基因。
牛;ICM;多能性标记;qRT-PCR
胚胎干细胞(Embryonic stem cells,ES)是来源于附植前胚胎内细胞团(Inner cell mass,ICM)、保持未分化状态并能自我增殖的多能性细胞[1]。ES 细胞具有分化为机体所有细胞的潜力,所以可用于早期胚胎发育的研究[2]。自从M.J.Evans等[3]1981年建立了第1个小鼠 ES 细胞系后,陆续获得了猕猴[4]、人[5]和大鼠[6]的ES细胞系,牛类ES细胞系也相继建立[1,7-15],但是牛ES细胞系尚未成功建立。这主要是由于牛ES细胞多能性维持机理尚不清楚,迄今为止,主要还是借鉴研究小鼠和人ES细胞系的方法研究牛ES细胞。近年来,小鼠和人ES细胞研究取得了巨大进展,其培养条件日趋成熟,ES细胞鉴定标准(如多能性基因和表面标记等)也已比较完善[3,5]。阶段特异性胚胎抗原(Stage-specific embryonic antigen,SSEAs)是ES细胞的重要多能性表面抗原标记,其中 SSEA-1已被确认为小鼠 ES 细胞的表面标记,而OCT4、SOX2、NANOG等是可以鉴定小鼠ES细胞的特异多能性基因[3,16]。人ES细胞的表面标记有SSEA4、TRA-1-60和TRA-1-81,特异多能性基因有OCT4、SOX2、NANOG等[5]。由于物种间存在差异,这些分子标记并不能鉴定牛ES细胞[17]。因此,探索牛ES细胞的多能性标记基因及其表面标记,揭示维持牛ES细胞多能性的机制,有助于找到适合牛类ES细胞的培养条件,促进牛ES细胞系的成功建立[18]。
免疫磁珠分选法可根据细胞特异表面标记分选细胞,利用这种方法可以获得高纯度的 ICM和滋养层细胞(Trophoblastic cell,TE)[19]。而采用qRT-PCR对获得的高纯度ICM和TE 细胞进行分析,有助于探索牛ICM多能性维持基因[20]。近年来,越来越多的研究开始利用 2i/LIF培养液培养牛类ES细胞,并建立了牛类ES细胞系[14,20-21],而对所建立的牛类ES细胞系进行免疫荧光染色,检测多能性基因和表面标记的表达,有助于探索牛ES细胞的多能性调控网络。因此,本研究采用全胚接种结合机械传代法分离牛囊胚ICM,并通过免疫荧光染色来检测其多能性标记基因与表面标记。qRT-PCR检测免疫磁珠法分选获得的ICM和TE细胞,筛选ICM特异多能性基因,旨在探究牛类ES细胞多能性标记基因及表面标记,为牛ES细胞研究提供参考。
1 材料与方法
1.1 主要试剂与溶液配制
TCM199、DMEM和FBS购自Gibco,LH和FSH 购自BIONICHE公司,其余试剂均购自 Sigma公司。卵母细胞成熟液:TCM199+10% FBS+1 μg·mL-1雌二醇+5 μg·mL-1FSH+5 μg · mL-1LH;小鼠胎儿成纤维细胞培养液:DMEM+10% FBS+100 U·mL-1青霉素+0.05 mg·mL-1链霉素。
1.2 体外受精囊胚的生产
1.2.1 牛卵母细胞体外成熟培养 将从屠宰场取得的牛卵巢置于32~35 ℃生理盐水中,保温2~3 h送到实验室后,用真空蠕动泵(12号针头)抽取卵巢表面可见卵泡。捡出含3层以上卵丘细胞的卵丘-卵母细胞复合体(COCs)后,分别用卵母细胞洗液和卵母细胞成熟液洗两遍,移入四孔板成熟培养液中(每孔750 μL成熟液,50枚COCs),在5% CO2、37.5 ℃、饱和湿度的培养箱中培养22~24 h。
1.2.2 体外受精 体外受精程序参照文献[22]的方法进行,略有改动。在35 mm的培养皿中做50 μL的受精微滴,放入培养箱中平衡2 h。将在成熟液中培养22~24 h的卵母细胞移至平衡2 h的受精滴中,每滴15枚。然后取冷冻精液,在38 ℃水中解冻后,用受精液洗两遍(1 800 r·min-1,每次8 min)后,弃上清液,用受精液悬浮,调整精子密度为1×106mL-1。取50 μL精子悬浮液加入到已放入卵母细胞的50 μL受精微滴中,置于培养箱中培养8 h (5%CO2、38.5 ℃、饱和湿度)。
1.2.3 胚胎体外培养 用0.25%的透明质酸酶消化受精8 h的受精卵,脱除颗粒细胞,用终止液(M199+10% FBS)和胚胎培养液(mCR1aa)[23]各洗2遍后,移入预平衡2 h以上的mCR1aa微滴中培养。48 h后,更换培养液为mCR1aa + 10% FBS,以后隔天半量换液。
1.3 饲养层的制备1.3.1 小鼠胎儿成纤维细胞系的建立 将12.5~13.5 d 的孕鼠颈椎脱臼处死,无菌取其胚胎,去除胎鼠的头、尾、四肢、内脏,将剩余部分置于无Ca2+、Mg2+的PBS中冲洗1~2次;然后将其剪成1 mm3以下的组织碎块,加入0.05% trypsin-EDTA,放入培养箱(37.5 ℃、5% CO2、饱和湿度)中消化5 min,待消化完成后反复吹吸混匀。在消化液中加入小鼠胎儿成纤维细胞培养液[24],终止消化。将单细胞悬液铺在细胞培养皿中,于培养箱(37.5 ℃、5% CO2、饱和湿度)中培养。每日观察,隔天换液,3~4 d后传代。
1.3.2 饲养层的制备 用10 μg·mL-1的丝裂霉素C处理第2代的小鼠胎儿成纤维细胞2~3 h。处理完成后用无Ca2+、Mg2+的PBS冲洗3~5次,0.25% 的trypsin-EDTA消化1~2 min后,用含有10% FBS的DMEM终止消化,再将细胞悬液离心3 min(1 000 r·min-1)。去上清,加入冻存液(DMEM∶FBS∶DMSO=7∶2∶1),按合适密度冻存于液氮中备用。在全胚接种或者牛ICM克隆传代前一天,将细胞接种于0.1%明胶涂层的6孔板中,放入培养箱(37.5 ℃、5%CO2、饱和湿度)中培养,用作饲养层。
1.4 囊胚的接种
提前0.5 h将饲养层更换为胚胎干细胞培养液[25],然后将培养7 d的IVF囊胚接种到饲养层上。置于培养箱(38.5 ℃ 5%CO2,饱和湿度)中培养,隔天半量更换培养液,等贴壁后可全量换液。
1.5 ICM的分离与传代培养
接种7~10 d后,用机械分离法进行第1次传代:用1 mL注射器的针头将ICM形成的细胞团块挑出,并分离为较小的细胞团块,转移至新的饲养层上培养。之后每隔5~7 d进行传代,方法同1.4。
1.6 碱性磷酸酶染色和免疫荧光染色
利用ES细胞鉴定试剂盒(Millipore,USA﹠Canada)进行AP染色和免疫荧光染色。
1.6.1 碱性磷酸酶染色 在中低密度下培养ICM克隆5 d后,用4%多聚甲醛固定1~2 min;弃固定液,1×Rinse buffer冲洗;染色剂(Fast Red Violet Solution∶Naphthol∶Water = 2∶1∶1)在室温、黑暗环境下培养ICM克隆15 min;弃染色剂,1×Rinse buffer冲洗;加入1×PBS后在显微镜下观察阳性克隆数。
1.6.2 免疫荧光染色 室温下,4%的多聚甲醛固定ICM克隆15~20 min,1×Rinse buffer洗两遍(每次5~10 min);0.1%的Triton X-100透化细胞10 min,1×Rinse buffer洗两遍(每次5~10 min);封闭液(3%~5%BSA/TBST)封闭细胞30 min;再用封闭液把一抗稀释到工作浓度(SSEA-1、SSEA-4和TRA-1-60的稀释比例为1∶10~1∶50,OCT4、SOX2和NANOG的稀释比例为1∶100~1∶1 000),室温下用一抗培养ICM克隆1 h;1×Rinse buffer洗3遍(每次5~10 min);用1×PBS稀释二抗(Rabbit Anti-mouse IgG-Fc/FITC、Goat Anti-mouse IgM/FITC和Mouse Anti-rabbit IgG/PE,稀释比例均为1∶100~1∶1 000),用二抗培养ICM克隆30~60 min;1×Rinse buffer洗3遍(每次5~10 min);加入1×PBS覆盖细胞后,在显微镜下观察并拍照。
1.7 牛囊胚ICM和TE的分选
利用免疫磁珠分选法分选牛囊胚ICM和TE,具体参照文献[19]的方法进行,略有改动。
用结合有FITC的伴刀豆蛋白(ConA)标记已去除透明带的囊胚滋养层细胞;然后置于含有1 mmol·L-1EDTA 的DPBS (Invitrogen)中5 min,再移入trypsin-EDTA 溶液中,38.5 ℃下培养15 min;涡旋器将其分解成单细胞后,用含有1 mmol·L-1EDTA 和10% FBS 的DPBS来终止;细胞过滤器(BD Biosciences)过滤,收集通过过滤器的单个细胞;加入MACS buffer,500 g离心5 min,110 μL MACS buffer 重悬囊胚细胞;再加入10 μL结合有小鼠anti-FITC IgG1 的磁珠,在冰上、黑暗条件下,培养15 min;MACS 缓冲液洗3次后加入500 μL MACS 缓冲液重悬细胞,使其通过吸附在磁力架上的磁珠分离柱,并收集到离心管中,再用MACS 缓冲液冲洗两遍磁力柱(每次500 μL),从而获得FITC阴性细胞(ICM);将分离柱从磁力架上拿下后,用MACS 缓冲液冲洗3遍,并收集细胞悬液,从而获得 FITC阳性细胞(TE)。将分离得到的ICM和TE置于-80 ℃保存。
1.8 qRT-PCR检测牛囊胚ICM和TE多能性基因的差异表达
将通过免疫磁珠分选法获得的ICM和TE进行qRT-PCR,检测OCT4、SOX2和NANOG的表达水平。采用PureLinkTM RNA Micro 试剂盒(Invitrogen)来提取RNA,具体方法参照操作手册。提取RNA后进行逆转录。然后进行荧光定量PCR扩增(引物见表1),用β-actin作内参基因。PCR的反应体系为25 μL:17.3 μL超纯水+2.5 μL 10×buffer + 2.0 μL镁离子(25 mmol·L-1) + 0.2 μL dNTPs (25 mmol·L-1) + 0.5 μL上游引物(10 μmol·L-1) + 0.5 μL SYBR(20×)+ 0.5 μL下游引物(10 μmol·L-1) + 0.3 μLTaq酶(5 U·μL-1) + 1.2 μL模板(除模板外,均为Invitrogen公司产品)。 PCR反应条件为95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火30 s,45个循环。每个样品重复3次,荧光定量结果采用2-ΔΔCt法[26]进行分析。

表1 qRT-PCR引物
1.9 统计分析
数据采用SAS软件进行分析,并用ANOVA进行显著性差异分析,结果用“平均值±标准误”表示,P<0.05表示差异显著。
2 结 果
2.1 牛囊胚ICM分离与培养
将培养7 d 的 IVF 囊胚全胚接种至饲养层上,接种培养 7~10 d 后,机械法将ICM克隆挑出并传至新的饲养层上,之后每隔5~7 d采用机械法传代。本试验将牛囊胚ICM克隆培养至第10代(图 1),克隆呈圆顶状,高度聚集,并有明显的边界。
2.2 ICM克隆中多能性标记基因及表面标记检测
碱性磷酸酶染色(图2)和免疫荧光染色分别检测第1代和第10代ICM克隆的多能性基因(OCT4、SOX2和NANOG)和表面标记(SSEA-1、SSEA-4和TRA-1-60)的表达,染色结果均呈阳性(图3和图4)。
2.3 牛囊胚 ICM 和 TE 的分选
用磁珠分选法分选牛IVF囊胚得到ICM和TE,经检测,二者的分离纯度均达到90%以上。
2.4 ICM 和 TE 多能性基因的表达
qRT-PCR 验证免疫荧光染色中呈阳性的多能性基因OCT4、SOX2和NANOG的表达情况。结果如图 5 所示,3个基因在 ICM和TE中均可表达,但ICM的表达量均高于TE(P<0.05),其中SOX2基因表达差异极显著(P<0.01)。
3 讨 论
3.1 牛囊胚ICM体外培养及免疫荧光染色
本试验中第1~10代的牛ICM克隆呈现出了典型的干细胞形态,这表明2i/LIF培养液有助于维持牛ICM克隆的多能性。此外,通过免疫荧光染色检测表面标记SSEA1、SSEA4 和 TRA-1-60以及多能性基因OCT4、SOX2和NANOG在牛ICM克隆中的表达情况,结果均为阳性,这与已有的研究结果有相同之处[1,12,14-15,21,24]。SSEAs是小鼠和人多能性细胞表达的表面抗原,其中SSEA-1 在小鼠ES细胞中表达量较高[27],SSEA-3和SSEA-4在人ES细胞中特异表达[28]。此外,OCT4、SOX2和NANOG是小鼠和人多能性细胞的重要标记基因。但是这些多能性分子标记在牛类ES细胞中的表达情况还有待进一步的研究[16]。L.Wang等[12]建立的牛类ES细胞系,表达表面标记 SSEA-4 和多能性基因OCT4;G.Gong等[24]研究结果为在5~7代的牛类ES细胞系中表面标记SSEA-1和多能性标记 OCT4 和NANOG染色呈阳性;而V.Verma等[21]所建立牛类ES细胞系表达表面标记SSEA-3、SSEA-4、TRA-1-60/-81和多能性基因OCT4、SOX2、NANOG、Klf4。T.Furusawa等[14]利用 2i/LIF 培养液建立的牛类ES细胞系表达SSEA-1、SSEA-4和多能性基因OCT4、SOX2、NANOG。关于牛类ES细胞多能性分子标记的研究存在很大差异,这可能是由多方面的因素所致。比如培养条件、传代方式、饲养层种类以及鉴定方法等[18]。
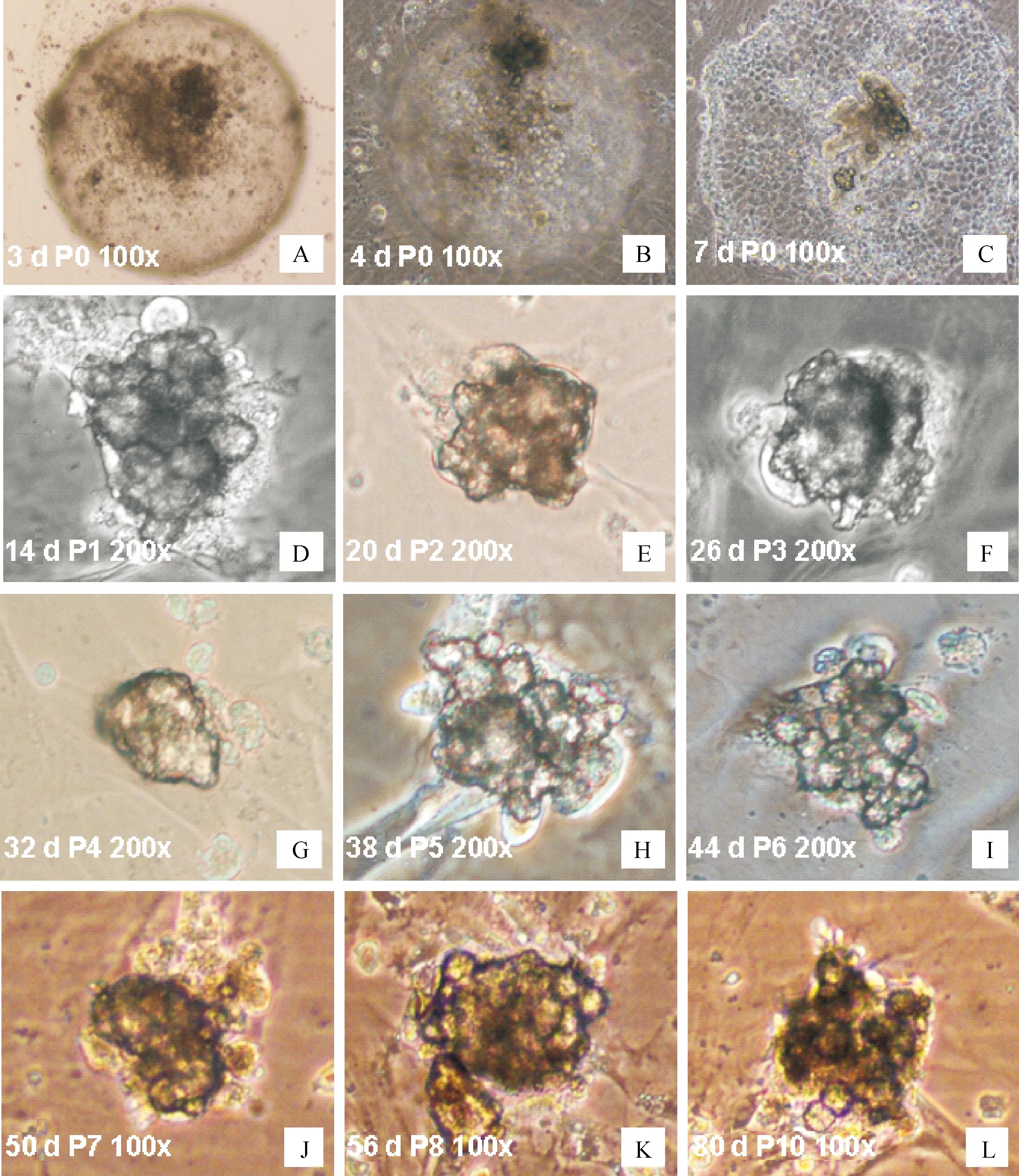
A~C.胚胎接种第3、4、7 天;D~K.第1~8代ICM克隆;L.第10代ICM克隆A-C.The embryo on the third,fourth and seventh day respectively after seeded onto MEF;D-K.The ICM-derived colonies from passage 1 to passage 8;L.The ICM-derived colonies at passage 10图1 牛ICM克隆各阶段培养状态图Fig.1 Morphology of ICM colonies from bovine IVF blastocysts

A、B.第1代牛囊胚ICM克隆;C、D.第10代牛囊胚 ICM 克隆A,B.ICM colonies derived from bovine blastocysts at passage 1;C,D.ICM colonies derived from bovine blastocysts at passage 10图2 碱性磷酸酶染色Fig.2 Alkaline phosphatase staining

利用免疫荧光染色法检测的多能性标记SSEA-1、SSEA-4、TRA-1-60、OCT4、SOX2和 NANOG。A1~F1、A2~F2和A3~F3.光镜照片、Hoechst33342标记细胞核以及特异抗体反应。下同。A1~B3 200×;C1~F3 100×Immunofluorescence staining for SSEA-1,SSEA-4,TRA-1-60,OCT4,SOX2 and NANOG in ICM colonies.A1-F1,A2-F2 and A3-F3.Light micrograph images,nuclear staining by Hoechst33342 and specific staining reactions,respectively.The same as below.A1-B3 200×;C1-F3 100×图3 第1代牛ICM克隆多能性标记的表达Fig.3 Expression of pluripotency markers in ICM colonies derived from bovine blastocysts at passage 1

图4 第10代牛ICM克隆多能性标记的表达 200×Fig.4 Expression of pluripotency markers in ICM colonies derived from bovine blastocysts at passage 10 200×
3.2SOX2、OCT4和NANOG在ICM和TE上的表达差异
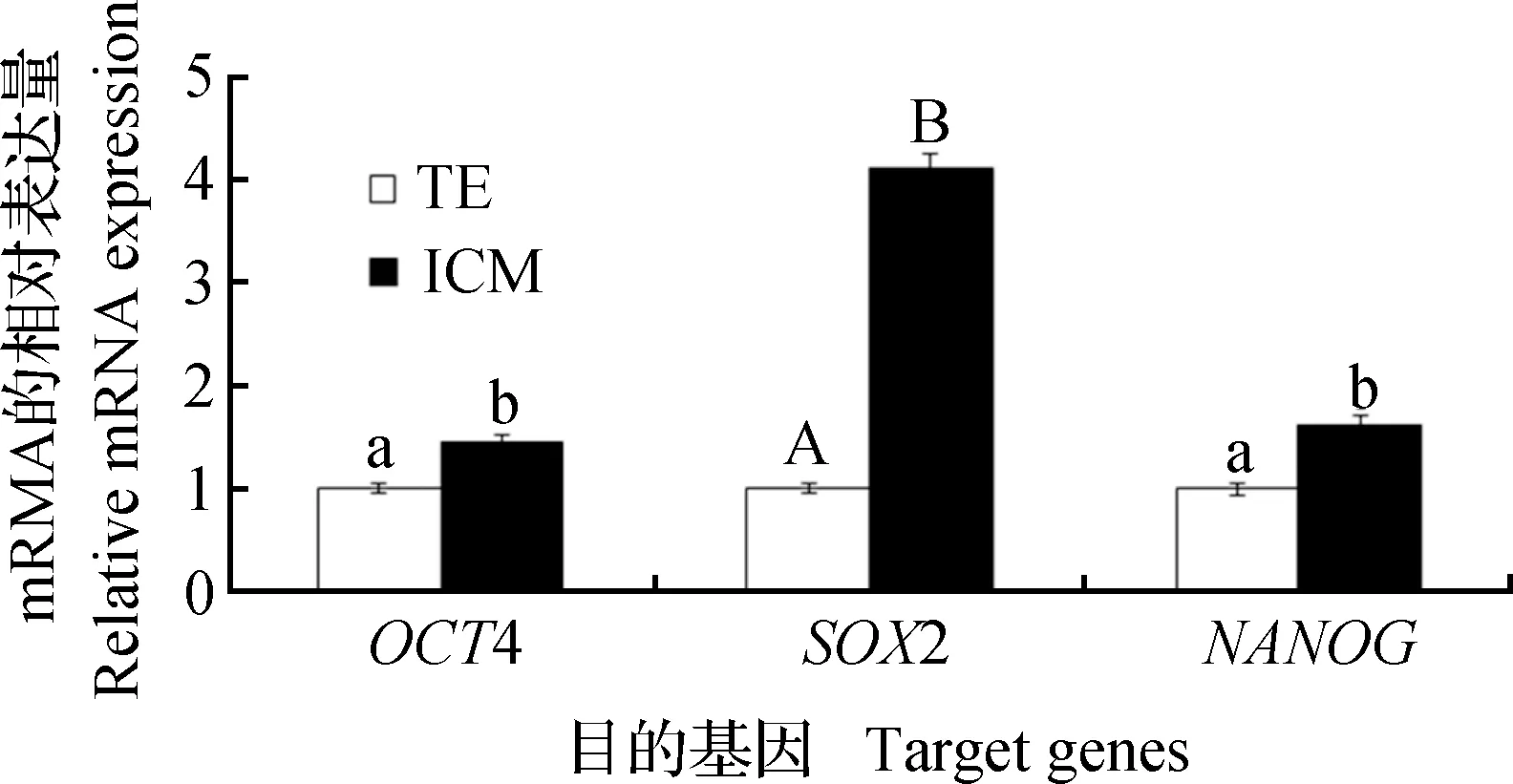
a,b.P<0.05;A,B.P<0.01图5 qRT-PCR检测3个基因在ICM和TE上的表达差异Fig.5 Differences between inner cell mass (ICM) and trophectoderm (TE) in expression of 3 target genes as determined by qRT-PCR
由于目前在牛上关于SSEA1、SSEA4和TRA-1-60 mRNA信息较少,所以本试验没有对其在ICM和TE上的表达进行qRT-PCR验证。本试验采用免疫磁珠法分离获得高纯度的ICM 和TE细胞,并通过qRT-PCR来进一步验证OCT4、SOX2和NANOG在牛囊胚ICM和TE中的表达。结果显示这3个基因在ICM和TE中的表达存在差异,其中SOX2的差异极显著,这表明SOX2最有可能成为牛ICM克隆的候选多能性标记。M.D.Goissi等[29]研究发现,SOX2在牛囊胚ICM中特异表达,并且SOX2表达量下降会导致附植前胚胎发育迟缓,这也表明SOX2有利于维持牛类ES细胞的多能性。而 H.Nagatomo等[16]用 Microarray的方法来筛选牛囊胚ICM和TE中的差异表达基因,结果显示SOX2在ICM中表达量显著上调;同时qRT-PCR 验证OCT4和NANOG在ICM和TE中的表达情况,结果NANOG在ICM中的表达量显著高于在TE中的表达量,而OCT4在二者中的表达量没有区别;此研究表明,SOX2在牛囊胚ICM中的作用与其在小鼠囊胚中相似,它极有可能是牛囊胚ICM中的特异多能性标记基因。
H.Sumer等[30]研究发现,仅用OCT4、SOX2、KLF4和c-MYC不足以将牛成纤维细胞诱导为多能性细胞,而NANOG作为一个调节多能性的关键因子,在这个过程中起着至关重要的作用。此外,G.Gong等[24]利用RT-PCR检测其所建立的牛类ES细胞系中多能性基因的表达情况,结果显示NANOG和OCT4均有表达。V.Verma等[21]建立了牛类ES细胞系,经RT-PCR和qRT-PCR检测显示NANOG在此类ES细胞中表达。这些研究结果表明,NANOG也可能与维持牛类ES细胞多能性相关。OCT4在小鼠和人ES细胞中特异表达,但是由于物种间存在差异,目前很多研究中所建立的牛类 ES 细胞系都不表达OCT4[17,31-32]。D.Harris等[33]在牛附植前胚胎培养液中添加了 2i(CHIR99021 和 PD0325901),然后利用免疫手术法分离获得牛囊胚 ICM 并接种,并用 RT-PCR 检测几个与多能性相关的特异基因在其形成的克隆中的表达情况,结果表明,添加 2i显著提高了SOX2和NANOG在ICM克隆中的表达水平,而对OCT4表达水平的影响不大。H.Nagatomo等[16]通过Microarray和qRT-PCR 检测也发现OCT4在牛囊胚 ICM与TE中的表达量没有明显差异。而 D.K.Berg等[34]研究发现,与小鼠不同,在牛囊胚早期发育阶段,OCT4不只在ICM中特异表达,在TE中也有表达。由此可见,OCT4 对于牛类 ES 细胞的作用还有待进一步研究。
综上所述,免疫荧光染色试验表明,在第10代牛囊胚ICM克隆上,表面标记蛋白(SSEA1、SSEA4和TRA-1-60)以及多能性基因(OCT4、SOX2 和NANOG)均表达,而qRT-PCR结果表明,SOX2在ICM与TE上的表达差异极显著。本研究结果为早日确定牛类ES细胞的多能性分子标记及揭示其多能性调控网络提供参考,进而有助于加速牛ES细胞系的成功建立。
[1] KIM E Y,NOH E J,PARK H Y,et al.Establishment of bovine embryonic stem cell lines using a minimized feeder cell drop[J].CellReprogram,2012,14(6):520-529.
[2] RATHJEN J,LAKE J A,BETTESS M D,et al.Formation of a primitive ectoderm like cell population,EPL cells,from ES cells in response to biologically derived factors[J].JCellSci,1999,112(Pt5):601-612.[3] EVANS M J,KAUFMAN M H.Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,292(5819):154-156.
[4] THOMSON J A,KALISHMAN J,GOLOS T G,et al.Isolation of a primate embryonic stem-cell line[J].ProcNatlAcadSciUSA,1995,92(17):7844-7848.
[5] THOMSON J A,ITSKOVITZ-ELDOR J,SHAPIRO S S,et al.Embryonic stem cell lines derived from human blastocysts[J].Science,1998,282(5391):1145-1147.[6] LI P,TONG C,MEHRIAN-SHAI R,et al.Germline competent embryonic stem cells derived from rat blastocysts[J].Cell,2008,135(7):1299-1310.
[7] STICE S L,STRELCHENKO N S,KEEFER C L,et al.Pluripotent bovine embryonic cell lines direct embryonic development following nuclear transfer[J].BiolReprod,1996,54(1):100-110.
[8] CIBELLI J B,STICE S L,GOLUEKE P J,et al.Transgenic bovine chimeric offspring produced from somatic cell-derived stem-like cells[J].NatBiotechnol,1998,16(7):642-646.
[9] IWASAKI S,CAMPBELL K H,GALLI C,et al.Production of live calves derived from embryonic stem-like cells aggregated with tetraploid embryos[J].BiolReprod,2000,62(2):470-475.
[10] MITALIPOVA M,BEYHAN Z,FIRST N L.Pluripotency of bovine embryonic cell line derived from precompacting embryos[J].Cloning,2001,3(2):59-67.[11] SAITO S,SAWAI K,UGAI H,et al.Generation of cloned calves and transgenic chimeric embryos from bovine embryonic stem-like cells[J].BiochemBiophysResCommun,2003,309(1):104-113.
[12] WANG L,DUAN E,SUNG L Y,et al.Generation and characterization of pluripotent stem cells from cloned bovine embryos[J].BiolReprod,2005,73(1):149-155.
[13] CAO S,WANG F,CHEN Z,et al.Isolation and culture of primary bovine embryonic stem cell colonies by a novel method[J].JExpZoolAEcolGenetPhysiol,2009,311(5):368-376.
[14] FURUSAWA T,OHKOSHI K,KIMURA K,et al.Characteristics of bovine inner cell mass-derived cell lines and their fate in chimeric conceptuses[J].BiolReprod,2013,89(2):28.
[15] CONG S,CAO G,LIU D.Effects of different feeder layers on culture of bovine embryonic stem cell-like cellsinvitro[J].Cytotechnology,2014,66(6):995-1005.[16] NAGATOMO H,KAGAWA S,KISHI Y,et al.Transcriptional wiring for establishing cell lineage specification at the blastocyst stage in cattle[J].BiolReprod,2013,88(6):158.
[18] LA BLOMBERG,BPVL TELUGU.Twenty years of embryonic stem cell research in farm animals[J].ReprodDomAnim,2012,47(Suppl4):80-85.
[19] OZAWA M,HANSEN P J.A novel method for purification of inner cell mass and trophectoderm cells from blastocysts using magnetic activated cell sorting[J].FertilSteril,2011,95(2):799-802.
[20] OZAWA M,SAKATANI M,HANKOWSKI K E,et al.Importance of culture conditions during the morula-to-blastocyst period on capacity of inner cell-mass cells of bovine blastocysts for establishment of self-renewing pluripotent cells[J].Theriogenology,2012,78(6):1243-1251.
[21] VERMA V,HUANG B,KALLINGGAPPA P K,et al.Dual kinase inhibition promotes pluripotency in finite bovine embryonic cell lines[J].StemCellsDev,2013,22(11):1028-1042.
[22] BRACKETT B G,OLIPHANT G.Capacitation of rabbit spermatozoainvitro[J].BiolReprod,1975,12(2):260-274.
[23] ROSENKRANS C F,JR FIRST N L.Effect of free amino acids and vitamins on cleavage and developmental rate of bovine zygotesinvitro[J].JAnimSci,1994,72(2):434-437.
[24] GONG G,ROACH M L,JIANG L,et al.Culture conditions and enzymatic passaging of bovine ESC-like cells[J].CellReprogram,2010,12(2):151-160.
[25] BUEHR M,MEEK S,BLAIR K,et al.Capture of authentic embryonic stem cells from rat blastocysts[J].Cell,2008,135(7):1287-1298.
[26] SCHMITTGEN T D,LIVAK K J.Analyzing real-time PCR data by the comparative C (T) method[J].NatProtoc,2008,3(6):1101-1108.
[27] GOOI H C,FEIZI T,KAPADIA A,et al.Stage-specific embryonic antigen involves alpha 1 goes to 3 fucosylated type 2 blood group chains[J].Nature,1981,292(5819):156-158.
[28] ANDREWS P W,DAMJANOV I,SIMON D,et al.Pluripotency embryonal carcinoma clones derived from human teratocarcinoma cell line Tera-2:differentiationinvivoandinvitro[J].LabInvest,1984,50(2):147-162.
[29] GOISSIS M D,CIBELLI J B.Functional characterization of SOX2 in bovine preimplantation embryos[J].BiolReprod,2014,90(2):30.
[30] SUMER H,LIU J,MALAVER-ORTEGA L F,et al.NANOG is a key factor for induction of pluripotency in bovine adult fibroblasts[J].JAnimSci,2011,89(9):2708-2716.
[31] YINDEE K J S,JIANG G,KANOK P,et al.Establishment and long-term maintenance of bovine embryonic stem cell lines using mouse and bovine mixed feeder cells and their survival after cryopreservation[J].ScienceAsia,2000,26:81-86.
[32] VRANA K E,HIPP J D,GOSS A M,et al.Nonhuman primate parthenogenetic stem cells[J].ProcNatlAcadSciUSA,2003,100(suppl 1):11911-11916.
[33] HARRIS D,HUANG B,OBACK B.Inhibition of MAP2K and GSK3 signaling promotes bovine blastocyst development and epiblast-associated expression of pluripotency factors[J].BiolReprod,2013,88(3):74.[34] BERG D K,SMITH C S,PEARTON D J,et al.Trophectoderm lineage determination in cattle[J].DevCell,2011,20(2):244-255.
(编辑 程金华)
The Research of Pluripotency-related Marker Genes and Surface Markers in Bovine ICM Colonies
CUI Li-sha1,2,ZHAO Xue-ming2,HAO Hai-sheng2,DU Wei-hua2,MA You-ji1,ZHU Hua-bin2*,WANG Zong-li1*
(1.CollegeofAnimalScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China;2.InstituteofAnimalScience,ChineseAcademyofAgricuturalSciences,Beijing100193,China)
This study was designed to investigate the pluripotency-related markers of bovine ES cells so as to provide a basis for optimizing culture conditions of bovine ES cells and promoting its research progress.The inner cell mass (ICM) were separated from bovine IVF blastocysts,seeded on mouse embryonic fibroblasts cultured in 2i/LIF medium and then passaged mechanically.The pluripotent markers of the ICM-derived colonies were detected at passage 1 and passage 10 by immunostaining.Additionally,the ICM and trophectoderm (TE) isolated from bovine blastocysts by magnetic activated cell sorting were used for qRT-PCR to validate the differences in gene expression between ICM and TE.We have derived ICM colonies from bovine IVF blastocysts and cultured them to passage 10,which displayed typical stem cell morphology and expressed specific markers such as OCT4,SOX2,NANOG,SSEA1,SSEA4 and TRA-1-60.Moreover,the results of qRT-PCR showed thatOCT4,SOX2 andNANOGwere differentially expressed between ICM and TE,SOX2 showed the most significant difference.In conclusion,2i/LIF culture medium is helpful for the culture of the ICM-derived colonies from bovine IVF blastocysts,andSOX2 is more likely to be a candidate pluripotency-related marker gene of bovine ICM-derived colonies.
bovine;ICM;pluripotency-related marker;qRT-PCR
10.11843/j.issn.0366-6964.2015.07.009
2015-01-05
中国农业科学院北京畜牧兽医研究所家畜胚胎工程与繁殖创新团队(ASTIP-IAS06-2014);中央级公益性科研院所基本科研业务费专项(2014ywf-yb-2)
崔莉莎(1989-),女,山东菏泽人,硕士生,主要从事动物遗传育种与繁殖方面的研究,E-mail:cuilishaxz@163.com
*通信作者:朱化彬,博士,研究员,E-mail:zhuhuabin@caas.cn;王宗礼,博士,研究员,E-mail:Wangzongli@sina.com
S823.2
A
0366-6964(2015)07-1141-09

