阿霉素不同给药部位对兔心收缩功能的影响研究
——湖北省教育厅科技计划项目《阿霉素静脉注射部位对兔心脏血流动力学的影响》成果介绍
黄霞丽,温茂兴,张家忠,杨义耀
(襄阳职业技术学院 医学院, 湖北 襄阳 441021)
一、课题研究背景、目标及内容
(一)课题研究背景
抗癌治疗中,临床上一般主要考虑药物对癌细胞的杀伤力、药物的急性毒性以及患者的短期内生存质量,[1]易忽略药物远期毒性。阿霉素(ADR)属蒽环类抗癌抗生素,具有抗瘤谱广、抗瘤活性强的特点,临床上广泛应用于治疗多种恶性肿瘤。为获得最大的治疗效果,常采用静脉注射或静脉冲入法。[1]但由于ADR属于强刺激性化疗药,静脉注射易引起静脉炎。为避免化疗时造成的血管损伤,对化疗病人提倡使用不同部位的静脉留置针。[1-2]且一般认为中心静脉与外周静脉给药相比较,中心静脉给药静脉炎的发生率低。[2-3]但中心静脉给药使药液回心路径缩短,会使药液回心速度加快,液体额外丢失少,心内药液浓度升高。[2,4]以上研究提示静脉注射给药部位的改变,药液回心速度、路径的不同,有致心室血流动力学改变的可能。
ADR的严重副作用是累积性、剂量依赖性的心肌毒性反应,[5-7]最终发生扩张性心肌病及充血性心力衰竭。剂量依赖性的心肌病变由于是DNA损伤导致的心肌细胞凋亡以及自由基的产生相关而呈现不可逆性。[7]
ADR心脏毒性早期表现(亚临床阶段)为绝大多数心脏收缩功能正常,[8-9]光镜下显示特异性的肌原纤维消失和空泡样变性,[8-10]且心肌病理损害远远早于心功能的改变。[11]这种改变美国学者研究表明手背静脉注射比静脉滴注ADR的心脏毒性高,[1]且胃肠道反应重。
对于多次注射ADR处于亚临床毒性阶段的心脏,从外周静脉和中心静脉给药,存在①静脉注射部位的改变会引起药液回心路径缩短、额外丢失减少、回心速度加快、心内药液浓度升高等。这些因素可能会加大心脏的前负荷;②由于药物进入心脏速度加快,存在加大心脏毒性的可能性。以上综合因素,对于已有病理损害的心肌是否会加大其衰竭状态而引起肿瘤患者输液的潜在危险,值得关注。
(二)课题研究内容、目标
1.课题研究内容:探讨不同部位注射ADR对处于亚临床阶段兔心脏收缩能力的影响,为临床治疗安全提供实验数据。
由于血流动力学监测常用的指标:左室收缩压(LVSP)、左室舒张末期压(LVEDP)、左室最大收缩速率(dp/dtmax)、左室最大舒张速率(-dp/dtmax)等,受负荷影响较小,对收缩能力变化较敏感,能定量评定心肌收缩能力,及早正确地反映心脏泵功能的下降。故本课题通过心室内插管的方法,采用血流动力学监测常用的指标,再结合心率以及光镜观察心、肝、肺组织的病理学改变,来衡量心脏功能的改变。
2.研究方法:普通级大耳白兔50只沿用临床“前导、后冲”的方法,注射ADR2.0 mg/kg·次×1次/周×4周,制备兔ADR早期心脏毒性模型。[8]于末次给药后12周通过心室内插管的方法,记录手术完成后从不同部位给药前后兔左室压。于30 min后分别从耳缘静脉、颈外静脉注射阿霉素(耳缘组、颈外组)和生理盐水(空白组、对照组),比较给药前后的左室压力,观察心肝肺组织光镜下变化。
3.研究目标:通过记录ADR对心脏血流动力学的作用随给药部位的变化规律,为临床找寻较好的给药方法以减少ADR的毒副性作用,提高肿瘤患者的生命和生存质量。
二、研究结果与结论
(一)腹腔肉眼观
耳缘组见胃肠运动缓慢,肠胃紧张度适度,腹腔内少量透明液体;未见毛细血管扩张、充血。颈外组可见多处毛细血管扩张、充血,个别毛细血管有渗血点;腹腔内有少量血性腹水。
(二)心、肝、肺组织镜下观
1.心肌组织镜下观察:肌细胞呈部分水肿和空泡变性,部分肌源纤维溶解,横纹消失;心肌细胞间隙明显增宽,并有少量白细胞的浸润,间质内还可见毛细血管扩张、不同程度的间质肿、出血,所有组别之间无明显差异。(见图1-2)
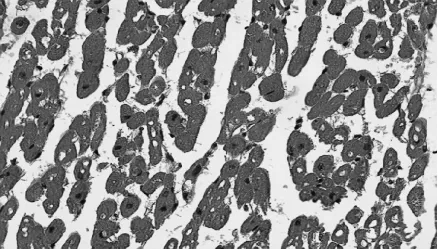
图1 耳缘组心肌组织(HE×400)
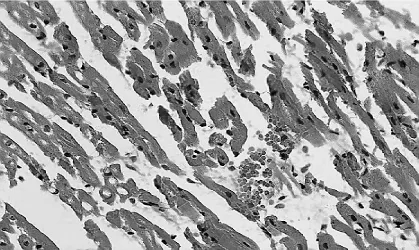
图2 颈外组心肌组织(HE×400)
2.肺组织镜下观察:所有组均出现肺间质增宽、纤维化,偶见少量肺大泡,呈现间质性肺炎的表现。具体各组的病理变化见表1。

表1 各组别肺部组织的变化
3.肝组织镜下观察:肝细胞出现明显的空泡样变性,偶见肝索断裂。各组病理改变见图3-4。
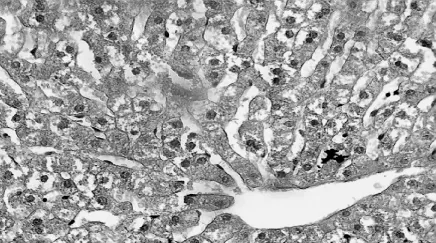
图3 耳缘组肝组织变化(HE.40×10)
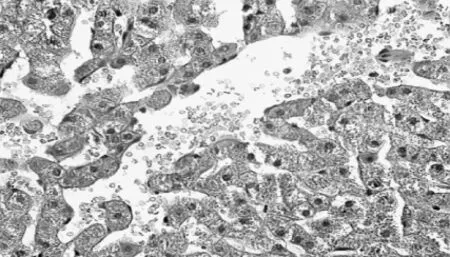
图4 颈外组肝组织变化(HE.40×10)
(三)心功能指标
1.用药前心功能指标:麻醉后,所有组别的LVSP、LVEDP、dp/dt.max、-dp/dt.max略有不同,但是各组间无明显差异,提示颈外组、耳缘组其心脏功能指标与正常动物相比较无明显差异。(见表2)
表2 各组动物再次给药前心脏血流动力学指标(±s)n=6
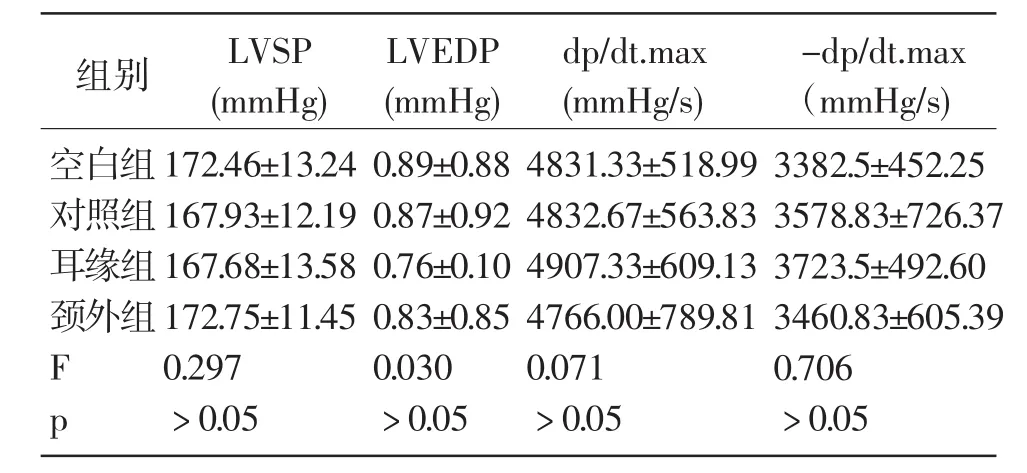
表2 各组动物再次给药前心脏血流动力学指标(±s)n=6
组别空白组对照组耳缘组颈外组LVSP(mmHg)LVEDP(mmHg)dp/dt.max(mmHg/s)-dp/dt.max(mmHg/s)F p 172.46±13.24 167.93±12.19 167.68±13.58 172.75±11.45 0.297﹥0.05 0.89±0.88 0.87±0.92 0.76±0.10 0.83±0.85 0.030﹥0.05 4831.33±518.99 4832.67±563.83 4907.33±609.13 4766.00±789.81 0.071﹥0.05 3382.5±452.25 3578.83±726.37 3723.5±492.60 3460.83±605.39 0.706﹥0.05
2.用药后30 min结果:颈外组较用药前主要表现为LVSP下降,LVEDP升高,dp/dtmax和-dp/dtmax下降较耳缘组大,p<0.05。各指标以用药后减去用药前的差值,具体数据见表3。
表3 30 min后各组动物各指标差值比较(±s)n=6
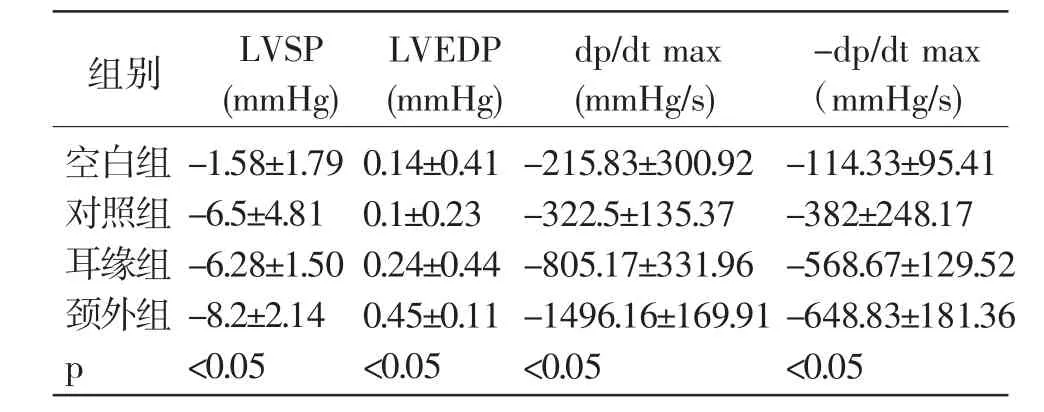
表3 30 min后各组动物各指标差值比较(±s)n=6
组别空白组对照组耳缘组颈外组p LVSP(mmHg)LVEDP(mmHg)dp/dt max(mmHg/s)-dp/dt max(mmHg/s)-1.58±1.79-6.5±4.81-6.28±1.50-8.2±2.14<0.05 0.14±0.41 0.1±0.23 0.24±0.44 0.45±0.11<0.05-215.83±300.92-322.5±135.37-805.17±331.96-1496.16±169.91<0.05-114.33±95.41-382±248.17-568.67±129.52-648.83±181.36<0.05
(四)结论
1.病理学表现说明,动物模型制作成功:本实验所有观察指标均于末次注射后12周进行检测,基本排除ADR的急性(1~2周)和亚急性(2周至3个月)毒性作用。与其他检测手段相比,组织学检查对于心肌病是较敏感可靠的特异性指标,早于心电图及超声心动图的变化,现所有组别的病理表现呈ADR心脏毒性的组织学特征。但是其心脏功能指标与正常动物相比较无明显差异,说明从耳缘静脉手推1 mg/mlADR生理盐水溶液2.0 mg/kg·次-1×1次/周×4周,形成了早期心衰的动物模型。
2.不同部位注射阿霉素对兔心收缩功能影响不同:路径短的可增加实验兔扩张型心肌病、心功能不全的发生率。研究结果显示颈外组较用药前LVSP明显降低,LVEDP明显升高及±dp/dtmax明显减小,提示心脏的舒缩功能皆有一定程度的损害。
三、创新之处与推广价值
(一)创新之处
沿用临床“前导”、“后冲”、常规剂量ADR药液时,从回心路径短的部位给药会使处于亚临床的心脏收缩能力下降,说明中心静脉给药有增加扩张型心肌病、心功能不全的发生率的可能。ADR所形成的心肌病,早期HR无显著改变,主要表现为心脏血流动力学的改变。
(二)推广价值
ADR的给药方法、部位的改变会加大其心脏毒性作用,造成处于亚临床阶段的心脏功能下降。这说明在抗癌治疗时,对于ADR这一类的发疱剂,给药时不应该只是考虑其局部刺激作用,还应充分考虑ADR心脏的毒性作用除与累积剂量有关外,也与注射速度和浓度有关。而给药部位改变会加大毒性作用,在临床多次注射化疗药物的患者,应该尽量选择上肢离心较远的血管给药。
ADR性心肌病,早期HR无显著改变,主要表现为心脏血流动力学改变,提示对静脉注射ADR临床常用的以病人主观感觉和早期以心率为判断输液速度和量的标准,具有不准确性和滞后性。
[1]王哲海,孔莉,于金明.肿瘤化疗不良反应与对策[M].济南:山东科学出版社,2002:1-24.
[2]张晓静.国内静脉留置针临床应用[J].中华护理杂志,2002(3):219-222.
[3]孙伟蔚,倪克梁.中心静脉与外周静脉置管在恶性肿瘤化疗中的应用[J],世界肿瘤杂志,2006(2):120-122.
[4]李黎.静脉输液部位对严重烧伤休克循环的影响[J].中华外科杂志,2006(1):34-35.
[5]张健,金哲.阿霉素心肌病的研究进展[J].中外医学研究,2013(13):152-153.
[6]Elliott P.Pathogebesis of cardiotoxicity induced by Anthracyclines[J].Semin Oncol,2006 (l8):2-7.
[7]时长淮.阿霉素毒副作用机制及其防治研究进展[J].实用临床医药杂志,2013(3):107-110.
[8]礼广森 ,任卫东,张卓,等.阿霉素致兔早期心脏毒性模型的建立及超声评价[J].中国医学影像技术,2006(4):548-550.
[9]Oberholzer K,Kunz RP,Dittrich M,et a1.Anthracycline-induced cardiotoxicity:cardiac MRI after treatm ent for childhood cance[J].Rofo,2004(9):1245-1250.
[10]柯永胜,芮景,李建中,等 .心力衰竭病理生理学与循证治疗学[M].合肥:安徽科学技术出版社,2007:40-65.
[11]Arnolda L,McGrath B,Cecks M,et a1.Adriamycin eardiomyopathy in the rabbit:an animal model of low output cardiac failure witlI activation ofvasoconstrictor mechanisms[J].Cardiovasc Res,1985(6):378-382.

