补注区别浓硫酸和稀硫酸的方法
朱华英+刘怀乐
摘要:针对人教版高一化学必修一练习题“区别相同体积的浓硫酸和稀硫酸”,列举分析了近30种较为简易、实用、安全的鉴别方法。并对教学参考书上提供的个别方法提出了不同的看法。
关键词:浓硫酸;稀硫酸;区别方法;实验探究
文章编号:1005–6629(2015)1–0057–04 中图分类号:G633.8 文献标识码:B
人教版高一化学必修1第104页有如下一道练习题:在2支试管中盛有相同体积的浓硫酸和稀硫酸,试设计简单的方法区别它们。看看谁设计的方法最多,谁设计的方法最简单,谁设计的方法最有创意。
按此要求,跟现行教材配套发行的《教师教学用书》第78~79页,一共提供了10种方法供教师教学时参考。本文拟对浓硫酸和稀硫酸的区别方法做些补注。
1 教师对所区别的硫酸必须做到心中有数
下表列出了浓H2SO4和几种常用稀H2SO4在15℃时的物理常数[1]。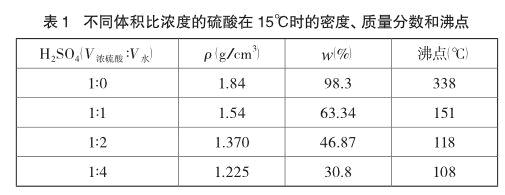
不过笔者注意到,全国各地的化学试剂商店出售的分析纯浓H2SO4,都是符合部颁标准GB/T625-1989,浓硫酸的质量分数为95%~98%。也就是说,我们实际用到的符合国家标准的试剂浓硫酸的浓度,一般都略低于教科书上说的浓H2SO4(ρ=1.84 g/cm3浓度为98%)。上表所列数据可供实验者参考。其次,在实际区别时,实验者切不可把稀H2SO4当成是水!否则脱离实际。建议教师引导学生实际区别时一般以选用1:1~1:4的稀H2SO4为宜。
2 区别浓硫酸和稀硫酸方法补注
2.1 煮沸法
两个小试管里,分别注入2mL浓H2SO4和2mL体积比为1:1~1:4的稀H2SO4,用同一个有稳定小火焰的酒精灯,用同样的手势给液体加热煮沸这两种酸。笔者煮沸1:1的稀H2SO4用了45s,煮沸浓H2SO4用了95s(煮沸水约30s)。可见煮沸法是区别这两种酸原理比较简单,操作比较容易的一种方法。
还有比煮沸法更简单的方法。
2.2 表面张力比较法
(1)浓H2SO4的表面张力比水大。同样两只滴管的管尖端悬一滴液体,体积小的是浓H2SO4,体积大的是稀H2SO4(如果是水滴,体积会更大些)。
(2)取两个规格相同的小量筒,用同一个胶头滴管,用相同的手势取相同滴数的酸(如50滴、60滴、80滴均可)滴入量筒,体积小的是浓H2SO4,体积大的是稀H2SO4(如果是相同滴数的水,体积会更大些)。
注:1滴液体体积的大小跟两种因素有关:一是液体的表面张力——表面张力大的,1滴液体体积小,表面张力小的,1滴液体的体积大;二是滴管尖端的口径——口径小的,1滴液体的体积小,口径大的,1滴液体的体积相对较大。一般说来,标准酸碱滴定管,约是19~20滴/mL,1滴≈0.05mL;1mL水大约是19~20滴/mL;1mL浓H2SO4大约是39~41滴/mL。同体积的水与浓H2SO4的滴数比约是1:2;1体积稀H2SO4和浓H2SO4与水的体积关系理应在1与2之间。
(3)在一块玻璃片相隔2~3cm的A、B两处,各滴下1滴酸液,玻片上被浸润面积小的是浓H2SO4,浸润面积大的是稀H2SO4。
2.3 密度比较法
(1)把两个小试管插入盛满水的大烧杯中,注入相同体积的两种酸(如各10mL),试管下沉得深的是浓H2SO4,另一个是稀H2SO4(如图1)。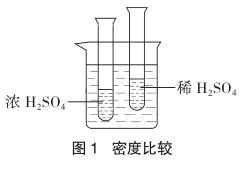
(2)在托盘天平的左右两个盘上各放一个相同大小的表面皿(或培养皿),调平天平后,用滴管分别注入相同体积(如两滴管)的酸液,天平托盘下降明显的是浓H2SO4,另一个是稀H2SO4。
2.4 吸水法
(1)在托盘天平的左右两个盘上各放一个相同大小的表面皿,两个表面皿分别都注入相同体积的两种酸后,迅速把天平调平,观察2min后,托盘下移的酸是浓H2SO4,另一个是稀H2SO4。(此法在北方冬季气体干燥时可能不明显-编者注)
(2)试管里注入2~3mL浓H2SO4,加入2~3滴饱和FeSO4溶液,逐渐析出大量白色FeSO4沉淀(FeSO4不溶于浓H2SO4)的是浓H2SO4,另外一个是稀H2SO4。
(3)按下表所列(示)顺序操作,每个试管里都加入黄豆堆量大小有色固体(结晶水合物),当各加入1滴管酸液,观察在1~2min之后,如果有表内所示颜色变化现象的是浓H2SO4,没有颜色变化的是稀H2SO4。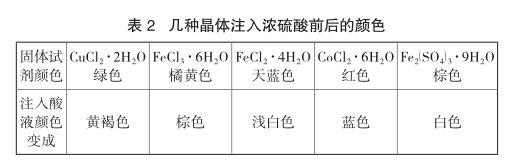
(4)两种盛H2SO4的试管都用胶塞密封好存放一些时间。如图2所示,在插有单孔橡皮塞玻璃棒的一端,用棉线或胶圈固定好一片浸湿有红色CoCl2溶液的滤纸,插入盛有酸液的试管密封好,经过3~5min后,如果红色试纸变成蓝色的是浓H2SO4,没有颜色变化的是稀H2SO4。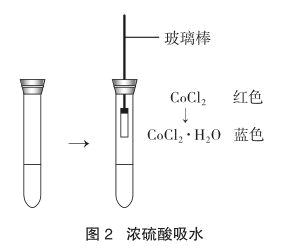
实验者注意,浸湿滤纸片用的试剂最好用CoCl2的浓溶液,也可以用绿色的CuCl2浓溶液,不宜用蓝色的CuSO4溶液。
(5)用温度计水银球一端沾取一点酸液,悬置在空气中观察温度变化:温度上升幅度较大的是浓H2SO4,温度没有变化或略有上升的是稀H2SO4。
2.5 脱水法
(1)在一片废报纸的A、B两处,分别滴加1~2滴液体,液体浸渍处迅即变黑的是浓H2SO4,没变化的是稀H2SO4。
(2)用酸液把火柴梗(木条)浸湿,片刻后能使火柴梗变黑的是浓H2SO4,不能使火柴梗变黑的是稀H2SO4。
2.6 与纤维素反应法
(1)选一片滤纸,或红、蓝色石蕊试纸,或pH试纸,在纸上滴1~2液体,滤纸或试纸被液体溶解的是浓H2SO4(滤纸暂不炭化,溶解出一个空洞),没有这种现象的是稀H2SO4。
(2)两个小试管里都注入约2mL液体,用玻璃棒送进去酒精棉球那样一丁点脱脂棉团,振荡试管,棉团能被液体溶解(化了)的是浓H2SO4,棉团没有发生变化的是稀H2SO4。
2.7 氧化法
(1)用玻璃棒沾取半滴液体去浸湿火柴梗的药头,2~3s之后,能使火柴药头着火燃烧的是浓H2SO4,没有这种现象发生的是稀H2SO4。原来,火柴药头中有KClO3,它与浓H2SO4接触会发生下列反应[2]:
3KClO3+2H2SO4=KClO4+2KHSO4+H2O+2ClO2
ClO2是一种强氧化剂,本身可燃烧,也极易使可燃的火柴梗燃烧。
(2)两个试管里都放进绿豆大小的KClO3晶体,用滴管注入几滴液体,如果听见试管里发出一连串爆炸声音,那加入的这种液体就是浓H2SO4,而稀H2SO4没有这种现象。反应原理同前,这是浓H2SO4和KClO3反应生成ClO2同时放热发生爆炸所致。
(3)两个试管里各放进一丁点白色的KI晶体,用滴管各加入1~2滴液体把晶体浸湿,使白色晶体变成紫黑色的是浓H2SO4,不出现这种现象的是稀H2SO4。
2KI+3H2SO4=2KHSO4+I2+SO2↑+2H2O
(4)两个试管分别注入1~2mL样品酸,稍微加热(不必煮沸),投入米粒大的NaBr(或KBr)晶体,溶液显橙红色并伴有白雾冒出管口的是浓H2SO4,没有这种现象的是稀H2SO4。
NaBr+H2SO4=HBr↑+NaHSO4
2NaBr+3H2SO4=2NaHSO4+Br2+SO2↑+2H2O
(5)两个试管分别注入1~2mL样品酸,再分别滴入1~2滴饱和NaBr溶液,溶液颜色逐渐由浅红变成橙红的是浓H2SO4,无颜色变化的是稀H2SO4。
(6)两个试管分别都注入2mL样品酸液,分别放进一片光亮的紫红色Cu片,两个试管都没有什么现象发生,当加热酸液,酸液逐渐呈浅棕色—棕色—棕黑色的是浓H2SO4,没有颜色变化的是稀H2SO4。
(7)两个试管分别都注入2mL样品硫酸,分别滴进1~2滴饱和蔗糖溶液,逐渐呈棕色到棕褐色再到黑色的是浓H2SO4,另一个是稀H2SO4(饱和蔗糖溶液中的水与浓H2SO4混合时放热,热的浓度较大的稀硫酸仍然具有较强的氧化性)。
2.8 复分解反应法
用石灰石粉区别:这或许是读者不曾想到的。原来石灰石粉末与稀H2SO4反应生成不溶性CaSO4(不溶于稀H2SO4),反应一开始就趋于停滞状态(产生CO2气泡明显要少);而与浓H2SO4反应生成可溶性Ca(HSO4)2而离开CaCO3,使反应持续下去,产生CO2气泡又多又快。
CaCO3+2H2SO4=Ca(HSO4)2+H2O+CO2↑
在两个试管里,都装入少量石灰石粉末,用滴管加入待区别酸液,反应最激烈,产生大量气泡的是浓H2SO4,产生气泡相对较少的是稀H2SO4。
2.9 粘度法
两个小试管里都装入相同体积(如10mL)样品硫酸,当倒置试管把液体全部倒出时,最容易倒出来,同时又流淌得干净利索彻底的是稀H2SO4,那种像炒菜倒菜油一样,流淌缓慢,甚至流淌成细线,最后1~2滴很难滴下的,是粘稠度较大的浓H2SO4。
2.10 H+氧化法
两个试管里都注入2mL酸液,分别投入Zn粒,Zn被H+氧化立即冒气泡的是稀H2SO4,不立即冒气泡的是浓H2SO4。
3 给导电法的补注
按教材练习题要求,区别方法要操作简单,有创意,即方法本身要看得见,摸得着,用得上,用得灵。以上合计总共罗列了除教师教学用书以外的近30种方法,未必都符合上述要求。读者可以把你认为操作简单、最有创意的方法择其善而用之。
笔者最后还想补注的就是对《教师教学用书》的区别方法(10)-导电法的一些认识。
确有多处文献报道说[3]:不含杂质的100%的硫酸(所谓—水合SO3)几乎是不传导电流的。并由图3可以看出,大约30%(1:4)的硫酸具有最好的导电性。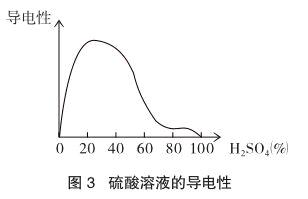

笔者实地考查了浓H2SO4的导电性实验,那是一个一做就灵(导电)、没有任何难度的实验。
笔者认为,我们教材提供的习题是“两支试管中盛有相同体积的浓H2SO4和稀H2SO4”。这是一个非常实际的问题,谁能提供那种理论上真正100%的无水H2SO4呢?即使可以提供,在实际使用过程中,具有如此强烈吸水性的浓H2SO4能防止它吸收空气中的水么?更何况我们实际能够买到的浓H2SO4,只能是符合部颁标准的分析纯的含H2SO4 95%~98%的浓H2SO4。一句话,现实中没有100%的纯硫酸。可见,即使是100%纯H2SO4和我们可能提供给学生区别的浓H2SO4实际上都是可以导电的。所以《教师教学用书》推荐的用导电法区分浓H2SO4和稀H2SO4的方法是脱离实际的,不可取的。
参考文献:
[1][苏] Ю. B.卡尔雅金著.无机化学试剂手册[M].北京:化学工业出版社,1969:289~293.
[2]傅鹰著.大学普通化学(下册)[M].北京:人民教育出版社,1982:327~328.
[3]Б.В.涅克拉索夫著.普通化学教程(中册)[M].上海:商务印书馆,1956:296.
[4]北京师范大学无机化学教研室编.无机化学(下册)(第四版)[M].北京:高等教育出版社,2003:50.
[5]陆英麟.无水硫酸能否导电[J].化学教育,1988,(4):55.

