基于常压室温等离子体诱变技术选育高产色氨酸突变株的研究
杨立鹏,李小刚,魏爱英,陈金龙,马风勇,贾惠萍,孟刚
(宁夏伊品生物科技股份有限公司,宁夏银川 750100)
基于常压室温等离子体诱变技术选育高产色氨酸突变株的研究
杨立鹏,李小刚,魏爱英,陈金龙,马风勇,贾惠萍,孟刚
(宁夏伊品生物科技股份有限公司,宁夏银川 750100)
本研究通过常压室温等离子体(ARTP)微生物育种技术,选育到一株高产L-色氨酸的突变株TRP-YP-3-2。与出发菌TRP-1201相比,该突变株生长及耗糖更快、产酸更高。TRP-YP-3-2色氨酸产量达到61.4 g/L,糖酸转化率达到19.25%,比出发菌分别提高了15.41%和22.77%。TRP-YP-3-2的产酸遗传稳定性研究发现经过30代培养后,仍具有很好的遗传稳定性。本研究不仅获得了一株高产色氨酸的突变株,具有很大的经济价值;同时确立的育种方法可为其他工业微生物的诱变育种提供有益的参考。
常压室温等离子体;色氨酸;高通量筛选
L-色氨酸(L-Tryptophan),化学名为L-2-氨基-3-吲哚基丙酸,属于中性芳香族氨基酸,是人和动物八种必需氨基酸之一,对人和动物的新陈代谢及生长发育具有重要作用,被认为是第二必需氨基酸,广泛应用于食品、医疗及饲料行业[1-4]。随着微生物法生产色氨酸研究的不断深入,L-色氨酸的生产已经由早期的化学合成法和蛋白质水解法发展为现在的微生物发酵法。
常压室温等离子体(Atmoshpheric and Room Temperature Plasma,ARTP)能够在大气压下产生温度在25~40°C之间、具有高活性粒子(包括处于激发态的氦原子、氧原子、氮原子、OH自由基等)浓度的等离子体射流。研究表明,ARTP富含的活性粒子能够使微生物细胞壁/膜结构及通透性发生改变,造成遗传物质损伤,并诱发细胞启动SOS修复机制。SOS修复过程为一种高容错率修复,因此修复过程中产生种类丰富的错配位点,并最终稳定遗传进而形成突变株[5]。常压室温等离子体对人和环境无危害、设备简单、操作简便[6-7]。
1 材料和方法
1.1 材料
1.1.1 试剂
酵母粉、葡萄糖(分析纯)、柠檬酸(分析纯)、豆粕、生物素(分析纯)、对二甲氨基苯甲醛(分析纯)、硫酸(分析纯)、色氨酸标准品(分析纯)、NaNO3(分析纯)、K2HPO4(分析纯)、KH2PO4(分析纯)、(NH4)2SO4(分析纯)、FeSO4(分析纯)、MnSO4(分析纯)、CaCO3(分析纯)、MgSO4(分析纯)。
1.1.2 仪器
ARTP诱变系统(ARTP-Ⅱ,北京思清源生物科技有限公司);高速冷冻离心机(Centrifuge 5810R,Eppendorf);水浴恒温振荡器(SHA-C,常州国华电器有限公司);超净工作台(SW-CJ-1FD,上海博迅实业有限公司医疗设备厂);漩涡振荡仪(MIXMATE混匀小精灵,Eppendorf);754N紫外可见分光光度计(上海菁华科技仪器有限公司);恒温摇床(SUKUN SKY-211C,上海苏坤实业有限公司);SBA-40生物传感分析仪(山东省科学院研究所)。
1.1.3 菌种和培养基
菌种:色氨酸生产菌TRP-1201(Escherichia coli),由宁夏伊品生物科技股份有限公司菌种中心提供。
种子培养基(g/L):K2HPO424,KH2PO49.6,(NH4)2SO45,MgSO41,酵母粉15.2,葡萄糖10,pH 7.0,121°C灭菌20 min。葡萄糖和其他成分灭菌后再混合。
固体培养基:种子培养基+1.5%琼脂。
摇瓶发酵培养基(g/L):MgSO42,(NH4)2SO48,KH2PO47,CaCO350,柠檬酸2,糖蜜10,豆粕4,葡萄糖10,微量元素混合液1 mL,pH 7.0,121°C灭菌20 min。
5 L发酵罐发酵培养基(g/L):酵母粉1.5,柠檬酸2,葡萄糖10,MgSO42,(NH4)2SO41,KCl 5,(NH4)2HPO43,微量元素混合液1 mL,pH 7.0。115°C灭菌15 min。
1.2 方法
1.2.1 ARTP诱变TRP-1201致死率曲线的测定
一般诱变理论认为,当细菌受到物理或化学因子的影响,致死率达到90%以上时,其突变率会以几何级数增加。因此,需要确定ARTP对TRP-1201的致死率。本研究所用ARTP诱变系统额定功率为150 w,利用99.99%高纯氦气作为载气,流速8 L/min,等离子体发射源距载片2 mm。取培养至对数期的TRP-1201菌液(OD6600.4~0.6,37°C、180 r/min,2~3 h)10 μL,点样至载片上,处理时间分别选择10 s、20 s、30 s、40 s、50 s、60 s、70 s和80 s。之后,将载片放入1 mL无菌的种子培养基中,于漩涡振荡仪上振荡30 s,将载片上经ARTP处理的菌体完全混匀至种子培养基中。将上述混合液稀释适当梯度,取100 μL稀释液均匀涂布于固体培养基上,37°C培养过夜,菌落计数,以未经ARTP处理的TRP-1201做对照。计算致死率。

1.2.2 ARTP诱变选育高产色氨酸突变株
用接种环挑一环色氨酸生产菌TRP-1201加入含有8 mL种子培养基的50 mL三角瓶中,37°C、180 r/min培养2~3 h至OD660达到0.4~0.6。取10 μL培养液进行ARTP诱变,诱变时间选择致死率达到99%的处理时间。诱变后,将载片放入含1 mL种子培养基的EP管中,漩涡振荡30 s,将培养基涂布于2~3个固体平板上,37°C培养过夜。根据菌落大小、丰度、完整度,随机挑取单菌落进行摇瓶发酵,考察发酵性能[8]。
1.2.3 摇瓶初筛TRP-1201突变株
将经上步挑选的TRP-1201突变株转接于种子培养基中,37°C、180 r/min培养至OD660达到6.0~8.0。然后以10%的接种量转接于发酵培养基中(500 mL挡板三角瓶,装液量50 mL),37°C、180 r/min培养24 h,检测各突变株发酵液的pH、OD660及色氨酸含量。挑取色氨酸产量较出发菌有明显提高的突变株进行5 L发酵罐复筛。
1.2.45 L发酵罐复筛TRP-1201突变株
对经过摇瓶初筛得到的TRP-1201突变株进行5 L发酵罐复筛。发酵初始培养基1.5 L,接种量13%,采用补料分批发酵(补加60%葡萄糖,用氨水调pH)的方式进行发酵,发酵温度37°C,pH维持在7.0,溶解氧控制在10%~20%,发酵周期36 h。
1.2.5 色氨酸含量检测
色氨酸的详细检测方法见参考文献[9]。
1.2.6 菌体OD测定
用1%盐酸溶液(用于消耗摇瓶发酵液中的CaCO3)将摇瓶发酵培养液稀释至适当浓度,在分光光度计660 nm波长处测定吸光值。
用去离子水将发酵罐中发酵培养液稀释至适当浓度,在分光光度计660 nm波长处测定吸光值。
1.2.7 发酵液残糖测定
利用生物传感分析仪测定培养液(发酵培养及种子培养)中的残糖含量。首先,取1 mL培养液,12000 r/min离心3 min,取上清液,稀释100倍,用于残糖的测定。接着,用取样针准确取25 μL葡萄糖标准液加入生物传感仪进行定标,定标完毕之后。取25 μL待测样品,读数。
2 结果与分析
2.1 ARTP致死率曲线测定
按照方法1.2.1对色氨酸生产菌进行了致死率曲线的测定,见图1。
由图1可知,当ARTP处理时间为10 s时,TRP-1201致死率为38.6%;随着处理时间的延长,其致死率在不断上升;当处理时间为40 s时,TRP-1201致死率达到99.3%,本文选择将致死率控制在99%以上,一方面,可以确保TRP-1201得到充分的诱变;另一方面,可以控制诱变后单位体积突变株的数量。因此,选择ARTP诱变40 s作为下一步TRP-1201诱变的处理时间。

图1 ARTP诱变TRP-1201致死率曲线
2.2 突变株的初筛
对色氨酸生产菌TRP-1201进行了30次诱变,根据菌落大小、完整度、丰度挑选了684个单菌落,进行摇瓶初筛。结果发现有10株突变株产酸量较出发菌TRP-1201有明显提高(图2)。TRP-1201摇瓶平均产酸为5.1 g/L,其中突变株3-2产酸最高达到了7.2 g/L,产酸量提高41.18%。由于摇瓶筛选误差较大、结果不稳定,所以,需要对初筛得到的10株产色氨酸正突变株进行5 L发酵罐小试发酵产酸复筛,考察各突变株的产酸性能。

图2 TRP-1201与突变株产酸比较
2.3 突变株复筛
对经过摇瓶初筛得到的10株正突变株进行5 L发酵罐小试发酵复筛(按1.2.4的方法进行),每株突变株做两次重复试验,考察突变株的产酸性能。结果列于表1。
5 L发酵罐产酸复筛试验结果显示,在发酵条件一致的情况下,突变株3-2产酸及转化率较出发菌有了明显的提升,分别提高15.41%和22.77%,将该突变株命名为TRP-YP-3-2。
2.4 TRP-YP-3-2生长性能研究
为了考查诱变出发菌TRP-1201与正突变株TRP-YP-3-2生长情况的差异,利用摇瓶(500mL,装液量50 mL)对获得的高产色氨酸突变株TRP-YP-3-2进行生长性能研究。培养时间12 h,从接种开始,每隔2 h测种子培养基OD660和残糖,结果见图3。

表1 TRP-1201突变株5 L发酵罐产酸复筛结果
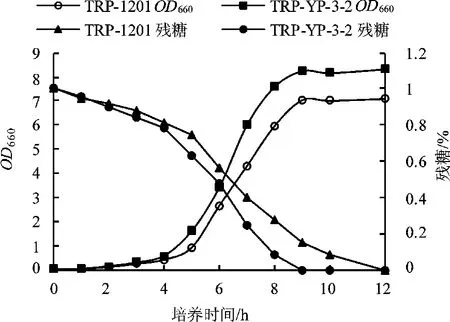
图3 出发菌株TRP-1201与突变株TRP-YP-3-2生长性能比较
从图3中可以发现,与出发菌TRP-1201相比,突变株TRP-YP-3-2表现出了优良的生长性能。TRP-1201和TRP-YP-3-2在经历了4 h左右的延滞期后,开始进入对数生长期;其中突变株TRP-YP-3-2生长速度较快,且耗糖速率也比出发菌TRP-1201快。
2.5 TRP-YP-3-2发酵性能的研究
为了考察突变株TRP-YP-3-2发酵过程中的产酸性能,以出发菌TRP-1201作对照,5 L发酵罐进行分批补料发酵产酸验证,发酵周期36 h。补料葡萄糖浓度为60%(w/v);通过控制补糖速度使发酵溶氧在15%~25%之间,残糖不超过0.5%。在发酵全程,每隔2 h测OD660及残糖,从发酵12 h开始,每隔6 h测产酸量。结果见图4。
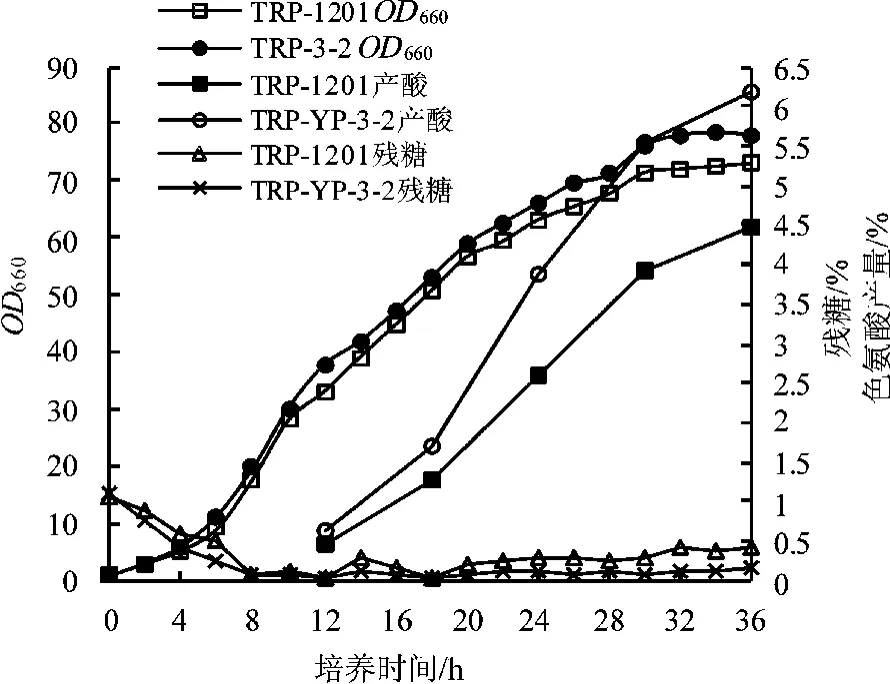
图4 出发菌株TRP-1201与突变株TRP-YP-3-2发酵性能比较
由图4可见,出发菌TRP-1201与突变株TRP-YP-3-2经历了短暂的延滞期后,开始进入对数生长期,在26 h后进入稳定期。TRP-YP-3-2较出发菌生长更快,最终OD660高出出发菌TRP-1201约5左右。同时,突变株的产酸量更高、耗糖更快,产酸达到61.8 g/L。
2.6 TRP-YP-3-2遗传稳定性研究
由于回复突变的存在,经常会导致工业菌株发酵性能的退化。因此,需要对TRP-YP-3-2进行产酸遗传稳定性研究。为了进行遗传稳定性研究,在固体平板上对TRP-YP-3-2连续传代至30代,每隔5代进行5 L发酵罐产酸验证,考察其产酸性能。结果见图5。
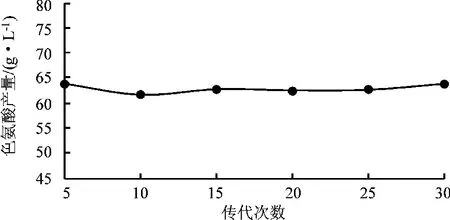
图5 TRP-YP-3-2遗传稳定性
从图5可见,经过30代传代,突变株TRPYP-3-2仍具有稳定、高效的产酸性能,在5 L发酵罐中,色氨酸产量维持在62 g/L左右。
3 结论
本研究通过常压室温等离子体(ARTP)工业微生物育种技术结合高通量筛选方法,得到一株高产色氨酸突变株TRP-YP-3-2。与出发菌TRP-1201相比,突变株TRP-YP-3-2生长及耗糖更快、产酸更高,色氨酸产量达到61.4 g/L,糖酸转化率达到19.25%,分别提高了15.41%和22.77%。经过遗传稳定性试验,发现在连续传代30代后,突变株TRP-YP-3-2仍然具有高效的产酸性能,产酸稳定地维持在62 g/L左右。
本研究得到的高产色氨酸突变株还需进一步进行中试发酵产酸验证,考察其发酵性能,为工业化生产提供必要的支撑;同时,需要对突变株TRP-YP-3-2进行分子水平的研究,分析其生长及发酵性能提高的内在原因。
[1]韦和平,吴梧桐.色氨酸生物工程研究进展[J].药物生物技术,1998,5(3):180-185.
[2]杨振军,杨松鹤,等.有关褪黑素的研究进展[J].承德医学院报,2004(1):74-77.
[3]陈涛,陈宁.L-色氨酸的生产及其代谢控制育种[J].生物技术通讯,2000,11(2):141-145.
[4]宋文霞,王瑞明.L-色氨酸的研究[J].农产品加工学刊,2005(3):18-20.
[5]Wang L Y.Studies of the mechanisms and applications of the atmospheric room temperature plasmas acting on the microbes [D].Beijing∶Tsing hua University,2010.
[6]Lu Y,Wang L Y,Ma K,et al.Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma(ARTP)[J].Biochemical Engineering Journal,2011,55(1)∶17-22.
[7]Jiang P X,Wang L Y,Huang Z L,et al.Studies on the mutation breeding mechanism of Streptomyces avermitilis by a novel atmospheric-pressure,low-temperature discharge plasma[J].Journal of Biotechnology,2008,136S,S22.
[8]蔡友华,李文锋,等.新型常压室温等离子体(ARTP)快速诱变高产苏氨酸的突变株[J].现代食品科技,2013,29(8):1888-1892.
[9]黎景丽,文一彪.对氨基酸测定的研究(上)[J].中国调味品,2002(12):34-37.
(责任编辑:朱小惠)
表3 不同的辅助有机氮源对发酵结果的影响
参考文献:
[1]贾士儒,王明霞,毛希琴,等.气升式生化反应器提高衣康酸产酸率的研究[J].食品与发酵工业,1997,23(6):36-40.
[2]Gyamerah M.Factors affecting the growth form of Aspergillus terreus NRRL 1960 in relation to itaconic acid fermentation[J]. Applied Microbiology and Biotechnology,1995,44(3-4)∶356-361.
[3]金其荣,张继明,徐勤,等.有机酸发酵工艺学[M].北京:中国轻工业出版社,1992:500.
[4]Lockwood L B,Ward G E.Fermentation process for itaconic acid[J].Industrial&Engineering Chemistry,1945,37(4)∶405-406.
[5]Batti M,Schweiger L B.Process for the production of itaconic acid∶US,3078217[P].1963.
[6]Riscaldati E,Moresi M,Petruccioli M,et al.Effect of pH and stirring rate on itaconate production by Aspergillus terreus[J]. Journal of Biotechnology,2000,83(3)∶219-230.
(责任编辑:朱小惠)
A mutant strain with high L-tryptophan productivity obtained by Atmospheric and Room Temperature Plasma
YANG Lipeng,LI Xiaogang,WEI Aiying,CHEN Jinlong, MA Fengyong,JIA Huiping,MENG Gang
(Ningxia EPPEN Biotech Co.,Ltd.,Yinchuan 750100,China)
In this study,a tryptophan high-yielding mutant TRP-YP-3-2 was obtained by Atmospheric and Room Temperature Plasma(ARTP)mutation technique.Strain TRP-YP-3-2 showed faster growth rate,greater glucose consumption rate and higher yield of tryptophan compared with the original strain(TRP-1201).The yield of L-tryptophan produced by TRP-YP-3-2 reached 61.4 g/L and the conversion rate of glucose reached 19.25%,which were increased by 15.41%and 22.77%respectively compared with the original strain.Study on the genetic stability of tryptophan production showed that TRP-YP-3-2 possessed a good genetic stability after 30 generations of culture.The tryptophan high-yielding mutant had great economic value,and the breeding method established in this study could provide reference for other industrial microbial mutation breeding.
Atmospheric and Room Temperature Plasma(ARTP);tryptophan;high throughput screening
TQ92
A
1674-2214(2015)01-0028-05
2014-10-14
杨立鹏(1984—),男,宁夏吴忠人,硕士,研究方向为微生物育种,E-mail:yanglipeng582@163.com.通信作者:孟刚,工程师,E-mail:pufeel@163.com.

