酪氨酸脱羧酶产生菌的筛选及脱羧条件研究
朱黎君,陈航娟,肖正群,李开波,程奇灵
(浙江普洛医药科技有限公司,浙江东阳 322100)
酪氨酸脱羧酶产生菌的筛选及脱羧条件研究
朱黎君,陈航娟,肖正群,李开波,程奇灵
(浙江普洛医药科技有限公司,浙江东阳 322100)
酪胺广泛应用于生化试剂、有机化工及医药中间体。从厂区周围土壤中筛选到一株能催化L-酪氨酸脱羧产酪胺的细菌ZQM4#,鉴定为普罗威登斯菌(Providencia Ewing)。通过碳氮源、装液量、pH值、培养温度等条件的单因素试验和正交试验,得到该菌株的摇瓶脱羧培养条件为:牛肉浸膏5 g/L,酵母浸粉5 g/L,葡萄糖5 g/L,甘油5 g/L,磷酸氢二钾2 g/L,硫酸锰0.01 g/L,维生素VB60.003 g/L,温度37°C,pH 5.5。最后进行底物投料量的条件优化后,得到如下结果:10 g/L起始底物浓度下,3 h能100%脱羧转化成酪胺,之后每3 h补加10 g/L底物,可连续补充4次,底物仍能100%脱羧转化成酪胺。
土壤分离;酪氨酸;脱羧;酪胺;普罗威登斯菌
酪胺又名对羟基苯乙胺(CAS号51-67-2,分子式C8H11NO),在自然界中存在于一些寄生树及腐败的动物组织中。酪胺在医疗上具有收缩子宫、收缩末梢神经及升高血压的生理作用,可用作治疗偏头痛和诊断嗜铬细胞瘤的药物;应用于生化试剂、有机化工及医药中间体,目前主要用于制备降血脂药物苯扎贝特。现有报导的技术基本为化学合成法,如苯乙腈法[1]、茴香醛法[2]、对羟基苯甲醛法[3]、苯酚法[4],这些方法普遍有步骤多、对环境污染大的缺点;同时还有酪氨酸热解脱羧法[5],该法最大优势是步骤少,但是反应温度高,对设备要求高;目前有专利指出140~170°C即可热解[6],对于工业化生产来说也有相当难度。本文采用微生物脱羧转化底物获得酪胺,在37°C下即可温和快速高效脱羧,其原材料酪氨酸为常见易得的廉价氨基酸,可以较低的成本生产;并在摇瓶上对脱羧条件进行优化,提高脱羧效率,为今后的研究提供一些依据。
1 材料与方法
1.1 材料
1.1.1 菌种
大肠杆菌基因工程菌J5T1#,为本实验室保藏菌种。
1.1.2 试剂
L-酪氨酸(质量分数99%,浙江威仕生物科技有限公司),其余化学试剂均为分析纯,生化试剂均为试剂级。
1.1.3 培养基
LB培养基[7]:蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠10 g/L,pH 7.0。
固体LB培养基:LB培养基中加入1.5%~2.0%的琼脂粉。
氨基酸脱羧酶试验培养基:蛋白胨5 g/L,酵母浸粉3 g/L,葡萄糖1 g/L,1.6%溴甲酚紫-乙醇溶液1 mL,水1 L,pH 6.8。然后加入5 g/L的L-酪氨酸。
1.6%溴甲酚紫-乙醇溶液:溴甲酚紫1.6 g,溶解于100 mL无水乙醇。
TB磷酸缓冲液:磷酸氢二钾164.3 g/L,磷酸二氢钾23.1 g/L。
以上培养基与缓冲液均经过高压蒸汽灭菌(121°C,30 min)。
1.1.4 土壤样品
参照已知的土样采集标准方法,采集厂区里面及周围的12个土样,时间为2013年3月17日至2013年6月6日。采样时先除去表层5 cm表土,取5~15 cm深的土壤,5点采集,每份样品重约500 g,同时记录地理位置、当时地质条件、气候等各种周边环境状况[8]。
1.2 方法
1.2.1 菌种选育筛子
氨基酸脱羧会产生CO2,得到碱性产物生物胺,使溴甲酚紫成紫色[9]。而L-酪氨酸微溶于水,在固体培养基中脱羧形成可溶于水的酪胺,会形成透明圈。根据透明圈的大小和紫色深浅,可判断菌株的脱羧产胺能力。
1.2.2 酪胺生产分析
实验室保藏的典型微生物菌种经斜面活化,制备成菌悬液,适当稀释后分别涂布在氨基酸脱羧酶试验培养基平板上,恒温培养。每个样品各做2个平行,每天定时观察菌落形态,测量透明圈直径,记录变色圈颜色深浅,分析判断脱羧能力。
1.2.3 土壤微生物的分离
每份土样均分成2份,置于40°C烘箱中烘2 h以减少菌体的存活量,然后10倍稀释法适当稀释后,分别涂布在氨基酸脱羧酶试验培养基平板上,恒温培养。每个样品各做2个平行,每天定时观察菌落形态,测量透明圈直径,记录变色圈颜色深浅,分析判断脱羧能力。
1.2.4 脱羧菌株的纯化
对上述挑出菌株进行斜面活化,制备成菌体悬液,适当稀释后,取适量分别涂布在氨基酸脱羧酶试验培养基平板上,37°C恒温培养后,挑选性能优良菌落传代培养。斜面保藏备用。
1.2.5 脱羧能力检测
选择透明圈大、变色圈紫色深的菌株,用LB培养基扩培后,离心收集菌体投入到新鲜LB培养基中,加入10 g/L的L-酪氨酸为底物,振荡培养转化一定时间后,检测酪胺含量,并计算转化率,确认脱羧能力最强的菌株。以无菌的含10 g/L底物的LB培养基为对照。
1.2.6 菌种鉴定
1)对菌种形态进行形态结构观察[10];2)提取该菌全基因组DNA,采用通用引物扩增16S rDNA[11],扩增产物由上海生工测序,将该序列在NCBI数据库上BLAST比对。
1.2.7 培养基优化
1)通过单因素试验分别确定最佳碳、氮源;选择最佳碳源时,以蛋白胨为固定氮源;选择最佳氮源时,以葡萄糖为固定碳源;2)选择碳、氮源为因素,多个浓度为水平,设计正交试验以确定合适碳氮比;3)500 mL摇瓶装液量试验。
上述试验摇床培养条件均为37°C、200 r/min。
1.2.8 脱羧条件优化
1)通过单因素试验选择适宜的有助于脱羧转化的无机盐类和生长因子,并设计正交试验确定最佳投料量;2)温度试验:设28°C、30°C、33°C、35°C、37°C、40°C 6个条件;3)pH值试验:设4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0等8个条件;4)底物投料量和投料模式试验。
1.2.9 酪胺液相检测
高效液相色谱仪采用Agilent Technologies 1200 series,色谱柱采用TSK 100-C18(4.6 nm× 250 nm)。HPLC测的条件是:流动相V(7.2 g/L庚烷磺酸钠)∶V(ACN)=75∶25;流速:0.9 mL/min;温度:30°C;检测波长:230 nm。
2 结果与分析
2.1 平板初筛
从土壤中筛选到46个菌株,其中38个菌株的菌落有透明圈,具有明显分解利用酪氨酸的作用,但仅有23个菌株的菌落观察到紫色,即有脱羧并生成胺的作用,最佳的菌株有2个,分别为ZGS6#和ZQM4#,见表1。试验分别观察了培养1 d、2 d、3 d、4 d的平板,发现能利用底物的菌落在第2天的时候有明显的透明斑和变色圈,第3天开始已经基本耗尽平板里的底物,而能将底物脱羧产胺的菌落还使整个平板为紫色,没有差异,所以采用第2天的数据。

表1 分离选择培养基平板上的培养结果
2.2 摇瓶复筛
将J5T1#、ZGS6#、ZQM4#三个菌株进行同步对比转化试验,结果如表2所示。
酪胺含量检测采用液相色谱法,色谱图如图1所示。
镜检可知ZGS6#为芽孢杆菌,脱羧能力虽强,但耗时太长,且培养过程中极易形成芽孢,不易调控,影响脱羧效果。大肠杆菌基因工程菌J5T1#也是耗时长,且无法完全转化。而ZQM4# 在24 h转化率已达100%,很可能在早前就已经完全转化,所以采用ZQM4#进行进一步试验。
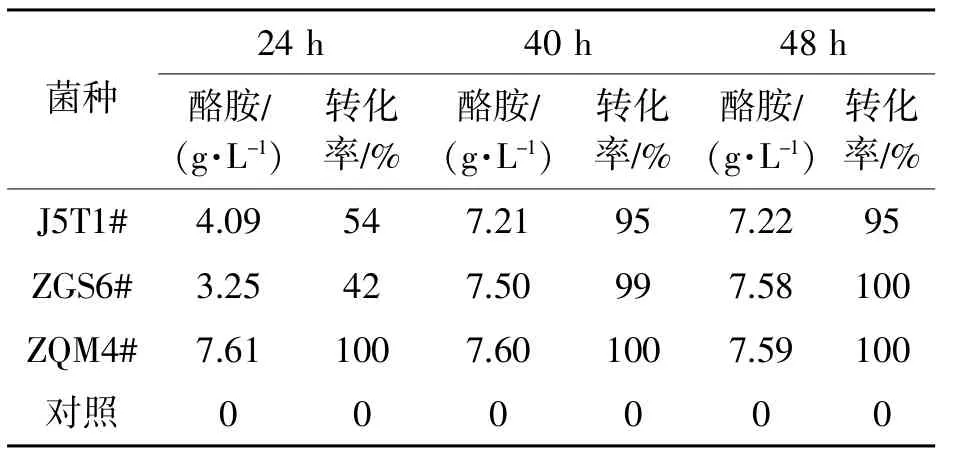
表2 底物浓度为10 g/L时脱羧转化结果
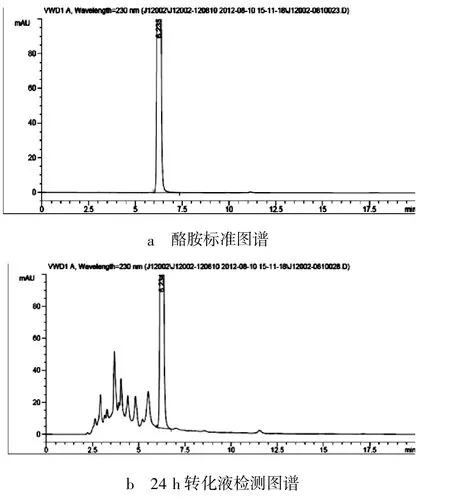
图1 酪胺液相检测图谱
根据L-酪氨酸难溶于水的性质,可以通过肉眼观察摇瓶中白色粉末或颗粒,来判定转化是否接近终点,然后在终点附近取样检测。从表3可知,ZQM4#在16 h时能完全转化底物。

表3 转化终点试验
2.3 菌种鉴定
涂布固体LB培养基平板后分离得到单个菌落,观察可见其呈类白色、直径1 mm以内圆形、微微隆起、透亮、边缘整齐、无集群。液体LB培养基培养,均匀混浊,革兰氏染色结果为阴性,镜检可见单个散落的小球杆菌,大小为0.5~0.8 μm,偶有对生或短链。
对该菌株DNA进行PCR扩增,以细菌16S rDNA通用引物,扩增得到947 bp的DNA片段见图2。将获得的序列在NCBI上进行blast序列比对,分析发现菌株ZQM4#与普罗威登斯菌(Providencia)同源性最高,达99%。

图2 16SrDNA核酸序列
2.4 培养基优化
不同碳、氮源对ZQM4#菌体生长的影响见图3。

图3 不同碳、氮源对菌体生长的影响
从图3可知,ZQM4#的最佳碳源为葡萄糖,其次是甘油;最佳氮源为酵母浸粉,其次是牛肉浸膏。后经过试验表明,ZQM4#菌体在葡萄糖、酵母浸粉组合的培养基中,不及在葡萄糖、甘油、酵母浸粉和牛肉浸膏四种物质组合的培养基中长势好,原因可能是牛肉浸膏中的某些微量元素和生长因子促进了菌体生长;而如果仅用葡萄糖作为单一碳源,会使培养体系的pH持续下降至5.0以下,从而抑制菌体生长,所以添加甘油为第二碳源。以碳、氮源的浓度4因素设3水平选择无交互作用的正交表L9(34),进行培养基优化试验[12],试验设计见表4。
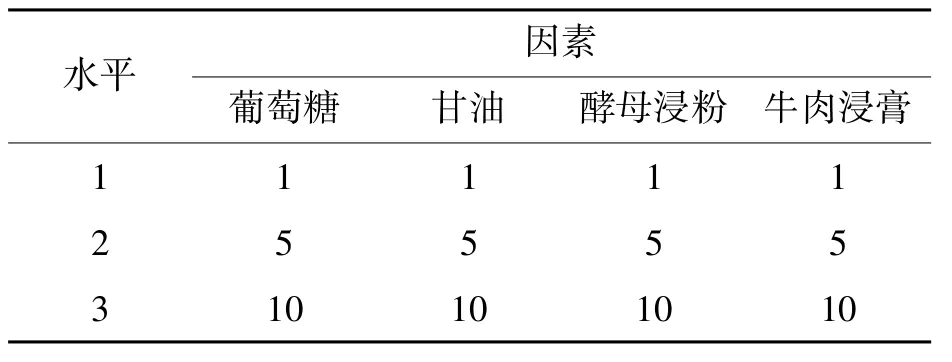
表4 碳、氮源4因素3水平试验(单位:g·L-1)
正交试验后,利用极差法分析数据,得到一个较优培养基:葡萄糖5 g/L,甘油5 g/L,牛肉浸膏5 g/L,酵母浸粉10 g/L。另外需加TB磷酸缓冲液100 mL/L维持体系pH值,因为从试验中得知,当pH值低于6.0时,菌体生长速度明显减缓,低于5.0时几乎停止生长。
对优化得到的培养基进行装液量试验,500 mL三角瓶设50 mL,75 mL,100 mL三个装液量,以100 mL的LB培养基作为对照,分别做生长曲线,见图4。从图中可知,最佳装液量为100 mL,OD600最高能达到9.0,比对照LB培养基高出一倍多。
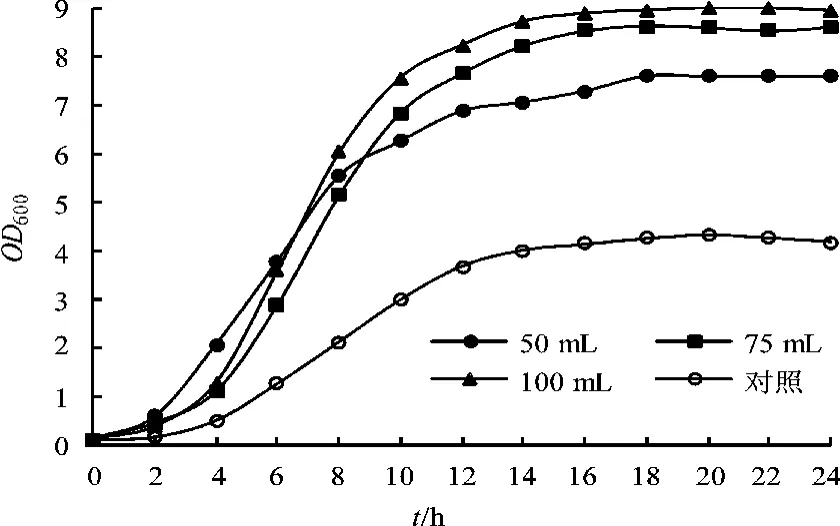
图4 生长曲线
2.5 脱羧条件优化
2.5.1 微量元素对脱羧反应的影响
通过试验可知,培养基中添加硫酸锰和维生素B6两种微量元素能加快脱羧转化的进行,见图5。原因可能是维生素B6在胞内转化成磷酸吡哆醛,而磷酸吡哆醛是酪氨酸脱羧酶不可或缺的辅酶;而锰离子虽不是酪氨酸脱羧酶的辅酶,却是作为磷酸转移酶的辅因子,促进维生素B6的利用[13]。
另外,通过单因素试验可知,添加硫酸锰所起的作用要比维生素B6更明显,可能是由于培养基中牛肉浸膏和酵母浸粉用量较大,原本就已有较多的维生素B6,添加的维生素B6只是补足缺少的量。

图5 两种培养基的转化速度对比图
通过正交试验后,利用极差法分析数据,确认各个因素的最佳组合条件,得到一个较优培养基。而种子培养基中使用的TB缓冲液在转化培养基中不适用,可能是由于离子强度不合适,且没有达到最适pH值。减少磷酸盐用量,且仅用磷酸氢二钾2 g/L,转化速率即加快。
2.5.2 温度、pH值的单因素试验
以上述最佳培养基做转化体系,添加浓度为10 g/L的底物,进行转化试验,结果表明最佳转化温度为37°C,温度过高与过低都会影响酶的活性;最佳转化pH值为5.5,pH低于5.0会导致菌体活性下降,从而影响脱羧效果,pH高于6.0虽有利于菌体生长,但酶活性低。这个结果与EYSIN品牌的酪氨酸脱羧酶成品的最佳使用条件相一致。在综合上述条件下,完全转化10 g/L底物最快仅需3 h。
2.5.3 最佳投料量和投料模式试验
通过实验可知,底物浓度越高,转化速率越低,转化率也越低,见表5。这可能是由于底物难溶于水,浓度过高时影响菌体与底物的均匀性,且会降低体系的溶氧量,导致菌体转化速度减缓。而随着时间延长,菌体的活性也会下降,从而导致最终转化率的降低。
遂采用分批补加的方式进行投料。经过试验,确定了最佳投料模式为:过夜培养的100 mL种子液,4500 r/min离心4 min,收集菌体投入到与种子液等体积的转化培养基中,加底物10 g/L,37°C继续培养3 h,再加底物10 g/L,如此每隔3 h投加一次底物。转化过程中,由于葡萄糖耗尽和氮源的利用,且碱性产物酪胺的生成,体系pH值会升高,所以第二次开始,每次投加底物前,均需用稀盐酸调节pH到5.5。

表5 底物转化浓度对比试验
3 结论
以L-酪氨酸为底物的氨基酸脱羧酶试验培养基为筛子,从土壤中筛选到一株高效的酪氨酸脱羧产酪胺菌株ZQM4#,对其进行了显微形态和16S rDNA序列分析鉴定,确定其为普罗威登斯菌。对该菌进行了脱羧产胺条件优化,优化后最佳种子培养基为葡萄糖5 g/L,甘油5 g/L,牛肉浸膏5 g/L,酵母浸粉10 g/L,TB缓冲液100 mL/L,自然pH值,培养温度37°C;最佳转化培养基为葡萄糖5 g/L,甘油5 g/L,牛肉浸膏5 g/L,酵母浸粉5 g/L,磷酸氢二钾2 g/L,硫酸锰0.01 g/L,维生素B60.003 g/L,pH 5.5,转化温度37°C。转化条件优化后,10 g/L起始底物浓度下,3 h能100%脱羧转化成酪胺,之后每3 h补加10 g/L底物,可连续补充4次,底物能100%脱羧转化成酪胺。结果说明,该菌具有十分优异的脱羧转化能力,很有希望能应用于工业化生产。
[1]Barger G,Walpole G S.Further syntheses of hydroxyphenylethylamine[J].Journal of the Chemical Society,1909,95(3)∶1712.
[2]Epstein J,Plapinye R E,Michel H O.Reaction of isopropylmethylphosphononofluoridate with substituted phenols[J].Journal of the American Chemical Society,1964,B6∶3075.
[3]曹正荣,郑正春.对羟基苯乙胺的合成研究和技术分析[J].化学世界,2000,41(1):51-52.
[4]陈蔚,潘毅,陶勇.酪胺的合成路线及新工艺[J].精细化工中间体,2009,39(4):20-21.
[5]胡益民,胡继萍.酪胺制备的改进方法[J].阜阳师范学院学报(自然科学版),1998,38(4):58-59.
[6]上海朴颐化学科技有限公司.一种制备酪胺的新方法:中国,ZL200910055103.7[P].2011-01-26.
[7]章小洪,汪琨,朱廷恒,等.解淀粉芽孢杆菌BW-13培养基和培养条件优化[J].浙江工业大学学报(自然科学版),2013,41 (1):35-39.
[8]王剑锋,刘建玲,王璋.从土壤中筛选产漆酶微生物菌株的研究[J].食品与发酵工业,2007,33(10):35-39.
[9]闫丽.氨基酸脱羧酶微量快速试验方法的研究[J].疾病监测与控制杂志,2010,4(1):31-32.
[10]江吉红,商弘颖,吴立飞,等.尼古丁降解菌的分离鉴定和初步特性研究[J].浙江工业大学学报(自然科学版),2013,39 (6):614-618.
[11]钟卫鸿,吴婉欣,陈雯雯,等.一株甲醛降解菌的分离鉴定及降解条件研究[J].浙江工业大学学报(自然科学版),2013,41 (1):25-30.
[12]李阳,刘峰,卢龙娣.磺胺胍抗性筛选法选育L-色氨酸高产菌株及其发酵条件的优化[J].福建师范大学学报(自然科学版),2009,25(3):84-88.
[13]沈同,王镜岩,赵邦悌,等.生物化学[M].北京:高等教育出版社,1981.
(责任编辑:朱小惠)
Screening for tyrosine decarboxylase producing strain and optimization of its decarboxylation conditions
ZHU Lijun,CHEN Hangjuan,XIAO Zhengqun,LI Kaibo,CHENG Qiling
(Zhejiang Apeloa Medical Technology Co.,Ltd.,Dongyang 322118,China)
Tyramine is widely used in biochemical reagent,organic chemical and pharmaceutical intermediates.A strain capable of catalyzing L-Tyrosine to produce tyramine was isolated and identified as Providencia Ewing.After single-factor and orthogonal tests,the optimal culture conditions were determined as follows∶beef extract 5 g/L,yeast extract 5 g/L,glucose 5 g/L,glycerine 5 g/L,K2HPO42 g/L,MnSO40.01 g/L,VB60.003 g/L,temperature 37°C and pH 5.5.After optimization of the transformation conditions,10 g/L of tyrosine was completely decarboxylation into tyramine in 3 h.The substrate was then supplemented every 3 h at a concentration of 10 g/L for 4 times,and it was found that the substrate could still be completely transformed into tyramine.
isolation from soil;tyrosine;decarboxylation;tyramine;Providencia Ewing
TQ92
A
1674-2214(2015)01-0038-06
2014-11-13
朱黎君(1981—),女,浙江永康人,主要从事工业微生物的菌种选育工作,E-mail:beforeus@163.com.

