下丘脑-小脑神经通路在大鼠躯体-内脏反应整合中的作用*
何叶成,李东印,张 轶
(苏州卫生职业技术学院基础医学教研室 215009)
机体能够自动协调躯体运动和内脏反应之间的关系,称为躯体-内脏反应整合。神经解剖学研究显示在下丘脑和小脑之间存在直接的神经环路[1-2]。下丘脑是机体内脏反应的高级中枢,小脑是皮层下最大的运动调节中枢,两者之间存在直接神经纤维联系,意味着在内脏高级调节中枢和皮层下最大运动调节中枢之间能够直接传递信号,提示下丘脑-小脑环路可能为躯体-内脏反应整合提供了结构基础,为合理解释躯体-内脏反应整合的机制提供了可能的方向。
下丘脑-小脑神经通路起源于下丘脑结节乳头核,发出的纤维直接投射到小脑皮层和深部核团,其神经递质为组胺[3]。神经解剖学研究揭示深部核团是小脑惟一的信号传出通路,并能够通过下行传出纤维影响脑干和脊髓的运动核团或神经元以调节躯体运动,小脑核团神经元组胺受体为H1和H2型。因此机体内脏功能状态,可能通过下丘脑-小脑组胺能投射纤维,影响小脑深部核团神经元的兴奋性,最终影响机体躯体运动能力。为了验证这一设想,本研究在大鼠小脑深部核团定点微量注射组胺类药物,观察大鼠小脑组胺能传入纤维信号传入被切断或强化后,大鼠躯体-内脏反应整合能力的变化,探索小脑组胺能传入纤维在躯体-内脏反应整合过程中发挥的作用,现报道如下。
1 材料与方法
1.1 动物和手术 采用240~260g清洁级雄性SD大鼠,腹腔注射戊巴比妥钠溶液麻醉,将其头部固定于立体定位仪上。根据鼠脑立体定位图谱,将两根不锈钢套管植入小脑,使其下端分别定位在双侧小脑顶核上方2mm的位置,用不锈钢螺丝和牙科水泥固定于颅骨,术后72h恢复期[4-5]。
给药时使用的微量注射器不锈钢针管比套管长2mm,使其下端正好位于顶核表面,不致损伤神经核团。双侧同时缓慢注射,60s内注射1μL药液。
1.2 行为学实验
1.2.1 开场实验 开场实验用来测试大鼠的运动及探索欲望的强弱。将大鼠轻轻地放入开场底部正中间,底部被划分成5×5个边长为10cm的方格,记录大鼠在5min内四肢经过的格子数和大鼠双脚直立的次数[4-5]。
1.2.2 rota-rod转棒仪实验 rota-rod转棒仪用来测试大鼠运动能力。将大鼠放置在旋转的横梁上,将转棒仪模式设置为转速在300s内从4r/min增加到40r/min的匀加速模式,记录大鼠在横梁上坚持的时间,如超过300s则记录为300s[4-5]。
1.2.3 实验设计 SD大鼠手术恢复后,进行3d加速rotarod转棒仪和开场实验训练,以达到稳定状态。选取120只运动能力正常的SD大鼠,随机分为对照组即A组(生理盐水),B组(组胺H1受体阻断剂triprolidine),C组(组胺H1受体激动剂2-PyEA),D组(组胺 H2受体阻断剂ranitidine),E组(组胺H2受体激动剂dimaprit)和F组(神经递质组胺histamine)。
整个行为学测试分禁食后、进食前、进食后3个阶段,依次命名为S0、S1、S2期,每期包括1次开场试验和rota-rod转棒仪测试。S0期的测试于禁食24h后上午8:00开始;测试完成后,休息1h,注射药物,然后进行S1期测试;测试完成后,休息1h,然后提供充裕的粮食和水;大鼠进食1h后进行S2期的测试,每期的测试控制在30min之内。
1.3 组织学鉴定 测试完成后,将动物小脑取出,作冰冻切片,判读插管创道的位置,如果插痕没有到达预期位置,测试结果将被排除在数据统计之外(图1)。

图1 组织学鉴定定点微量注射位点
1.4 统计学处理 应用SPSS13.0统计软件进行数据处理,计量资料以±s表示,两组间差异比较采用两独立样本t检验,多组间差异用单向方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 开场试验 开场试验结果见表1、2,A组大鼠摄食后与摄食前相比运动欲望和探索欲望明显降低。B、C组大鼠的行为学没有明显效应;D组则明显抑制大鼠运动欲望,且摄食后与摄食前的差距明显缩小;E、F组明显增强大鼠摄食前后的运动和探索欲望,摄食后与摄食前相比运动欲望和探索欲望差异不明显(图2)。从图3A中可以看出各组大鼠S0期运动欲望没有明显差异;S1期D组大鼠运动欲望明显降低,而E组和F组大鼠运动欲望明显增强;S2期(摄食后)各组运动欲望均有降低;D组、E组和F组大鼠降低不明显。从图2B中可以看出E组的比值为(74.560±6.791)%,B组、C组与A组相比无明显差异,而D组、E组和F组大鼠明显比A组高。图3C:各组大鼠S0期探索欲望没有明显差异;S1期D组大鼠探索欲望明显降低,而E组和F组大鼠探索欲望明显增强;S2期(摄食后)各组探索欲望均有降低;D组、E组和F组大鼠降低不明显。图3D,A组的比值为(75.180±5.688)%,B组、2-PyEA组与A组相比无明显差异,而D组、E组和F组大鼠明显比A组高。
表1 动物开场试验运动欲望数据(±s,n=20)
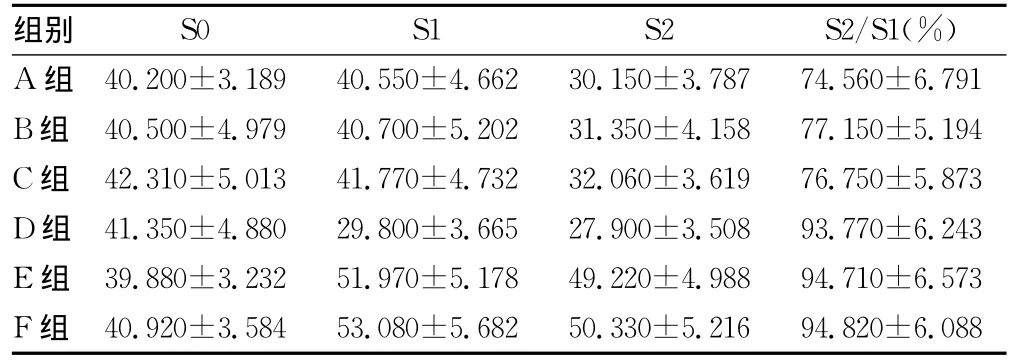
表1 动物开场试验运动欲望数据(±s,n=20)
组别 S0 S1 S2 S2/S1(%)560±6.791 B组 40.500±4.979 40.700±5.202 31.350±4.158 77.150±5.194 C组 42.310±5.013 41.770±4.732 32.060±3.619 76.750±5.873 D组 41.350±4.880 29.800±3.665 27.900±3.508 93.770±6.243 E组 39.880±3.232 51.970±5.178 49.220±4.988 94.710±6.573 F组 40.920±3.584 53.080±5.682 50.330±5.216 94.A组 40.200±3.189 40.550±4.662 30.150±3.787 74.820±6.088
2.2 rota-rod转棒仪测试 rota-rod转棒仪试验结果见表3、图3,各组大鼠S0期运动能力没有明显差异;S1期D组大鼠运动能力明显降低,而E组和F组大鼠运动能力明显增强;S2期(摄食后)各组运动能力均有降低;D组、E组和F组大鼠降低不明显。A组的比值为(80.900±5.100)%,B组、C组与A组相比无明显差异,而D组、E组和F组大鼠明显比A组高。

表2 动物开场试验探索欲望数据

图2 开场实验
表3 动物rota-rod转棒仪试验结果(±s,n=20)
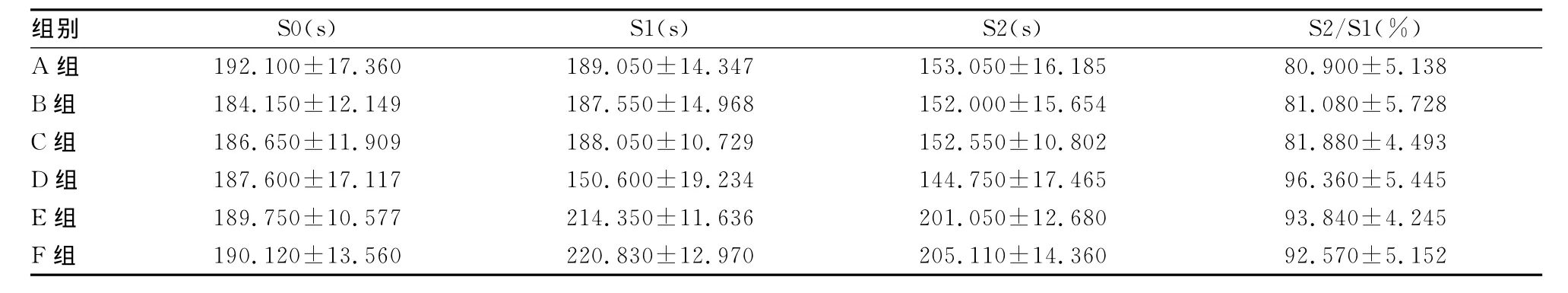
表3 动物rota-rod转棒仪试验结果(±s,n=20)
)()() /( )组别 S0(sS1sS2sS2S1%185 80.900±5.138 B组 184.150±12.149 187.550±14.968 152.000±15.654 81.080±5.728 C组 186.650±11.909 188.050±10.729 152.550±10.802 81.880±4.493 D组 187.600±17.117 150.600±19.234 144.750±17.465 96.360±5.445 E组 189.750±10.577 214.350±11.636 201.050±12.680 93.840±4.245 F组 190.120±13.560 220.830±12.970 205.110±14.A组 192.100±17.360 189.050±14.347 153.050±16.360 92.570±5.152

图3 rota-rod大鼠转棒仪实验
3 讨 论
近十年来神经解剖学研究发展飞速,其中一个重要进展就是揭示了下丘脑与小脑之间存在着直接的双向纤维联系,即下丘脑-小脑投射和小脑-下丘脑投射,二者构成了下丘脑-小脑神经环路。尽管目前对该神经环路确切的功能意义尚未完全揭示,但是内脏反应高级中枢与躯体运动中枢之间的直接纤维联系,为合理解释躯体-内脏反应整合机制提供了可能的方向。下丘脑-小脑神经纤维的胞体集中在下丘脑结节乳头核,该纤维的神经递质均为组胺。近年来研究发现组胺作为一种神经递质在脑内发挥了广泛作用,逐渐引起人们的重视,而组胺也被上升到“全脑功能的调节者”的高度[2,6-7]。到目前为止,已经发现的组胺受体有4种,分别为组胺H1、H2、H3、H4受体,均为促代谢型受体,在小脑深部核团只有H1和H2受体表达。
本实验先前的电生理研究显示,组胺能够剂量依赖地兴奋小脑深部核团神经元,且该兴奋能够被组胺H2受体阻断剂ranitidine而不是H1受体阻断剂triprolidine有效阻断[5]。进一步研究显示组胺能够通过H2受体使超极化激活的阳离子通道(Ih离子通道)激活,进而改变细胞膜电位,产生EPSP[8-9]。H2受体被激活后能够在较短时间内影响神经元电活动,H2受体有可能在躯体-内脏反应整合中发挥作用,因此本研究通过整体水平实验来验证这一设想。
在行为学实验中,A组与B~F组的大鼠进食前运动欲望和能力均没有差别,而A组S2期与S1期相比大鼠运动欲望和能力显著降低,提示内脏反应能够影响机体的躯体运动。B组与C组大鼠与A组相比没有差异,提示组胺并不通过H1受体途径影响机体躯体运动。D组大鼠小脑深部核团注射H2受体阻断剂后,运动欲望明显降低,提示内源性组胺能够增强机体运动欲望;而摄食前后运动欲望和能力变化不大,说明当小脑组胺能传入信号H2受体途径被切断以后,内脏反应对躯体运动的影响大大减弱。E组和F组大鼠,小脑深部核团H2受体被激活后,躯体运动能力明显增强,而摄食后内源性组胺释放减少,大鼠躯体运动能力略有减弱。以上结果说明,小脑组胺能传入纤维通过H2受体途径参与了机体躯体-内脏反应整合的调控。
神经解剖学研究表明,中枢组胺能纤维末梢并不与突触后神经元形成经典的化学突触,而表现为曲张体的形态[10],且组胺受体均为促代谢型。因此推测,小脑组胺能传入纤维并不承担传递特定信号指令的任务,只是根据机体内脏反应的状态调节运动中枢神经元膜电位水平,使之更易于或者不易于被兴奋。本实验中发现大鼠小脑核团注射ranitidine后,运动欲望和能力即明显下降,说明正常情况下丘脑释放一定量的组胺,使小脑核团神经元维持一定兴奋性;当机体内脏反应有变化,变化信号汇总到下丘脑后,下丘脑根据内脏运动状态,改变组胺能纤维递质释放的量,调节小脑等运动中枢神经元的兴奋性,进而改变机体躯体运动能力。在整体水平具体表现为,动物摄食后并不是表现为躯体运动消失,而是躯体运动欲望和能力下降。综合之前的研究资料以及本实验的研究结果,作者认为在实时运动中,下丘脑-小脑组胺能神经通路起到了协调机体的躯体-内脏反应整合的作用,以使机体能够更好地适应内外环境的变化。
[1]Haines DE,Dietrichs E,Mihailoff GA,et al.The cerebellar-hypothalamic axis:basic circuits and clinical observations[J].Int Rev Neurobiol,1997,41:83-107.
[2]Zhu JN,Yung WH,Kwok-Chong Chow B,et al.The cerebellar-hypothalamic circuits:potential pathways underlying cerebellar involvement in somatic-visceral integration[J].Brain Res Rev,2006,52(1):93-106.
[3]Panula P,Yang HY,Costa E.Histamine-containing neurons in the rat hypothalamus[J].Proc Natl Acad Sci U S A,1984,81(8):2572-2576.
[4]Song YN,Li HZ,Zhu JN,et al.Histamine improves rat rota-rod and balance beam performances through H2receptors in the cerebellar interpositus nucleus[J].Neuroscience,2006,140(1):33-43.
[5]He YC,Wu GY,Li D,et al.Histamine promotes rat motor performances by activation of H2receptors in the cerebellar fastigial nucleus[J].Behav Brain Res,2012,228(1):44-52.
[6]Brown RE,Stevens DR,Haas HL.The physiology of brain histamine[J].Prog Neurobiol,2001,63(6):637-672.
[7]Haas HL,Sergeeva OA,Selbach O.Histamine in the nervous system[J].Physiol Rev,2008,88:1183-1241.
[8]Haas H,Panula P.The role of histamine and the tuberomamillary nucleus in the nervous system[J].Nat Rev Neurosci,2003,4(2):121-130.
[9]Zhang J,Han XH,Li HZ,et al.Histamine excites rat lateral vestibular nuclear neurons through activation of postsynaptic H2receptors[J].Neurosci Lett,2008,448(1):15-19.
[10]Diewald L,Heimrich B,Büsselberg D,et al.Histaminergic system in co-cultures of hippocampus and posterior hypothalamus:a morphological and electrophysiological study in the rat[J].Eur J Neurosci,1997,9(11):2406-2413.

