持续禁食与恢复采食状态下食欲调控中枢不同核团兴奋性的比较
史萃菡,李绮琪,隋承融,束 刚,江青艳,朱灿俊
(华南农业大学 动物科学学院,广东 广州 510642)
【研究意义】采食是动物维持生命活动中营养摄取的首要过程。采食量决定营养摄入量,是保证动物遗传潜力和生产性能充分发挥的关键因素,也是提高生产效率和经济效益的重要前提[1]。当猪的能量摄入与自身维持需要比从2.3提高到2.6后,其耗料增重比可以降低17%[2]。哺乳母猪的采食量对仔猪断奶存活率、断奶窝重、断奶体重的影响呈正相关,且较高的采食量可以显著减少哺乳母猪体质量损失、缩短下次发情间隔时间[3]。影响畜禽采食的因素有很多,主要包括生理因素(如遗传、感官刺激[4])、环境因素(如温度、湿度、饲养密度)、日粮因素(如饲料适口性、能量水平)和病理因素(如胃肠道疾病、寄生虫)[5]。动物采食量受中枢多个核团组成的复杂“神经网络”调控。其中,循环系统的激素(瘦素、胰岛素等)和营养素(葡萄糖、脂肪酸等)等信号跨血脑屏障直接被下丘脑食欲调控中枢所感应,并通过复杂的神经投射系统传入高级中枢进行信息整合,最终通过神经-体液途径以调控机体的采食量。此外,肠道、感觉器官(视觉、听觉和嗅觉等)等信号还可通过外周神经传入脑干,经脑干初步整合后通过神经投射,一方面将信号传递至下丘脑等核团,引起能量稳态介导的采食调控,另一方面将信号传递至中脑腹侧被盖区(ventral tegmental area,VTA)等核团,引起非能量稳态(愉悦、偏好和奖赏等)介导的采食量调控[6]。因此,挖掘中枢潜在食欲调控核团,为提高畜禽采食量提供新的思路具有重要意义。【前人研究进展】能量的摄入量是由动物食欲决定的。饥饿禁食促使动物食欲增强,产生摄食行为,而持续的采食会引发饱感,进而停止摄食行为。饥饿、摄食和饱感间相互调节,最终决定食物摄入量。大脑作为食欲调控中枢,存在多个与摄食相关的核团,这些核团通过对食欲信号的感应、整合和传递,最终调控动物的采食量。下丘脑是调控代谢稳态与能量平衡的关键脑区,其中弓状核(arcuate hypothalamic nucleus,ARC)是下丘脑感受能量信号的重要核团之一,室旁核(paraventricular nucleus,PVN)、背内侧核(dorsomedial hypothalamic nucleus,DMH)、腹内侧核(ventromedial hypothalamic nucleus,VMH)和下丘脑旁侧核(lateral hypothalamic area,LHA)等不仅可直接感应多种能量调控信号,还可接收来自ARC的食欲信号投射。除下丘脑介导的能量稳态(homeostatic pathways)在食欲调控中发挥重要作用外,其他脑区也参与采食调控。研究表明:由纹状体(corpus striatum)、VTA、伏隔核(accumbens nucleus,Acb)等核团介导的非能量稳态(non-homeostatic pathways)在动物食欲调控中同样发挥重要作用[7-9](图1)。综上所述,动物的食欲调控是由中枢神经系统多个核团共同参与的复杂过程。神经元兴奋是其功能发挥的前提,FBJ小鼠骨肉瘤病毒癌基因同源物(cellular Finkel-Biskis-Jinkins murine osteosarcoma viral oncogene homolog,c-Fos),是一种典型的即刻早期应答基因(immediate early response genes,IEG)[10-11]。神经细胞受外界信号刺激,会快速诱导c-Fos基因表达。因此,目前普遍认为c-Fos 蛋白是神经元激活的标志蛋白。【本研究切入点】目前关于动物采食中枢的调控机制研究已有许多相关报道,激活下丘脑弓状核的刺鼠相关蛋白(agouti-related peptide,AgRP)神经元可显著提高动物的食欲和采食量;相反,激活弓状核的阿黑皮素原(pro-opiomelanocortin,POMC)神经元则会引起降低食欲、导致厌食[12];下丘脑室旁核(PVN)则主要参与饱腹感调节,从而阻止肥胖的发生等[13]。但是,上述研究主要集中在下丘脑等已知核团,大脑是否还存在更多与采食相关的核团,值得进一步探索。【拟解决的关键问题】本研究拟选用C57BL/6 雄性小鼠为模型,通过c-Fos 免疫荧光技术检测小鼠大脑中不同核团在持续禁食和恢复采食状态下的兴奋性变化,通过数据分析,筛选出参与食欲调控的潜在中枢核团。研究结果不仅可挖掘出调控动物食欲的新核团,丰富和完善动物采食中枢的调控机制,而且可望为研发高效、安全的新型诱食剂提供新的靶点,具有重要的科学意义和实践价值。

图1 稳态途径和非稳态途径调控采食的主要神经环路Fig.1 The main neural circuits of feeding controlled by homeostatic and non-homeostatic pathways ways
1 材料和方法
1.1 试剂与仪器
试验动物为:3周龄的雄性C57BL/6小鼠,购自广东省动物实验中心,许可证号:SCXK(粤)2018-0002,动物实验伦理批号:2021F072。试验小鼠可自由饮食饮水,光照时间12 h,温度(24±2)℃,湿度(55±10)%。
主要试剂:c-Fos 抗体(货号2250,美国Cell Signaling Technology 公司),山羊抗兔荧光二抗(红色cy3荧光,货号111-035-003,美国Jackson Immuno Research 公司)。仪器:共聚焦显微镜(Eclipse Ti-S 日本Nikon Instruments),平推切片机(HM 450,英国赛默飞公司)。
1.2 研究方法
1.2.1 动物造模 小鼠适应性喂养4周后,根据体质量将小鼠随机分为2组:持续禁食组和恢复采食组,每组4只。每次从2个组中选取体质量相近的2只小鼠进行造模。2只鼠同时持续禁食处理36 h,持续禁食组继续持续禁食2 h,恢复采食组则喂食2 h。先后使用生理盐水和4%多聚甲醛灌流小鼠,收取小鼠的脑组织固定在4%多聚甲醛中备用。以上配对试验重复4次。
1.2.2 c-Fos 免疫荧光染色 将小鼠脑组织在多聚甲醛中固定24 h,经30%的蔗糖溶液脱水24 h 后,放置平推切片机从前囟-8.24 mm 到前囟2.34 mm 连续切片,厚度为30 μm[14],放置于0.1%的叠氮化钠溶液中。脑片在0.1%的PBST 溶液中漂洗3 次(10 min/次)放入3%的羊血清溶液中室温封闭1 h。转移至含有c-Fos抗体(1∶2 000)的0.3% PBST溶液中,4 ℃孵育过夜。第2天用0.1%的PBST溶液中漂洗3次。在含有山羊抗兔荧光二抗(1∶400)的0.3% PBST 溶液中室温避光孵育2 h。之后用0.1% PBST 避光漂洗后裱片、风干、封片。
1.2.3 核团定位与图像采集 所有组织学图像均采用共聚焦显微镜获取图像。参照小鼠脑立体定位图谱[15],依据核团周围的脑室形状、穹窿位置、乳头丘脑束位置、核团本身的形状和神经元表达的轮廓确定各个核团的位置。尽量使两组同一核团的切片在同一切面,保证数据的可比性。每只小鼠单个核团选取3 张代表性脑片进行c-Fos 免疫荧光。使用Image J 软件对c-Fos 阳性神经元进行计数,取3 张脑片平均数为该小鼠单个核团表达c-Fos神经元数量。
1.3 统计学方法
使用GraphPad Prism 7.0 软件进行统计分析。计量资料以均数±标准误(xˉ±s)表示,数据的比较采用配对样本t检验。以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 持续禁食和恢复采食状态下c-Fos神经元在脑中的分布
试验过程如图2所示,结果发现c-Fos阳性神经元在小鼠全脑有广泛的分布。其中,在ARC,水管周灰质(periaqueductal gray,PAG),未定带(zona incerta,ZI),前背视前核(anterodorsal preoptic nucleus,ADP),DMH,背腱膜(dorsal tenia tecta,DTT)等前脑和中脑多个核团中分布密集。

图2 试验流程Fig.2 Experimental flow chart
2.2 持续禁食与恢复采食小鼠前脑中c-Fos的表达
前脑范围内,与持续禁食组相比,恢复采食组的ARC,ZI、ADP、前缘皮层(prelimbic cortex,PrL)、外侧隔核(lateral septal nucleus,LS)、外侧缰核(lateral habenular nucleus,LHb)、DMH、下丘脑后区(posterior hypothalamic area,PH)、侧视前区(lateral preoptic area,LPO)核团的c-Fos 阳性神经元数量明显减少(P<0.05);在PVN、SO、VMH 恢复采食组的c-Fos 阳性神经元数量多于持续禁食组(P<0.05);MeA、DTT、M2、MPO、LA核团中,恢复采食组的c-Fos阳性神经元数量相比持续禁食组有减少趋势,但是没有达到传统统计学的显著水平(0.05<P<0.1)。PV核团在恢复采食组的c-Fos神经元的表达数量增多趋势,但是没有达到传统统计学的显著水平(0.05<P<0.1)(图3,表1)。

图3 持续禁食与恢复采食对小鼠前脑区域核团变化的影响Fig.3 Effects of fasting and refeed on nuclear mass changes in forebrain regions of mice

表1 持续禁食与恢复采食对小鼠前脑核团c-Fos神经元数量变化的影响Tab.1 Effects of fasting and refeed on the number of c-Fos neurons in the forebrain nucleus of mice
2.3 持续禁食与恢复采食小鼠中脑和后脑内c-Fos的表达
在中脑范围内,持续禁食组的小鼠的PAG核团中的c-Fos阳性神经元数量显著多于恢复采食组(P<0.05)。在后脑范围内,在恢复采食组小鼠的Sol核团中的c-Fos神经元数量显著多于持续禁食组(P<0.05);AP核团c-Fos 表达在恢复采食组的数量比持续禁食组有增多趋势,MnR 核团的c-Fos 神经元数量在持续禁食组有增多趋势,但是两者都没有达到统计学显著水平(图4,表2)。

图4 持续禁食与恢复采食对小鼠中脑和后脑区域核团变化的影响Fig.4 Effects of fasting and refeed on nuclear mass changes in midbrain and hindbrain regions of mice
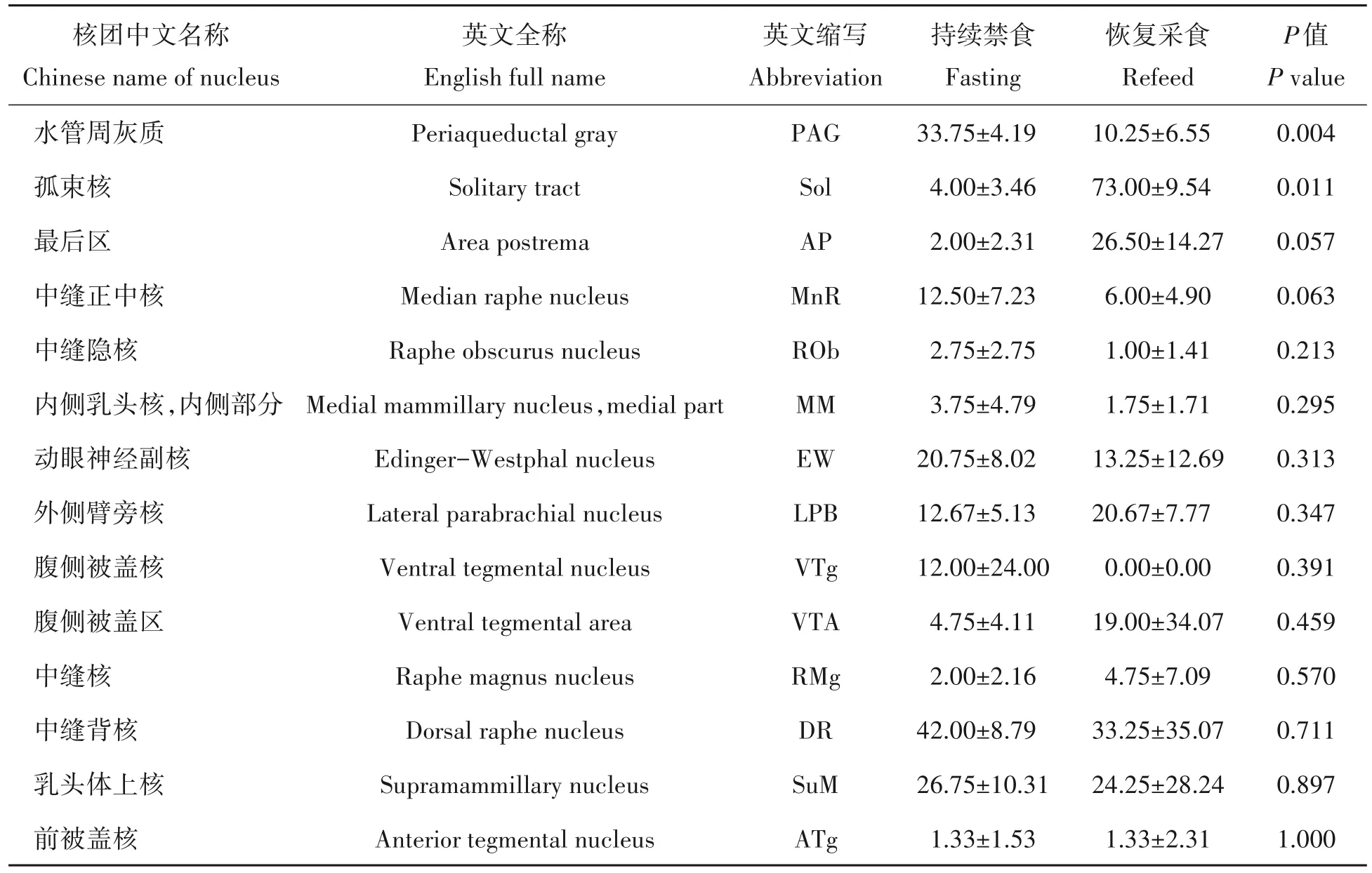
表2 持续禁食与恢复采食对小鼠中脑核团和后脑核团c-Fos神经元数量变化的影响Tab.2 Effects of fasting and refeed on the number of c-Fos neurons in midbrain nucleus and hindbrain nucleus of mice
3 结论与讨论
提高采食量是充分发挥畜禽生产潜力的最有效途径之一。动物的采食量受中枢复杂的神经网络调控。本研究为探究中枢食欲调控的潜在区域,以持续禁食/恢复采食小鼠为模型,通过c-Fos免疫荧光检测神经元兴奋性的变化。研究结果系统揭示了不同能量状态下中枢核团兴奋性的变化规律,为进一步阐明动物食欲的中枢整合机制提供理论基础。
研究发现,动物的食欲受多个因素影响,机体的能量水平、肠道饱感、环境因素、应激刺激等信号经中枢整合,最终引起动物采食量改变[16]。目前普遍认为下丘脑作为食欲调控中枢,在动物食欲调控中发挥关键作用。特别是下丘脑ARC 因其血脑屏障薄弱[17-18],富含大量促采食的AgRP 神经元,这些神经元作为“一级神经元”能够直接感应外周能量水平(营养物质、激素水平等)的改变[19]。饥饿禁食可显著提高ARC 中AgRP 神经元兴奋性并刺激神经末梢促食欲神经肽的释放,而下丘脑PVN、DMH 和VMH 作为AgRP 神经元下游投射靶点,AgRP 神经元释放的神经肽可有效抑制PVH 和VMH 神经元兴奋性,提高DMH 神经元兴奋性,增强动物食欲[20-22]。肠道作为动物食物储存和消化吸收的重要场所,存在大量的食欲调控信号,这些信号通过肠道迷走传入神经投射至脑干Sol和AP 区域[23],恢复采食后肠道各种机械或化学信号经迷走神经显著激活Sol和AP神经元,引起动物饱感[24]。
前脑边缘皮层(PrL)位于内侧前额叶皮层(medial prefrontal cortex,mPFC),对应激有抑制作用[25]。光遗传激活PrL 神经元可抑制动物应激行为[26],糖皮质激素可负反馈调控来减弱或终止应激反应[25]。隔核是连接高级认知中枢和低级执行系统的中间环路。外侧隔核(LS)是隔核的重要组成部分。有研究表明,来自ARC 的胃饥饿素神经元可投射至LS 核团[27],并且通过促食欲的胃饥饿素提高LS 神经元兴奋。而光遗传抑制LS 到下丘脑LH 的投射环路会抑制采食[28],结合本研究发现饥饿可显著提高LS 神经元兴奋性,提示LS 可能在提高动物食欲方面发挥重要作用。本研究发现饥饿禁食状态下PrL 和LS 核团神经元同样被激活,提示PrL和LS核团除参与缓解动物应激外还可能调控动物食欲。相反,PVH作为应激调控中枢,急性应激可显著激活PVH,但饥饿则有效抑制其兴奋性,说明应激与动物食欲间存在密切联系,饥饿禁食状态下动物应激反应明显减弱。
背腱膜(DTT)被认为是治疗身心障碍的潜在靶点[29],在采食方面的作用尚不明确。从结果可以看出,DTT在持续禁食的状态下,表达的c-Fos神经元数量比恢复采食的神经元数量多,提示DTT可能是调控食欲的潜在核团。
外侧缰核(LHb)被认为参与动物众恐惧、紧张、焦虑等众多负面情绪调控,进而抑制动物愉悦采食[30]。外侧视前区(LPO)作为下丘脑的一部分,大鼠体内注射芬弗拉明(5-羟色胺类药物),LPO 的中NPY 表达量和采食量均显著降低[31]。本研究则发现在饥饿禁食状态下小鼠LHb 和LPO 兴奋性均显著提高,提示LHb 和LPO 不仅介导食欲的非能量稳态调控,而且参与动物食欲的能量稳态调控[32]。进一步揭示食欲的能量稳态和非能量稳态调控并不是完全独立的,存在相互调控的关系。
丘脑室旁核(PV)能够调控进食行为。PV 损伤会导致采食量和体质量的增加[33]。药物激活PV 中胰高血糖素样肽-1 受体(glucagon-like peptide-1 recepter,GLP1R)减少动物采食行为[34]。光遗传激活ZI 投射到PV 的γ-氨基丁酸(γ-aminobutyric,GABA)能神经元可以增加采食量[35]。这些研究结果表明PV 神经元参与饱感信号调控[36]。本研究也同样发现,在饱食状态下,PV核团神经元兴奋性升高。
内侧杏仁核(MeA)是杏仁核皮质内侧群的一部分。一般认为内侧杏仁核参与应激相关的调控[37],进而影响采食和体质量。猫、狗和猴的MeA 损伤会破坏正常进食,引起暴饮暴食及体质量增加[38]。光遗传特异性激活投射到MeA 中弓状核来源的POMC 神经元会减少短期内的采食量[39]。但是也有研究说明MeA损坏后采食量会降低[40],而且使体质量减少[41]。笔者推测MeA核团中有不同功能的调控采食的神经元,该核团对于采食的调控还需进一步探索。本研究发现饥饿禁食状态下的MeA 的兴奋性有增强的趋势,提示MeA的神经元可能是以促采食神经元为主。
中脑水管周灰质(PAG)与动物猎食行为相关[42-44],因此饥饿可诱导PAG 神经元兴奋,进而刺激动物产生摄食行为。位于丘脑下核团未定带(ZI)主要由抑制性γ-氨基丁酸(GABA)能神经元构成。研究发现,ZI 通过GABA 神经元投射抑制PAG 活性,进而削弱动物捕食行为[45],光遗传等激活ZI 神经元则显著降低动物采食[46]。而本研究发现饥饿禁食可显著激活ZI 神经元活性,而出现这种现象的原因是ZI 核团参与广泛的生理调控过程,比如参与调控内脏活动、意识、注意力和运动等,因此在饥饿禁食状态下出现ZI核团活性升高现象。
综上所述,本研究通过系统对比持续禁食与恢复采食情况下小鼠中枢不同核团兴奋性变化,发现除经典的食欲调控关键核团神经元兴奋性发生显著变化外,还存在多个核团有明显的c-Fos表达差异包括分泌催产素和抗利尿激素的视上核(SO )[47],与抗应激相关的前缘皮层核(PrL),以及可以抑制棕色脂肪产生的下丘脑后区核团(PH)[48]等。本研究发现SO、PrL和PH 等核团可能在食欲调节中同样发挥重要作用,该研究结果进一步丰富和完善了动物采食中枢的调控机制,也为研发高效、安全的新型诱食剂提供新的靶点。

