CD40 siRNA 对MRL/Lpr 小鼠狼疮肾炎的治疗作用①
庞春艳 吕凤凤 尹芳蕊 王永福
(内蒙古科技大学包头医学院风湿免疫研究所包医一附院风湿免疫科,内蒙古自治区自体免疫学重点实验室,包头014010)
系统性红斑狼疮(Systemic Lupus Erythematosus,SLE)是一种可累积多系统、多器官的自身免疫性疾病,以肾脏受累多见,SLE 患者出现肾脏损害称为狼疮肾炎(Lupus Nephritis,LN),对LN 的治疗,若临床症状轻微,肾小球结构正常或轻微病变,可用抗疟药阿司匹林或NSAID 等治疗,同时加用小剂量激素口服;若肾小球病变严重时,可采用激素加细胞毒药物治疗。SLE 患者合并LN 时预后较差,LN 的主要死因是肾功能衰竭和合并感染。如果及时地控制LN 的发展可延长SLE 患者的5 年存活率。
小干扰RNA(small interfering RNA,siRNA)是一种特定基因沉默技术,广泛用于肿瘤、自身免疫性疾病和肝炎等疾病的治疗[1-3],而且小鼠体内研究发现,口服siRNA 制剂对小鼠不会造成任何的不良反应[4]。因此,本研究采用siRNA 技术沉默MRL/Lpr 小鼠中CD40 基因的表达,探讨CD40 基因的siRNA 对MRL/Lpr 小鼠的治疗作用。
1 材料与方法
1.1 主要试剂及仪器 载体pGFP-V-RS 购自美国Origene 公司,AxyPrep 质粒DNA 大量抽提试剂盒购自美国Axygen 公司,TRIzol 购自日本Takara 公司,M-MLV 逆转录酶和脂质体lipofectamineTM2000 购自美国Invitrogen 公司。
1.2 siRNA 的设计和CD40-siRNA 是否在小鼠肾脏中表达 针对CD40 基因的cDNA 序列设计2 段siRNA。第1 段序列为:CTTGGAGGTCCTACAGAAA,第2段序列为:GTGTTATCCCTGGACAAGC。将上述序列的模板插入质粒载体pGFP-V-RS 中,构建其真核表达载体。将构建好的60 μg CD40 siRNA1 和脂质体lipofectamineTM2000 的混合物200 μl[DNA(μg):lipofectamineTM2000 (μl)为1∶2]分别自尾静脉注射MRL/Lpr 小鼠,对照组小鼠注射等剂量、等比例的磷酸盐缓冲液(PBS)和lipofectamineTM2000 的混合物,6 h 后处死小鼠取肾脏,快速冰冻切片,荧光显微镜下观察是否有绿色荧光。
1.3 实验动物分组及给药 12 周龄MRL/Lpr 雌性小鼠16 只,体质量18~23 g,购南京大学动物模式研究所。按照简单随机化分组方法将小鼠分为对照组、空载体组、CD40 siRNA1 组和CD40 siRNA2 组4组,每组4 只。注射方法同上,空载体组小鼠注射载体pGFP-V-RS 与lipofectamineTM2000 的混合物。每隔1 天1 次,共6 次。
1.4 各项指标的检测 注射后14 d 处死所有组MRL/Lpr 小鼠,心脏取血,分离血清。-80℃保存。取小鼠肾脏,分成两份,其中一份TRIzol 提RNA,实时荧光定量PCR 检测小鼠肾脏中CD40 mRNA 的表达水平,根据ct 值计算2-ΔΔct。引物由上海生工生物工程技术服务有限公司合成,CD40 上游引物:5'-GAGAAGACCCAATGCCACC-3',下游引物:5'-GCACATGCCTCGCAATCC-3',内参β-actin 上游引物:5'-CTGTCCCTGTATGCCTCTG-3',下游引物:5'-ATGTCACGCACGATTTCC-3'。另一份肾脏,4% 甲醛固定,石蜡包埋,切2 张片,分别作HE 染色和荧光免疫组织化学染色,荧光免疫组织化学染色的图片采用IPP6 软件分析平均A 值。
1.5 统计学分析 采用SPSS17.0 统计软件进行数据分析,以±s 表示,组间的比较采用单因素方差分析。
2 结果
2.1 CD40 siRNA 真核表达载体在肾脏中的表达
由于本实验用到的质粒载体pGFP-V-RS 含有绿色荧光蛋白,因此荧光显微镜下观察冰冻切片,结果发现:对照组小鼠肾脏中看不到绿色荧光,而CD40-siRNA1 组可看到明显的绿色荧光,即CD40 siRNA真核表达载体可以在MRL/Lpr 小鼠肾脏中表达,见图1。
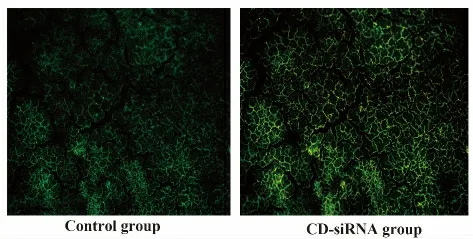
图1 CD40 siRNA 真核表达载体在小鼠肾脏中的表达Fig.1 Expression of CD40 siRNA in kidney from MRL/Lpr mice
2.2 4 组小鼠CD40 siRNA 注射后CD40 mRNA的表达水平 注射后14 d 处死小鼠,CD40-siRNA1 组和CD40-siRNA2 组小鼠肾脏中CD40 mRNA 的表达明显低于对照组和空载体组,差异有统计学意义(P<0.05),对照组和空载体组比较差异无统计学意义(P >0.05),CD40-siRNA1 组和CD40-siRNA2 组比较差异有统计学意义(P<0.05)。见表1。
2.3 4 组小鼠CD40 siRNA 注射后CD40 蛋白的表达水平 注射后14 d 处死小鼠,检测4 组小鼠肾脏中CD40 蛋白的表达,结果显示:对照组和空载体组有很强的红色荧光,而CD40-siRNA1 组和CD40-siRNA2 组的红色荧光量明显减弱,即CD40-siRNA1组和CD40-siRNA2 组CD40 的表达明显低于对照组和空载体组,对照组和空载体组比较差异不明显,siRNA1 组和siRNA2 组比较也无明显差异。见图2(附:上述应用的为荧光免疫组化,无需染色,放大倍数为10 倍)。
2.4 4 组小鼠的病理改变 光镜下观察肾脏的病理切片,结果发现:对照组的肾小球炎性细胞浸润,肿大,肾小管肿胀,可见管型,空载体组与对照组的病理类型一致,而CD40-siRNA1 组和CD40-siRNA2组中的小鼠肾脏病理显示:肾小球和肾小球浸润的炎性细胞减少,肾小管肿胀程度减轻,见图3。
表1 4 组小鼠肾脏中CD40 mRNA 表达水平(±s)Tab.1 Expression levels of CD40 mRNA in kidney from MRL/Lpr mice(±s)

表1 4 组小鼠肾脏中CD40 mRNA 表达水平(±s)Tab.1 Expression levels of CD40 mRNA in kidney from MRL/Lpr mice(±s)
Note:Compared with control group and empty vector group,1)P<0.05.

图2 4 组小鼠肾脏中CD40 蛋白的表达水平Fig.2 Expression levels of CD40 protein in kidney from MRL/Lpr mice
2.5 4 组小鼠CD40 siRNA 注射后24 h 尿蛋白的变化 24 h 尿蛋白检测结果显示:CD40-siRNA1 组和CD40-siRNA2 组中的小鼠24 h 尿蛋白的 浓 度 分 别 为(202.50 ± 26.30)mg/dl 和(201.25 ±28.39)mg/dl 显著低于对照组和空载体组狼疮鼠的浓度,差异有统计学意义(P<0.05),见表2。
2.6 4 组小鼠CD40 siRNA 注射后补体C3 的表达水平 注射后14 d 处死小鼠,CD-40 siRNA1组和CD-40 siRNA2 组小鼠血清中补体C3 的表达明显高于对照组和空载体组,差异有统计学意义(P<0.05),对照组和空载体组比较差异无统计学意义(P >0.05),CD-40 siRNA1 组和CD-40 siRNA2 组比较差异无统计学意义(P >0.05)。见图4。
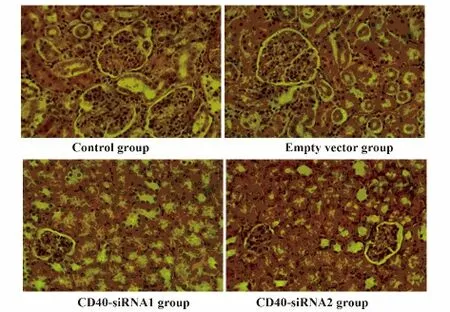
图3 4 组小鼠肾组织病理学改变(HE,×200)Fig.3 Changes of renal histopathology in MRL/Lpr mouse (HE,×200)
表2 4 组小鼠24 h 尿蛋白的浓度(±s,mg/dl)Tab.2 Urinary Protein content of MRL/Lpr mice in 4 groups(±s,mg/dl)

表2 4 组小鼠24 h 尿蛋白的浓度(±s,mg/dl)Tab.2 Urinary Protein content of MRL/Lpr mice in 4 groups(±s,mg/dl)
Note:Compared with control group and empty vector group,1)P<0.05.
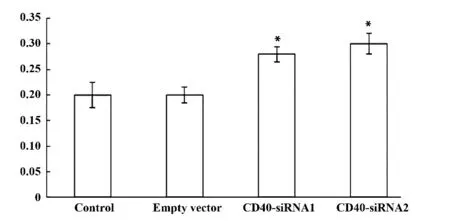
图4 4 组小鼠补体C3 的表达水平Fig.4 Expression level of complement C3 in serum of MRL/Lpr
3 讨论
LN 是SLE 累及肾脏所引起的一种免疫复合物性肾炎,除SLE 全身表现外,临床主要表现为不同程度的蛋白尿、血尿、肾功能不全等,可表现为不同的病理学分类。人类白细胞分化抗原CD40 是与T细胞和B 细胞功能有关的一种表面抗原。CD40 与其配体CD40L 形成信号通路在自身免疫炎症中起重要作用[5,6]。同时,CD40 还可激活SLE 患者B 细胞,使其增殖和分化能力增强,免疫球蛋白(IgS)分泌增多[7]。
本研究将2 段CD40 的siRNA 真核表达载体尾静脉注射MRL/Lpr 小鼠,6 h 后处死小鼠取肾脏制作冰冻切片,荧光显微镜下观察发现MRL/Lpr 小鼠肾脏可见绿色荧光,说明CD40 siRNA 真核表达载体可在小鼠肾脏中表达。CD40 的mRNA 和蛋白水平的检测结果发现:CD40 的特异性siRNA 可抑制MRL/Lpr小鼠肾脏中CD40 在mRNA 和蛋白水平的表达。
LN 肾脏病理可见肾小球有大量中性粒细胞浸润、肿胀,肾小管出现空泡样改变和管型,是SLE 主要的合并症和死亡原因。MRL/Lpr 小鼠会出现轻中度蛋白尿和进行性肾损害,病理表现为炎细胞浸润、血管炎以及间质小管病变,肾小球系膜和血管环中可见呈轻微颗粒型IgG 免疫复合物和补体C3,与人类LN 相似[8]。本研究狼疮鼠肾脏病理切片显示,模型组的肾小球肿胀,且有大量淋巴细胞浸润,肾小管出现空泡样改变,符合LN 肾脏的病理改变。MRL/Lpr 小鼠尾静脉注射CD40 的特异性siRNA 后可发现肾小球肿胀减轻,淋巴细胞浸润减少,肾小管空泡样改变减轻,而注射空载体的狼疮鼠肾脏却没有这样的改变,空载体组肾脏的病理改变和模型组基本一致,没有明显变化。这说明CD40 的siRNA可逆转LN 的肾脏病理改变。
SLE 患者合并LN 时会出现不同程度的蛋白尿,如及时合理地进行治疗蛋白尿的程度可以逐渐减轻。Luo 等[9]将B 淋巴细胞诱导成熟蛋白1(B lymphocyte-induced maturation protein-1,Blimp-1)的siRNA 载体注射MRL/Lpr 小鼠,结果发现,Blimp-1的siRNA 可减轻抗dsDNA 抗体的滴度,减少24 h尿蛋白的含量,减弱SLE 的相关症状等。本研究在CD40 siRNA 注射MRL/Lpr 小鼠尾静脉后,结果显示:24 h 尿蛋白的含量较模型组和空载体组明显减少,差异有统计学意义。这提示CD40 的siRNA 可减少MRL/Lpr 小鼠的24 h 尿蛋白的含量。
SLE 患者由于形成大量循环免疫复合物,补体被大量消耗,其下降程度与病情活动程度呈平行关系,患者表现为低补体血症。免疫复合物沉积肾小球可引起狼疮肾炎,临床上通常将补体C3 作为判断狼疮肾炎活动度的指标[10,11]。本研究结果显示:CD40 的siRNA 可以升高MRL/Lpr 小鼠血清中补体C3 水平。提示CD40 的siRNA 在一定程度上可以减轻狼疮小鼠体内的免疫反应,减轻LN 的活动度。
总之,CD40 的siRNA 真核表达载体尾静脉注射MRL/Lpr 小鼠后,CD40 siRNA 可以在其肾脏中表达,可减少CD40 mRNA 和蛋白的表达水平,同时减少24 h 尿蛋白的含量,逆转肾脏的病理改变,进一步还可升高MRL/Lpr 小鼠体内的补体C3 水平,缓解LN 的活动度,因此,CD40 siRNA 对LN 有治疗作用。
[1]Gillespie DL,Aguirre MT,Ravichandran S,et al.RNA interference targeting hypoxia-inducible factor 1α via a novel multifunctional surfactant attenuates glioma growth in an intracranial mouse model[J].J Neurosurg,2015,1222(2):331-341.
[2]Guo B,Zhang B,Zheng L,et al.Therapeutic RNA interference targeting CKIP-1 with a cross-species sequence to stimulate bone formation[J].Bone,2014,59:76-88.
[3]Thongthae N,Payungporn S,Poovorawan Y,et al.A rational study for identification of highly effective siRNAs against hepatitis B virus[J].Exp Mol Pathol,2014,97(1):120-127.
[4]Petrick JS,Moore WM,Heydens WF,et al.A 28-day oral toxicity evaluation of small interfering RNAs and a long double-stranded RNA targeting vacuolar ATPase in mice[J].Regul Toxicol Pharmacol,2014,71(1):8-23.
[5]Peters AL,Stunz LL,Bishop GA.CD40 and autoimmunity:the dark side of a great activator[J].Semin Immunol,2009,21:293-300.
[6]Pyrovolaki K1,Mavroudi I,Sidiropoulos P,et al.Increased expression of CD40 on bone marrow CD34+hematopoietic progenitor cells in patients with systemic lupus erythematosus:contribution to Fas-mediated apoptosis[J].Arthritis Rheum,2009,60 (5):543-552.
[7]Néron S,Boire G,Dussault N,et al.CD40-activated B cells from patients with systemic lupus erythematosus can be modulated by therapeutic immunoglobulins in vitro[J].Arch Immunol Ther Exp(Warsz).2009,57(6):447-458.
[8]丁朝霞,杨少锋,吴启富,等.白芍总苷对MRL/lpr 小鼠狼疮性肾炎的影响[J].南方医科大学学报,2011,31(4):656-660.
[9]Luo J,Niu X,Zhang M,et al.Inhibition of B lymphocyte-induced maturation protein-1 reduces the production of autoantibody and alleviates symptoms of systemic lupus erythematosus[J].Autoimmunity,2015,48(2):80-86.
[10]Julkunen H1,Ekblom-Kullberg S,et al.Nonrenal and renal activity of systemic lupus erythematosus:a comparison of two anti-C1q and five anti-dsDNA assays and complement C3 and C4[J].Rheumatol Int..2012,32(8):2445-2451.
[11]Li W,Li H,Song W,Hu Y,et al.Differential diagnosis of systemic lupus erythematosus and rheumatoid arthritis with complements C3 and C4 and C-reactive protein[J].Exp Ther Med,2013,6(5):1271-1276.