鼠伤寒沙门菌SL1344 株sipB 和crp 基因缺失对其侵袭力影响的比较①
陈松彪 张春杰 程相朝 李银聚 李 静 何 雷 郁 川 张明亮 余祖华 贾艳艳 赵战勤
(河南省动物疫病与公共安全院士工作站/河南科技大学动物疫病与公共卫生重点实验室,洛阳 471003)
鼠伤寒沙门菌(Salmonella typhimurium)是一群非适应性或泛嗜性的沙门菌,具有广泛的宿主,是目前世界各国分离率最高的菌型之一。该菌能引起各种哺乳动物以及人类发生全身性感染,具有重要的公共卫生意义[1]。
沙门菌的致病机制主要与Ⅲ型分泌系统(T3SS)有关,由SPI-1 和SPI-2 两个毒力岛编码,毒力岛(Pathogenicity island)是存在于病原菌染色体上的特定区域,编码与毒力相关的基因,负责细菌效应蛋白的分泌和转运,通过改变宿主细胞的生理机能来促进细菌的侵入与存活。因此,T3SS 所分泌的蛋白在利用宿主细胞促进细菌侵入,诱导炎症反应,以及创造胞内生小境来促进细菌在细胞内的存活和复制等方面发挥着重要作用[2]。
沙门菌入侵蛋白是侵入过程的起始中心,sipB是编码沙门菌转运蛋白的其中一个基因,已有研究表明SipB 可以调节Ⅲ型分泌系统(TTSS)调节蛋白的传递[3]。越来越多的证据表明位于毒力岛1(SPI-1)上的SipB 效应蛋白主要通过天冬氨酸特异性蛋白酶1(caspase-1)激活IL-1b 和IL-18 促进宿主细胞的坏死和凋亡[4,5]。最近的研究发现SipB 蛋白能够插入到宿主的细胞膜中形成一个离子通道,从而能够改变效应蛋白在宿主细胞中的位置[6],SipB 蛋白在维持细菌细胞膜完整性和耐高渗性方面扮演着重要的角色[7]。而crp 基因编码腺苷酸环化酶受体蛋白,其突变株能在普通培养基上生长,消除了细菌在哺乳动物中摄取cAMP 的唯一途径,其作为沙门菌重要的毒力基因,国内外学者一直在不断地研究[8,9]。在前期研究中我们发现crp 和sipB缺失株均能够显著降低对哺乳动物的毒力[10,11],但是这种毒力的降低是由什么机制引起的目前尚少见有关报道,因此本实验在实验室前期研究的基础上对crp 和sipB 缺失株的其他生物学特性进一步的研究,以小鼠和细胞建立感染模型,分别对两种缺失株进行体内和体外的侵袭力试验,为crp 和sipB 缺失株的减毒机制研究奠定了实验基础。
1 材料与方法
1.1 菌株、细胞和培养条件 鼠伤寒沙门菌SL1344 强毒株由南京农业大学惠赠;SL1344Δ sipB、SL1344Δ crp、HeLa 细胞由河南科技大学动物疫病与公共卫生实验室构建并保存;鼠伤寒沙门菌在37℃静止或振摇培养;细胞在37℃和5%CO2恒温培养箱中静置培养。
1.2 主要试剂、培养基和实验动物 生化鉴定试剂由杭州天和微生物试剂有限公司生产;沙门菌属诊断血清(11 种)及各种单因子血清由宁波天润生物药业有限公司生产;DMEM 培养基、胰蛋白酶购自Sigma 公司;Triton X-100 购自Sangon 公司。麦康凯琼脂和SS 琼脂培养基购自广东环凯微生物科技有限公司;胰蛋白胨、酵母浸出物等由英国OXOID 公司生产;6 周龄的BALB/c 小鼠购自郑州大学实验动物中心[SCXK(豫)2010-0002]。
1.3 Δcrp 和ΔsipB 缺失株的表型鉴定 将缺失株利用玻片凝集试验进行血清型鉴定,同时将两株缺失株与SL1344 分别接种于含1%麦芽糖的麦康凯固体培养基上,研究菌落生长状况;然后挑单菌落转接含葡萄糖、蔗糖、鼠李糖、甘露醇、麦芽糖糖等生化鉴定管,研究其生化特性。
1.4 Δcrp 和ΔsipB 缺失株的生长特性鉴定 将两株缺失株与亲本株SL1344 在LB 中37℃培养过夜,无菌生理盐水连续10 倍稀释,取100 μl 适当稀释度菌液均匀涂布于LB 固体平板上,每个稀释度做3个重复,37℃培养过夜,计数,取平均值计算原液的CFU。然后以终浓度约为106CFU/ml 转接于相同液体培养基,37℃、200 r/min 培养,每1 h 取样并进行涂板计数,绘制生长曲线。
1.5 Δcrp 和ΔsipB 缺失株感染小鼠后在体内动态分布 6 周龄BALB/c 小鼠(16 只/每组)口服crp、sipB 缺失株1 ×107CFU,每周每组解剖4 只,共3组,并且取其肝、脾研磨进行稀释计数,连续测定4周,并设亲本菌株对照组。
1.6 Δcrp 和ΔsipB 缺失株感染上皮细胞黏附试验感染前16 h 将细胞按照按每孔1 ×105细胞接种于24 孔板;将细菌调至OD600=0.4,用无抗生素的DMEM 培养基洗3 次,按100∶1 的细菌/细胞比例调整细菌浓度,加入1 ml/孔至细胞培养板,900 r/min离心10 min,37℃5%CO2作用2 h;PBS 洗3 次,加入300 μl 的胰酶作用5 min,再加入700 μl 5%BSAPBS 吹匀,稀释涂板,培养24 h 后计数,以黏附的细菌数/接种细菌数计算黏附率。每次试验重复2 孔,每个试验重复3 次。
1.7 Δcrp 和ΔsipB 缺失株感染上皮细胞侵入试验 参照Dong[12]的方法将细胞按照每孔1 ×106细胞接种于6 孔板;将细菌调至OD600=0.4,用无抗生素的DMEM 培养基洗三次,按100∶1的细菌/细胞比例调整细菌浓度,加入1 ml/孔至细胞培养板,900 r/min 离心10 min,37℃5%CO2作用2 h;PBS 洗3 次,在PBS 洗3 次后,换含100 μg/ml 庆大霉素的DMEM 作用90 min;PBS 洗3 次,再加入1 ml 含0.1% Triton X-100 的PBS,吹匀,PBS 稀释涂板,培养24 h 后计数,以侵入的细菌数/接种细菌数计算侵入率。每次试验重复2 孔,每个试验重复3 次。
1.8 统计学分析 数据分析用SPSS13.0 软件进行,各组间差异比较采用t 检验,P<0.05 或P<0.01 为差异具有统计学意义。
2 结果
2.1 Δcrp 和ΔsipB 缺失株的表型鉴定 亲本菌株SL1344 和SL1344ΔsipB 在含1%麦芽糖的麦康凯琼脂培养基上呈红色菌落,可利用麦芽糖,而SL1344Δcrp 不能利用麦芽糖,在含1%麦芽糖的麦康凯琼脂培养基上呈无色菌落(见图1)。生化试验结果表明,SL1344ΔsipB 利用碳源的能力与SL1344基本相同,但SL1344Δcrp 与亲本菌株相比,只保留了利用葡萄糖的能力,不能够利用半乳糖、麦芽糖、木糖、鼠李糖、山梨醇、甘露醇(表1)。
2.2 Δcrp 和ΔsipB 缺失株生长特性鉴定 将缺失株SL1344Δcrp、SL1344ΔsipB 及亲本株SL1344 菌液浓度均调整至1 ×106CFU/ml 为起始浓度开始振荡培养,每隔1 h 取样进行涂板计数,结果显示,SL1344ΔsipB 和亲本菌株SL1344 生长速度没有明显差异,而SL1344Δcrp 较亲本菌株相比发生了显著的降低(图2)。
2.3 Δcrp 和ΔsipB 缺失株免疫小鼠后在体内的动态分布 基因缺失株实验组和亲本株对照组的小鼠均口服免疫1 ×107CFU 剂量的菌液,亲本株在肝、脾内的细菌数显著高于各缺失株,并于1 周内全部死亡。其中crp 基因缺失组在各脏器分离到的细菌数目高于sipB 缺失组,两组实验组的细菌均是在肝中逐渐被清除,到第4 周被基本清除;在脾脏中的细菌到接种后第4 周仍保持低水平的细菌数(见表2)。
2.4 Δcrp 和ΔsipB 缺失株感染上皮细胞黏附和侵入试验 由图3 可知,当HeLa 细胞细胞形成单层后,以100MOI 的量接种亲本株或缺失株细菌,黏附试验表明,sipB 基因缺失组的黏附率(图3A)和侵入率(图3B)显著低于对照组,而crp 基因实验组与对照组无明显差异。
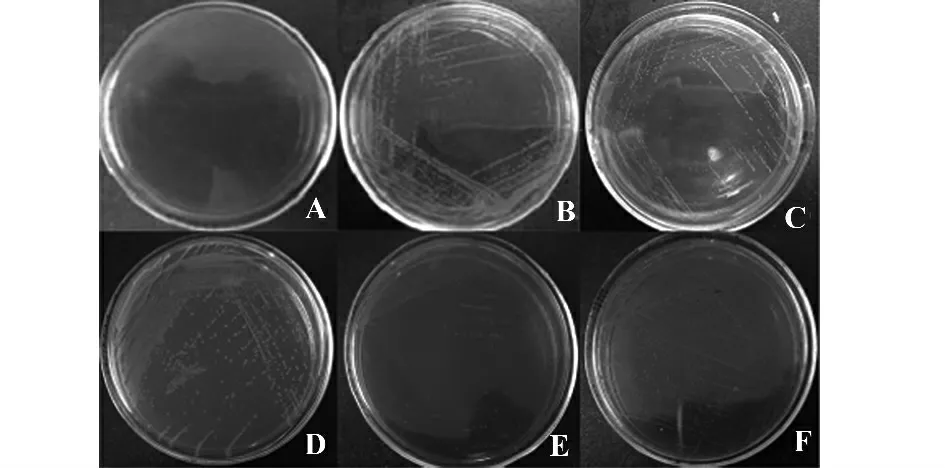
图1 SL1344、SL1344ΔsipB 和SL1344Δcrp 在培养基上的生长情况Fig.1 Growth of SL1344,SL1344ΔsipB and SL1344-Δcrp on medium

图2 缺失菌株SL1344ΔsipB、SL1344Δcrp 与亲本菌株SL1344 的CFU 生长曲线Fig.2 Growth curves of SL1344ΔsipB,SL1344Δcrp and SL1344 base on CFU

图3 SL1344△sipB、SL1344△crp 和SL1344 对HeLa 细胞的黏附率和侵入率试验Fig.3 Adherence and intracellular assay of SL1344,SL1344△sipB and SL1344△crp to HeLa cells

表1 SL1344,SL1344Δcrp 和SL1344ΔsipB 生化特性比较Tab.1 Comparison of biochemical characteristics of SL1344,SL1344Δcrp and SL1344ΔsipB
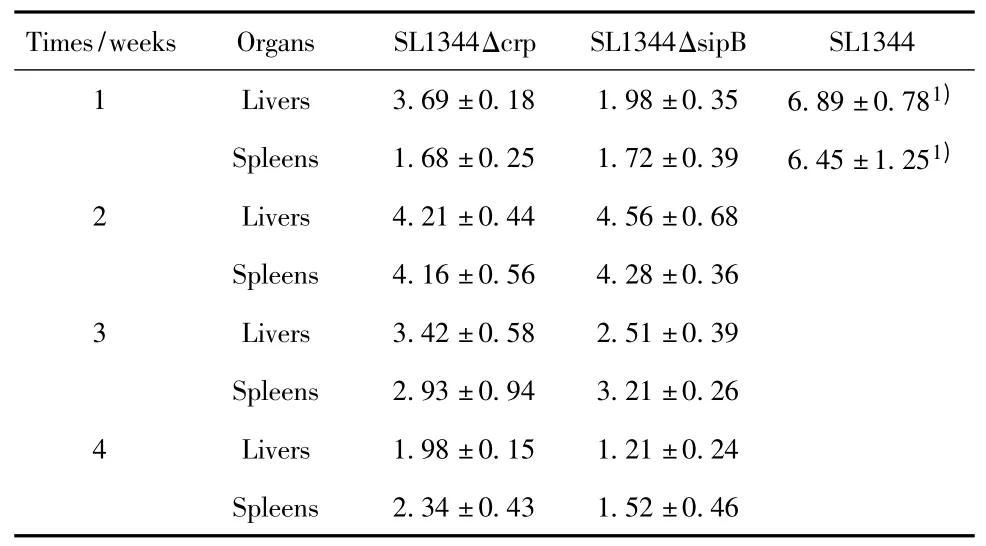
表2 免疫后4 周内细菌在BALB/c 小鼠体内的分布Tab.2 Distribution of bacteria in BALB/c mice on 4 weeks post-inoculation
3 讨论
鼠伤寒沙门菌具有非连续的侵入非吞噬细胞的能力,细菌的效应蛋白穿过宿主细胞的细胞膜主要由一些转运蛋白参与完成的,这些转运蛋白包括SipB、SipC、SipD,这些转运蛋白可能形成一个通道使细菌的一些效应蛋白通过细胞膜[13]。在沙门菌感染红细胞过程中需要上述三个转运蛋白形成一个功能性小孔,它们在沙门菌侵染哺乳动物细胞过程中扮演着非常重要的角色[14]。其中SipB 是SPI-1 T3SS 的效应蛋白,与细菌侵入有关。Santos 等[15]报道在鼠伤寒沙门菌感染牛巨噬细胞早期sipB 缺失株能够显著降低巨噬细胞发生凋亡。我们在研究过程中也发现鼠伤寒沙门菌SL1344 株sipB 的基因缺失株能够降低对小鼠的致病性,但机制尚不清楚,因此本实验对构建的缺失株进行了后续研究。有学者研究发现,和sipB 同样位于SPI-1 上的编码腺苷酸环化酶受体蛋白crp 基因缺失株通过消除消除了细菌在哺乳动物中摄取cAMP 的唯一途径,影响参与碳水化合物、氨基酸和小肽代谢的广泛功能及影响菌毛与鞭毛的表达和降低其生长增殖速度等途径来降低其毒力[16,17]。我们的研究结果发现crp 基因缺失株失去了利用麦芽糖、半乳糖、山梨醇等的能力,并且生长速度与亲本菌株相比也发生了显著的下降,两者的结论相一致。而sipB 基因缺失株仍然保持着利用麦芽糖、半乳糖、山梨醇等的能力,并且其生长速度较亲本菌株相比没有发生明显的变化,说明sipB 基因缺失后不影响菌株参与碳水化合物、氨基酸和小肽代谢等功能。通过构建小鼠感染模型和上皮细胞感染模型对缺失株进行侵袭力比较。在小鼠体内的动态分布结果表明缺失菌株较亲本菌株相比在肝脏和脾脏分离到的细菌数明显的低于亲本菌株,并且均能很快地被清除,实验组间对比发现sipB缺失组在各脏器分离到的细菌数低于crp 缺失组,说明sipB 基因缺失实验组对小鼠内脏器官的毒力和侵袭力下降更明显,细胞的黏附和侵入试验结果显示缺失sipB 基因后能够显著降低对上皮细胞的黏附和侵入能力,而crp 基因缺失株实验组与亲本菌株对照组无明显差别,均与前面的小鼠试验模型结果相一致。通过以上试验结果说明sipB 基因缺失株可能是通过降低对机体的内脏器官和上皮细胞的黏附和入侵能力来达到降低毒力的目的,而crp基因缺失株可能通过影响参与碳水化合物、氨基酸和小肽代谢的广泛功能及影响菌毛与鞭毛的表达和降低其生长增殖速度等途径来降低其毒力。
[1]Paine NJ,Ring C,Bosch JA,et al.The time course of the inflammatory response to the Salmonella typhi vaccination[J].Brain Behav Immun,2013,30:73-79.
[2]Lillard JJ,Boyaka PN,Singh S,et al.Salmonella-mediated mucosal cell-mediated immunity[J].Cell Mol Biol(Noisy-le-grand),2001,47(7):1115-1120.
[3]Kim JS,Kim BH,Jang JI,et al.Functional insight from the tetratricopeptide repeat-like motifs of the type III secretion chaperone SicA in Salmonella enterica serovar Typhimurium[J].FEMS Microbiol Lett,2014,350(2):146-153.
[4]Obregon C,Dreher D,Kok M,et al.Human alveolar macrophages infected by virulent bacteria expressing SipB are a major source of active interleukin-18[J].Infect Immun,2003,71(8):4382-4388.
[5]Kang HY,Dozois C M,Tinge S A,et al.Transduction-mediated transfer of unmarked deletion and point mutations through use of counterselectable suicide vectors[J].J Bacteriol,2002,184(1):307-312.
[6]Myeni SK,Wang L,Zhou D.SipB-SipC complex is essential for translocon formation[J].PLoS One,2013,8(3):e60499.
[7]Asakura H,Ekawa T,Sugimoto N,et al.Membrane topology of Salmonella invasion protein SipB confers osmotolerance[J].Biochem Biophys Res Commun,2012,426(4):654-658.
[8]Han L,Zhen YH,Liang AX,et al.Oral vaccination with inhibin DNA delivered using attenuated Salmonella choleraesuis for improving reproductive traits in mice[J].J Basic Microbiol,2014,54(9):962-968.
[9]Mukherjee S,Barman S,Mandal NC,et al.Anti-bacterial activity of Achatina CRP and its mechanism of action[J].Indian J Exp Biol,2014,52(7):692-704.
[10]廖成水,程相朝,赵战勤,等.鼠伤寒沙门菌SL1344 株cAMP受体蛋白基因缺失株的构建及其生物学特性[J].中国兽医学报,2011(12):1711-1716.
[11]陈松彪,李 静,郁 川,等.鼠伤寒沙门菌SL1344 株侵袭性蛋白B 缺失株的构建及生物学特性[J].中国免疫学杂志,2015,34(2):215-220.
[12]Dong H,Peng D,Jiao X,et al.Roles of the spiA gene from Salmonella enteritidis in biofilm formation and virulence[J].Microbiology,2011,157(Pt 6):1798-1805.
[13]Galan JE.Interactions of Salmonella with host cells:encounters of the closest kind[J].Proc Natl Acad Sci USA,1998,95(24):14006-14008.
[14]Lara-Tejero M,Galan JE.Salmonella enterica serovar typhimurium pathogenicity island 1-encoded type III secretion system translocases mediate intimate attachment to nonphagocytic cells[J].Infect Immun,2009,77(7):2635-2642.
[15]Santos RL,Tsolis RM,Baumler AJ,et al.Salmonella enterica serovar typhimurium induces cell death in bovine monocyte-derived macrophages by early sipB-dependent and delayed sipB-independent mechanisms [J].Infect Immun,2001,69 (4):2293-2301.
[16]Alper MD,Ames BN.Transport of antibiotics and metabolite analogs by systems under cyclic AMP control:positive selection of Salmonella typhimurium cya and crp mutants[J].J Bacteriol,1978,133(1):149-157.
[17]陈松彪,李 静,尚 珂,等.鸡白痢沙门菌C79-13ΔcrpΔasd平衡致死系统的构建及其生物学特性的研究[J].中国免疫学杂志,2014,30(8):1083-1087,1092.