K652 重组表达IL-6 基因对NK 细胞表型和功能的影响①
李登瑞 杨永辉 李 辉 郭素敏 朱桂云 李秀武 耿书军 赵荣娣 任雪飞 高 莉 辛 欣
(河北省胸科医院,河北省肺癌防治中心,石家庄 050041)
现在肿瘤对人类生存健康的威胁越来越严重,对肿瘤的治疗方法也发生着越来越多的变化,各种各样的肿瘤治疗已经显现出来,成为治疗肿瘤的重要发展方向。继肿瘤浸润淋巴细胞(TIL)、淋巴因子激活杀伤细胞(LAK)及CD3 单抗激活的杀伤细胞(CD3AK)后,自然杀伤细胞(Nature killer,NK)的杀瘤作用日益显现出来[1,2]。NK 细胞是将人外周血、脐带血或骨髓的单个核细胞在体外多种细胞因子(干扰素、白介素等)作用下培养一段时间后获得的一群细胞。NK 细胞的过继治疗在抗病毒、抗肿瘤的治疗中有着广泛的应用前景,在造血干细胞移植后减少移植物抗宿主反应中的作用也倍受关注[2]。由于NK 细胞在外周血中所占的比例很少,建立一种有效的NK 细胞体外扩增系统是深入研究NK 细胞功能与探讨NK 细胞免疫治疗的基础。体外获取人NK 细胞主要有两种途径:一是采用抗NK细胞特异性抗体与磁珠交联的方法,从PBMC 中分离人NK 细胞;二是采用刺激扩增培养的方法,从PBMC 中扩增培养人NK 细胞[3]。与其他过继性免疫治疗细胞相比,NK 还具有增殖速度快、杀瘤活性高、杀瘤谱广、副作用小、对正常骨髓造血影响轻微等优点。因此,NK 细胞的应用被认为是新一代肿瘤过继免疫治疗的首选方法。
NK 细胞体外大量扩增并且获得强大的细胞毒活性与多种细胞因子的作用有着密切关系,这些细胞因 子 包 括IL-1、IL-2、IL-7、IL-12、IFN-γ 以 及CD3McAb 等[4,5]。通过体外的刺激培养可进行相对大规模的NK 细胞制备,使临床应用成为可能。但是迄今为止多数的体外刺激扩增培养也只能使NK 细胞在体外扩增数十到百倍,且纯度也不理想。在本文研究中,我们采用基因工程方法,在K562 细胞上表达IL-6 基因,构建特定的K562 工程细胞作为刺激细胞。IL-6 基因与一段特殊的跨膜蛋白基因融合,使IL-6 蛋白在K562 细胞中表达后锚定于细胞膜表面。其次,以γ 射线照射致死的K562 工程细胞作为刺激细胞,以人外周血单个核细胞(PBMC)为扩增培养对象,通过与IL-6 的共刺激作用,使NK 细胞在体外培养条件下得到大量的扩增。用4 h51Cr 释放实验检测NK 细胞对K562 细胞杀伤水平的影响。用NK 细胞作用K562 细胞的毒活性进行功能分析。
1 材料与方法
1.1 主要试剂和仪器 脐带血来源于白求恩国际和平医院,K562 细胞来自河北省肿瘤医院科研中心。RPMI1640 培养基、0.25%胰酶为美国Gibco 公司产品,淋巴细胞分离液购自德国GE 公司。流式细胞荧光标记抗体、IL-2、IL-15、IL-6 购自美国PeproTech 公司。流式细胞仪为美国BECKMAN-COULTER 公司。CO2培养箱为美国Thermo 公司。
1.2 表达IL-6 的重组K562 细胞的构建 采用RT-PCR 方法分别从人单核细胞(PBMC)中扩增IL-6 cDNA,测序正确后,IL-6 基因克隆至CD8 信号肽的下游。重组的IL-6 亚克隆至含有不同筛选标记的真核表达载体,先后脂质体转染K562 细胞后,筛选稳定表达的细胞克隆,构建K562 工程细胞株。K562 细胞与PBMC 共培养前,用γ 射线照射致死。
1.3 NK 细胞的诱导 将12 份(每组4 份)人外周血分离出单核细胞,制备成细胞悬液,同时加入IL-2和IL-15 到培养袋中进行培养,标号实验组和对照组。第1 组为实验组,加入IL-2 和IL-15,再另加射线灭活的同等数量的重组K562 细胞,第6 天起每隔3 d 对孔中的液体半换液,同时设以下两个平行对照组:第2 组加入IL-2 和IL-15,再加入IL-6 作用组;第3 组为空白对照组,加入IL-2 和IL-15。然后加入RPMI1640 培养基,置于37℃、5%CO2培养箱中培养扩增,每天观察细胞生长并根据情况进行扩增。
1.4 免疫荧光染色和流式细胞术分析(FCM)NK细胞表型 培养21 d 后收集细胞因子刺激的PBMC细胞,调整细胞数,为1 ×107ml-1,加入细胞悬液50 μl(用DPBS 稀释)灭活正常兔血清,室温作用10 min。加入CD(16 +56)-PE 和CD3-FITC 进行膜表面双色荧光标记,对照组加入PE IgG1 和FITC IgG1,作用30 min。用洗涤液洗涤2 次。加适量固定液,用流式细胞术进行细胞分类分析,确定CD56+CD16+CD3-细胞的比例。
1.551Cr 释放实验法检测细胞毒活性 效应细胞为人白血病细胞株K562。将K562 细胞悬液置于37℃,5%CO2培养箱中进行培养,收集对数生长期K562 细胞,调整细胞数为2.0 × 106ml-1,加入51Cr 3.7 MBq,37℃孵育1.5 h,中间每隔15 min 晃动1次。标记完毕后洗涤3 次,调整靶细胞数至1.0 ×105ml-1,加入96 孔U 型板,100 μl/ 孔。收集细胞因子刺激的PBMC,按照不同的效靶比加入含有预先标记K562 细胞的96 孔U 型板中,37℃孵育4 h,380 r/min 离心5 min,收集上清液每孔100 μl,用 计数仪测定CPM 值,按以下公式如下:

2 结果
2.1 构建重组K562D3 细胞 ABCDE 五组实验,第D 组第3 批次重组的K562 细胞稳定表达IL-6,我们将其命名为K562D3 细胞,我们以后做的所有实验都用这一批次的重组细胞,以区别于靶细胞K562。成功构建了表达IL-6 的重组K562D3 细胞。射线照射后的K562 细胞经过连续2 周的培养,存活细胞消失。照射后的重组K562 细胞在3~7 d 内依然具有完整的细胞形态,与PBMC 混合后,照射过的重组K562 细胞在第7 天后破碎并被逐渐吞噬干净。
2.2 NK 细胞的增长曲线 动态监测NK 细胞的增殖情况,发现3 组NK 细胞均在培养第3 天开始增殖,培养第14 天进入快速增长期,到20 d 增殖速度达到最快。20 d 以后进入平台期。3 组细胞悬液中都加入IL-2 和IL-15,第1 组为加射线灭活的同等数量的重组K562 细胞:第2 组为加入IL-6 作用组;第3 组为空白对照组。3 组间的NK 细胞增殖存在着不同。实验组第1 组NK 细胞生长得快,而且细胞数量多,对照组第1 组、第2 组的NK 细胞生长不如第1 组NK 细胞生长得快和数量多。每组4 份细胞,到23 d 时,第1 组CD56+CD16+CD3-细胞数量比单个核细胞数量扩增了(760 ±18)倍。第2 组CD56+CD16+CD3-细胞数量比单个核细胞数量扩增了(216 ±5)倍。第3 组CD56+CD16+CD3-细胞数量比单个核细胞数量扩增了(23 ±1)倍。统计学分析差异显著,P<0.05。结果见图1。
2.3 扩增的NK 细胞表面标记分析 对第3 组重组的K562工程细胞刺激扩增的NK细胞进行纯度检测,采用流式细胞术进行分子表面标记物CD56、CD16、CD3 分析。结果证实,经过23 d 的刺激培养后,流式细胞仪检测到PBMC 细胞表面标记物CD56+CD3-的纯度增多;扩增前是6% ±0.4%,扩增后是91% ±2%(图2)。
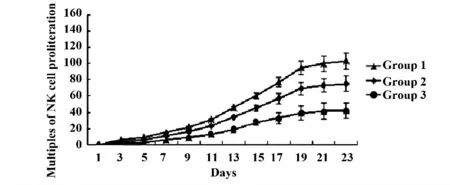
图1 NK 细胞的增殖曲线Fig.1 Curve of cell proliferation of NK cell
2.4 不同条件下诱导的NK 细胞对K562 肿瘤细胞的杀伤率 由表1 可见,在相同效靶比下诱导的NK细胞杀伤率1 组明显最大,说明1 组NK 细胞对K562 的杀伤作用最强。2、3 组次之。而在相同条件下诱导的NK 细胞,其在效靶比为20∶1 时,对K562 细胞的杀伤率均明显高于10∶1。统计学分析差异显著,P<0.05。
3 讨论
NK 细胞是先天免疫中一类重要的细胞,通过细胞毒作用和分泌细胞因子参与机体抗感染和抗肿瘤免疫[6,7]。因其作用不需初次免疫活化,因而在过继免疫治疗上有其独特的应用前景。由于不能获得数量大、纯度高的人NK 细胞,使NK 细胞在免疫治疗中的应用受到了限制。采用体外扩增的方法获得足够数量和较高纯度的人NK 细胞,是近年来研究NK 细胞功能特别是探讨过继免疫治疗的一个重要基础平台。尤其是对手术后或者放、化疗后患者效果显著,能消除残留的转移病灶,防止癌细胞的扩散,提高机体自身的免疫力[8]。
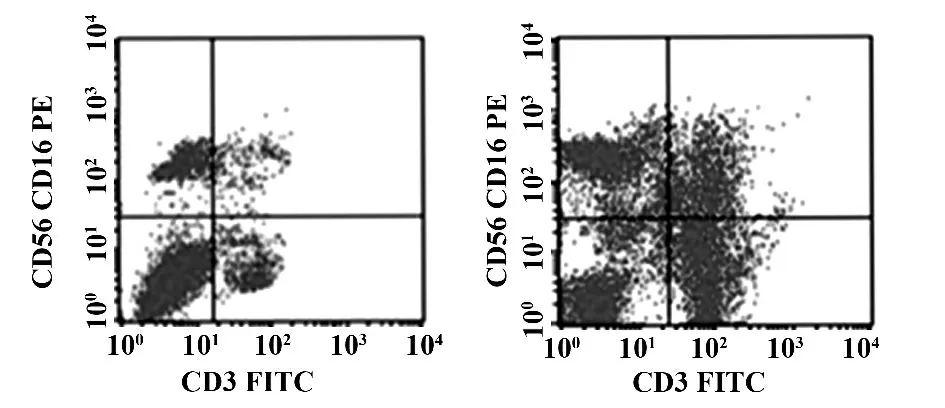
图2 流式细胞仪检测NK 细胞表型Fig.2 Immunophenotypic analysis of NK cell surface markers was performed by flow cytometry
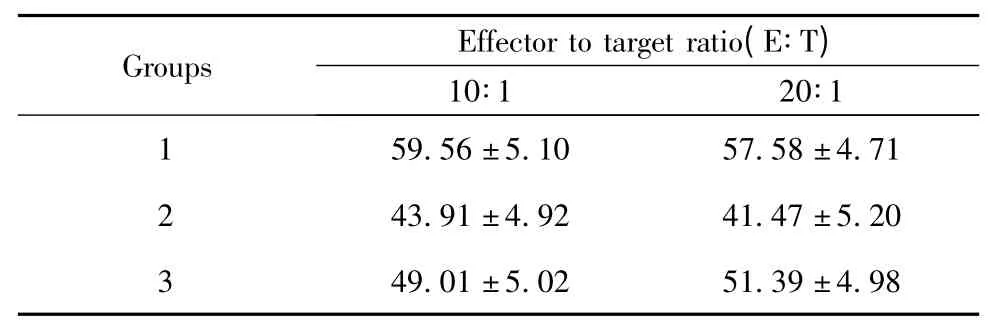
表1 不同条件诱导的NK 细胞对K562 肿瘤细胞的杀伤率Tab.1 Cytotoxicity of NK cells to K562 cells cultured in different conditions
人正常的外周血中含有极少量的NK 细胞,PBMC 在体外经过多种细胞因子诱导后获得大量的NK 细胞。这些细胞因子包括IL-2、IL-15、单克隆抗体等[9]。上述这些扩增方法获得的NK 细胞似乎还不能满足过继免疫治疗的需要,NK 细胞的增殖、活化、杀伤及分泌等功能,仅仅靠可溶性细胞因子的刺激还很难使NK 细胞得到大量的扩增。国内外学者在扩增的方法上进行了各种的探索,如采用磁株分选的方法先从人PBMC 中分离NK 细胞,获得的NK细胞在体外培养条件下,用可溶性IL-2、IL-12、IL-15等细胞因子共同刺激,能使NK 细胞扩增数十倍[10,11]。除了细胞因子外,K562、HFWT 等肿瘤细胞也能够刺激NK 细胞的扩增,采用照射致死的K562 细胞或HFWT 细胞与PBMC 共培养,也能使PBMC 中的NK 细胞得到一定的扩增[12,13]。IL-6 的生物学活性:①刺激细胞生长:IL-6 可促进多种细胞的增殖,如B 淋巴细胞杂交瘤、浆细胞瘤、EBV 转化的B 细胞、T 细胞、PMA 和IL-4 刺激的胸腺细胞、造血干细胞、角朊细胞和肾小球系膜细胞。②促进细胞分化:如B 细胞分化和Ig 的分泌,CTL 分化,协同IL-2 增强CTL 中穿孔素基因的表达,并增加T 细胞IL-2 产生和IL-2R 表达,诱导巨噬细胞、神经细胞和NK 细胞分化。协同IL-3 促进干细胞分化和巨核细胞的成熟,明显促进小鼠骨髓移植后免疫功能的重建。
本实验结果与以往结果相比[12,14],在数量上,没有将多个细胞因子如IL-15、IL-18 和4-1BBL 三种基因共同表达,只表达一种IL-6 基因的重组K562,得到NK 细胞的数量多、纯度高和活性强,这是一个突破。本研究在以膜蛋白形式表达非可溶形式的IL-6 的基础上,构建了表达IL-6 的重组K562 细胞,结果表明用重组的K562 扩增的NK 细胞,其细胞毒活性比IL-6 单独扩增的NK 细胞提高了约10%,扩增倍数达到了760 倍。本扩增方法获得NK 细胞95%杀伤率和91%纯度高,操作简单,只是表达了一种非可溶性基因,也可以达到很高的扩增和纯度。
本研究为CIK 细胞进一步应用于临床肿瘤治疗奠定了基础,其有关作用机理还需要进一步探索。
[1]Sconocchia G,Eppenberger S,Spagnoli GC,et al.NK cells and T cells cooperate during the clinical course of colorectal cancer[J].Oncoimmunology,2014,3(8):e952197.
[2]June CH.Adoptive T cell therapy for cancer in the clinic[J].J Clin Investi,2007,117:1466-1476.
[3]Cancer Immunotherapy Scores Again[J].Cell,2015,160(1-2):7
[4]Nguyen KB,Salazar-Mather TP,Dalod MY,et al.Coordinated and distinct roles for IFN-alpha beta,IL-12,and IL-15 regulation of NK cell responses to viral infection[J].J Immunol,2002,169(8):4279-4287.
[5]Lefterova P,Marten A,Buttgereit P,et al.Targeting of natural killer-Like T immunologic effector cells against Leukemia and lymphoma cellsby reverse antibody-dependent cellular cytotoxicity[J].J Immu,2000,23(3):304-310.
[6]Chuang SS.In situ hybridisation for Epstein-Barr virus as a differential diagnostic tool for T-and natural killer/T-cell lymphomas in non-immunocompromised patients[J].Pathology,2014,46(7):581-591.
[7]Poli M,Sève P,Merrot O,et al.Diagnosis of a multicentric extranodal nasal-type natural killer T-cell lymphoma made with an anterior chamber tap[J].Retin Cases Brief Rep,2012,6(1):46-49.
[8]Fiala M.Curcumin and omega-3 fatty acids enhance NK cell-induced apoptosis of pancreatic cancer cells but curcumin inhibits interferon-γ production:benefits of omega-3 with curcumin against cancer[J].Molecules,2015,20(2):3020-3026.
[9]Schuster IS,Wikstrom ME,Brizard G,et al.TRAIL(+)NK Cells Control CD4(+)T cell responses during chronic viral infection to limit autoimmunity[J].Immunity,2014,41(4):646-656.
[10]Pilones KA,Aryankalayil J,Babb JS,et al.Invariant natural killer T cells regulate anti-tumor immunity by controlling the population of dendriticcells in tumor and draining lymph nodes[J].J Immunother Cancer,2014,2(1):37.
[11]Wu J.IL-15 Agonists:the cancer cure cytokine[J].J Mol Genet Med,2013,7:85.
[12]Schmidt TL,Negrin RS,Contag CH.A killer choice for cancer immunotherapy[J].Immunol Res,2014,58(2-3):300-306.
[13]Yokoyama WM,Sojka DK,Peng H,et al.Tissue-resident natural killer cells[J].Cold Spring Harb Symp Quant Biol,2013,78:149-156.
[14]Rooney MS,Shukla SA,Catherine J,et al.Molecular and genetic properties of tumors associated with local immune cytolytic activity[J].Cell,2015,160(1-2):48-61.