姜黄素通过抑制STAT3 通路调控人结肠癌耐奥沙利铂细胞株的耐药性①
文坤明 冷 敏 程家平 陈正权 陈奕霖 曾庆良 (遵义医学院附属医院胃肠外科,遵义 563003)
肿瘤对化疗药物多药耐药(Multidrug resistance,MDR)是影响其化疗效果的关键原因,肿瘤耐药的机制包括:机体或肿瘤基因或表观遗传发生改变、肿瘤微环境改变或阻止化疗药物进入细胞等,其中肿瘤细胞高表达ABC 药物转运蛋白(ATP-binding cassette transporters,ABC transporters),将进入肿瘤细胞的化疗药物泵出细胞,使化疗药物无法达到有效浓度从而发生耐药在肿瘤细胞耐药机制中起了重要作用[1]。P-糖蛋白(P-gp)由耐药基因MDR-1 编码,是ABC 药物转运蛋白超家族一员,结肠癌细胞高表达P-gp 是影响治疗效果的主要障碍之一[2]。研究发现,表达P-gp 的基因MDR-1 存在受STAT3调控的启动子结合域,STAT3 可调控P-gp 表达在肿瘤耐药中起作用[3]。本项目拟研究具有抗癌活性的姜黄素(Curcumin,Cur)对具有MDR 特性的人结肠癌耐奥沙利铂(Oxaliplatin,Oxa)细胞株(SW620/OxR)的逆转作用及其机制是否与抑制STAT3 信号通路有关。
1 材料与方法
1.1 细胞株 人结肠癌细胞株SW620 购于中国科学院上海细胞库。将SW620 细胞在含10%胎牛血清(FBS)的L-15 培养基中培养。按照我们之前报道的方法建立稳定的耐药细胞株[4]:在SW620 细胞的培养液中最初加入浓度0.1 μmol/L 的Oxa,加药后大部分细胞死亡,少量存活细胞继续生长,待细胞融合度达80%左右时予传代处理,传3 代后提高Oxa 浓度,由0.1 μmol/L 提高到0.5 μmol/L,同样的处理方法由0.5 μmol/L 提高到1.0 μmol/L,最终达临床血药浓度2.0 μmol/L,至少传5 代以上进行后续实验,最终所建立的稳定的耐药细胞称为SW620/OxR。
1.2 相关试剂 奥沙利铂及姜黄素购自美国Sigma 公司;细胞增殖检测试剂WST-1 购自瑞士Roche公司;L-15 培养基购于北京迈成生物有限公司;胎牛血清(FBS)购自美国Gibco 公司;兔抗人P-STAT3(pY705)抗体购自美国Eptomics 公司、鼠抗人P-gp抗体购自美国Santa-Cruz 公司;鼠抗人β-actin 一抗、山羊抗鼠、山羊抗兔二抗购自北京中杉金桥公司。
1.3 细胞增殖活性检测 为了选择合适浓度的Cur 进行实验,我们首先测定了姜黄素对耐药细胞的IC50 值(半数抑制浓度)。Cur 用二甲基亚砜(DMSO)溶解配置成浓度为500 mmol/L 于-20℃储存备用,使用时用细胞培养基稀释成目标浓度(DMSO 终浓度均<0.1%)。
采用细胞增殖检测试剂WST-1 检测细胞增殖活性。将耐药细胞SW620/OxR 接种于96 孔板,细胞数量为3 000 个/孔,培养液为含10%FBS 的L-15培养基。参考文献报道的姜黄素对结肠癌细胞的作用浓度[5],我们选择5 个梯度浓度的Cur 进行实验。在接种12 h 细胞贴壁生长后,将细胞暴露于含Cur浓度分别为0、1、5、10、20、30 μmol/L 的培养基中,每种浓度设置3 个复孔,于37℃含5%CO2的细胞培养箱中培养48 h 后(文献报道[5,6],姜黄素对结肠癌、肺癌等肿瘤细胞的IC50 检测时间选择在加药后24~48 h,本研究检测时间定为加药后48 h),酶标仪在570nm(OD570)波长下进行吸光度检测。检测前10 min,根据WST-1 试剂盒操作说明在每孔中加入10 μl WST-1 试剂震荡混匀。按照我们之前报道的方法[4],计算加药后细胞相对于未加药对照组的存活细胞百分率,并且进行3 次独立实验。考虑到Cur 与Oxa可能存在协同杀伤癌细胞的作用,并且为了尽量减小高浓度药物所致的不良反应,我们选择的Cur 药物浓度为IC50 前一浓度来进行后续实验。
1.4 细胞凋亡检测 为了明确Cur 对耐药细胞凋亡的影响,我们将SW620/OxR 分为对照组和实验组(后面的实验与之相同),对照组细胞培养液为含2 μmol/L Oxa 及10%FBS 的L-15 培养液,实验组细胞培养液中另外增加IC50 前一浓度的Cur。取指数生长期SW620/OxR 细胞进行传代,待12 h 细胞贴壁后,加入相应的培养液各3 ml(50 ml 培养瓶),于37℃细胞培养箱中培养。在加药后48 h,0.25%胰酶消化收集每组细胞,每个样本细胞数量约为1×106,采用Annexin V/PI 双染色法,流式细胞仪检测细胞凋亡情况,右下象限为早期凋亡细胞,右上象限为中晚期凋亡(死亡)细胞,总的细胞凋亡率按早期凋亡细胞加中晚期凋亡细胞在总细胞数中的百分率计算。
1.5 Western blot 检测蛋白表达 P-STAT3 和P-gp蛋白检测采用Western blot 方法。实验分组及细胞处理方法同1.4,使用细胞刮收集细胞,采用反复冻融法破碎细胞,加入适量的裂解液(每100 μl 裂解液中加入1 μl 蛋白酶抑制剂)充分混匀裂解30 min,按(Pierce BAC protein Assay Kit)蛋白定量试剂盒操作说明进行浓度测定,加入上样缓冲液煮沸10 min 使蛋白充分变性,-80℃冻存备用;进行蛋白印迹实验的上样量为40 μg,6%或10%的SDS-PAGE胶分离蛋白,采用湿法转膜将相应蛋白转移至PVDF 膜上,5%脱脂奶粉封闭1 h 后加入一抗稀释液(P-STAT3:1∶2 000,P-gp:1∶500),4℃过夜孵育;PBST洗膜3 次,每次10 min;分别加入稀释比例均为1∶5 000的山羊抗兔及山羊抗鼠二抗,室温孵育1 h;PBST 洗膜3 次;ECL 发光并拍照;采用Quantity-One 软件对条带的吸光度值进行半定量分析,目的蛋白的相对量=目的条带的吸光度值/内参β-actin 蛋白条带的吸光度值。
2 结果
2.1 细胞增殖活性检测结果 不同浓度Cur 作用于SW620/OxR细胞后48h,采用细胞增殖检测试剂WST-1 检测的存活细胞百分率结果见图1,Cur对SW620/OxR 细胞的IC50 浓度为18.9 μmol/L。根据实验设计,在后续实验中,我们使用的Cur 浓度为10 μmol/L。
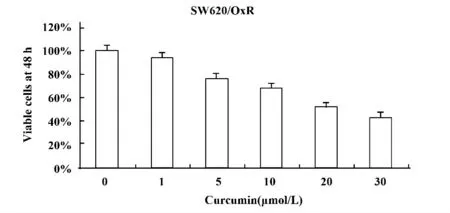
图1 不同浓度Cur 作用于SW620/OxR 细胞48 h 后存活细胞百分率Fig.1 Effect on percentage of surviving cells after 48 h with Cur of different concentrations conducted in SW620/OxR cells

图2 流式细胞技术检测实验组及对照组的细胞凋亡率Fig.2 Cells apoptosis rate in control group and experimental group detected by flow cytometry
2.2 细胞凋亡检测结果 将SW620/OxR 细胞暴露于含10 μmol/L 的Cur、2 μmol/L 的Oxa 及10%FBS 的L-15 培养液中与不含Cur 的对照组比较,细胞凋亡率由(5.08± 1.82)% 上升到(30.69 ±2.94)%,10 μmol/L 的Cur 作用于SW620/OxR 细胞后细胞凋亡率明显增高(P<0.05),见图2。
2.3 P-STAT3 及P-gp 表达结果 Western blot 检测结果提示,P-STAT3 及P-gp 蛋白分别由对照组的(0.23 ±0.04)及(0.75 ±0.12),下降到实验组的(0.09 ±0.01)及(0.16 ±0.04),加药后的实验组两种蛋白表达明显低于未加药的对照组(P 均<0.05),提示Cur 能明显抑制P-STAT3 及P-gp 蛋白的表达。图3 为其中一次检测结果。

图3 Western blot 检测对照组及实验组P-STAT3、P-gp蛋白表达结果Fig.3 Protein expression levels of P-STAT3 and P-gp in control group and experimental group detected by Western blot
3 讨论
结直肠癌(Colorectal cancer,CRC)的发病率位于恶性肿瘤的第3 位[7],手术和化疗是其主要的治疗方法。尽管在过去的十几年时间内,手术及化疗均取得了明显的进展,但均未能明显改善结直肠癌患者的预后,复发率仍维持在50%左右,MDR 是导致CRC 治疗失败的主要原因之一[8]。因此,研究结肠癌耐药机制,寻找逆转结肠癌MDR 的策略对改善结肠癌患者的预后具有重要意义。
耐药细胞株的建立为研究耐药机制并寻找逆转的方法提供了较好的研究平台。我们在之前的研究中,成功建立了人结肠癌耐奥沙利铂细胞株——SW620/OxR,已证实其具有MDR 特性[4]。Cur 是从姜黄根茎中提取出的主要活性物质,其具有抗癌活性[6-9],并且研究还发现其能逆转肿瘤耐药[6]。我们首先确定了Cur 对SW620/OxR 细胞是否具有逆转耐药的作用。
为了选择适当浓度的Cur 进行研究,我们首先采用细胞增殖试剂WST-1 检测了Cur 对耐药细胞的IC50 值。结果提示,Cur 对SW620/OxR 细胞的IC50 浓度为18.9 μmol/L,见结果2.1。考虑到Cur与Oxa 可能存在协同杀伤肿瘤细胞的作用,并尽量降低高药物浓度的Cur 对细胞的毒副作用,在后续实验中,我们选择10 μmol/L 的Cur 作用于SW620/OxR 细胞。采用流式细胞技术测定该浓度的Cur 对耐药细胞凋亡的影响,结果提示,加药后48 h,细胞凋亡率为(30.69 ±2.94)%,而未加药的对照组细胞凋亡率为(5.08 ±1.82)%,提示10 μmol/L 的Cur 导致SW620/OxR 细胞凋亡率明显增加(P<0.05),见结果2.2。以上结果表明Cur 作用于耐药细胞后能够明显抑制细胞增殖,显著增加细胞凋亡率,提示Cur 对具有MDR 特性的结直肠癌耐奥沙利铂细胞SW620/OxR 具有逆转耐药的作用。
STAT3 信号通路激活参与了多种肿瘤的MDR[3,10]。我们在之前的研究中也发现,SW620/OxR 细胞相对于其亲本细胞SW620,STAT3 激活的标志磷酸化STAT3(p-STAT3)明显高表达[4],P-gp表达也明显增高[11],说明STAT3 信号通路激活及P-gp 高表达可能参与了结肠癌的MDR。研究还发现,编码P-gp 的基因MDR-1 存在受STAT3 调控的启动子结合域,STAT3 可调控P-gp 表达在肿瘤耐药中起作用[3]。我们进一步研究了姜黄素逆转人结肠癌细胞耐药是否与抑制STAT3 通路,降低P-gp 表达有关。Western blot 检测结果提示,加入10 μmol/L 的Cur 48 h 后的实验组较未加药的对照组P-STAT3 及P-gp 表达均明显降低(P<0.05),见结果2.3,提示姜黄素可抑制SW620/OxR 细胞的STAT3 信号通路并明显降低P-gp 表达。
综上所述,我们的研究显示,姜黄素能够明显抑制具有MDR 特性的人结肠癌耐奥沙利铂细胞增殖,能够明显增加细胞凋亡,说明其具有调控人结肠癌耐奥沙利铂细胞耐药性的作用,其作用机制可能与抑制STAT3 信号通路并明显降低P-gp 表达有关。
[1]Pramanik D,Campbell NR,Das S,et al.A composite polymer nanoparticle overcomes multidrug resistance and ameliorates doxorubicin-associatedcardiomyopathy[J].Oncotarget,2012,3 (6):640-650.
[2]Liu YS,Hsu HC,Tseng KC,et al.Lgr5 promotes cancer stemness and confers chemoresistance through ABCB1 in colorectal cancer[J].Biomed Pharmacother,2013,67(8):791-799.
[3]Zhang X,Xiao W,Wang L,et al.Deactivation of signal transducer and activator of transcription 3 reverses chemotherapeutics resistance of leukemia cells via down-regulating P-gp[J].PLoS One,2011,6(6):e20965.
[4]Wen KM,Fu ZX,Wu XY,et al.Oct-4 is required for an antiapoptotic behavior of chemoresistant colorectal cancer cells enriched for cancer stem cells:effects associated with STAT3/Survivin[J].Cancer Lett,2013,333(1):56-65.
[5]Shakibaei M,Buhrmann C,Kraehe P,et al.Curcumin chemosensitizes 5-fluorouracil resistant MMR-deficient human colon cancer cells in high density cultures[J].PLoS One,2014,9(1):e85397.
[6]Ye MX,Zhao YL,Li Y,et al.Curcumin reverses cisplatin resistance and promotes human lung adenocarcinoma A549/DDP cell apoptosis through HIF-1α and caspase-3 mechanisms[J].Phytomedicine,2012,19(8-9):779-787.
[7]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[8]Nautiyal J,Kanwar SS,Yu Y,et al.Combination of dasatinib and curcumin eliminates chemo-resistant colon cancer cells[J].J Mol Signal,2011,6:7.
[9]Hu A,Huang JJ,Jin XJ,et al.Curcumin suppresses invasiveness and vasculogenic mimicry of squamous cell carcinoma of the larynx through the inhibition of JAK-2/STAT-3 signaling pathway[J].Am J Cancer Res,2014,5(1):278-288.
[10]Zhu H,Chen X,Chen B,et al.Activating transcription factor 4 mediates a multidrug resistance phenotype of esophageal squamous cell carcinoma cells through transactivation of STAT3 expression[J].Cancer Lett,2014,354(1):142-152.
[11]文坤明,傅仲学,张贵海,等.结直肠癌耐药细胞株诱导上皮间质转化的研究[J].中华实验外科杂志,2012,29(10):2015-2018.