脉红螺形态学参数分析及其交配行为的观察❋
孙晓琪, 于 红, 于瑞海, 李 琪(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
研究简报
脉红螺形态学参数分析及其交配行为的观察❋
孙晓琪, 于 红, 于瑞海, 李 琪
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
为探究脉红螺(Rapanavenosa)的交配模式及交配前的性选择机制,本实验选取99个脉红螺成体进行形态学测量并分析6个形态参数的相关性。研究发现,脉红螺的壳宽、体螺层高、厣宽和厣高均与壳高有显著相关性(r≥0.8),与螺旋部高无相关性(r<0.3),螺旋部高仅与壳高有弱相关性(0.3≤r<0.5);进一步比较雌螺和雄螺的6个形态学参数,发现脉红螺不存在性别二态性现象。在室内养殖池内观察脉红螺交配行为,发现亲螺入池后2~4d,雌螺和雄螺陆续出现交配现象;脉红螺每次交配持续时间均小于96 h,其中83.6%的交配在48 h内完成;雌螺和雄螺的交配次数均在0~5次之间,交配间隔期在2.67~8.80d之间,且前2次交配的间隔期要长于其他间隔期;未发现脉红螺在交配前以外部形态特征作为选择依据。研究表明,脉红螺属于多雌多雄的混交模式。
脉红螺; 交配模式; 性选择; 性别二态性; 形态参数
性选择(Sexual selection)是指在有性生殖环境下对可以增加动物生殖成功性状的选择,它是自然选择的一种特殊形式[1]。动物为了繁衍后代、提高自身繁殖成功率,表现出各种各样的性选择行为,既包括同性个体间的竞争,也包括异性间的配偶选择;既存在交配前形态个体水平的性选择,也存在交配后精卵之间的性选择。性选择的成功与否直接决定动物的繁殖成功率,对其生物学特性的遗传有着重要影响,是动物在有性生殖环境下最重要的行为[1];同时性选择对于物种的进化和形成也具有重要意义,性选择行为的分化会改变物种种群内某些基因的基因型频率,导致物种内的微进化,进而加速新物种的形成[2]。性选择研究一直是繁殖行为学、行为生态学和进化生态学等研究领域的热点,不仅有助于了解物种的交配模式演化和行为进化趋势,同时也可为物种种质资源保护提供理论基础,为经济动物的人工繁育提供重要资料。
腹足类是软体动物门中分布最广、属种最多的一个类群,其数量仅次于昆虫,是少有的能够栖息于海洋、淡水和陆地3种生境的动物类群。腹足类具有复杂的求偶和繁殖方式,混交与精子贮存现象较为普遍,是近年来水生无脊椎动物性选择研究中的热点类群。研究发现,腹足类交配前性选择的主动方多为雄螺[3-5],性选择依据主要为雌螺的个体大小及交配状态,不同种属之间选择标准有所不同。
脉红螺(Rapanavenosa)隶属于软体动物门(Mollusca)、腹足纲(Gastropoda)、新腹足目(Neogastropoda)、骨螺科(Muricidae)、红螺属(Rapana),成体壳高约110 mm,为大型海洋底栖贝类,广泛分布在中国渤海和黄海潮间带至水深约20 m的岩石岸及泥沙质的浅海[6]。脉红螺足部肥大、味美、营养丰富,除鲜食外,可制罐、冷冻或加工成干制品,深受国内外市场欢迎,已成为中国重要的养殖开发品种。脉红螺为雌雄异体,体内受精,交尾后受精卵被革质膜与黏液聚集一起产出,黏附于基质上,卵袋成簇分布,呈菊花状排列[7-8]。脉红螺作为典型的海洋腹足类,其繁殖行为学知识相对匮乏。目前,仅报道脉红螺繁殖期内亲螺有多次交尾现象[7]以及具有多雄交配现象[9],但其具体交配模式并不清楚;有关于脉红螺性选择方面的研究未见报道。
本研究通过对脉红螺交配行为进行观察及相关形态参数分析,检测脉红螺是否存在性别二态性,确定脉红螺的交配模式和交配前性选择的机制,为脉红螺苗种人工繁育及种质资源保护提供重要的基础资料。
1 材料与方法
1.1 材料
实验用脉红螺亲螺于2012年3月采自日照,共99个,壳高为71~120 mm;置于烟台海益苗业有限公司进行暂养促熟。
1.2 方法
1.2.1 形态参数测量及相关分析 用数显电子游标卡尺测量99个亲螺的壳高、螺旋部高、体螺层高、壳口宽、厣宽和厣高6个形态参数(见图1),精确度为0.01 mm。使用SPSS18.0软件对亲螺的各形态参数进行相关分析,运用逐步回归分析,建立多元回归方程。对雌螺和雄螺的6个形态参数分别进行t检验。

(A.壳高;B.螺旋部高;C.体螺层高;D.壳口宽;E.厣宽;F.厣高;单位为mm。A. Shell height; B. Spire height; C. Body whorl height; D. Aperture width; E. Operculum width; F. Operculum height; Unit:mm.)
图1 脉红螺形态参数测量
Fig.1 The morphologic measurements ofRapanavenosa
1.2.2 交配行为观察及记录 随机选取49个脉红螺亲螺,用防水材料在每一个亲螺的壳上做好编号,以便进行观察记录。亲螺在养殖池中培养(4 m×3 m×1.5 m),养殖水体25 m3,水深是1.2 m,水温21~23 ℃。养殖期间,投喂蛤蜊、扇贝、贻贝等鲜活饵料,每日清底,每日换水2次,每次1/2水体容积,连续充气增氧。在培养过程中,观察交配现象,判断雌雄(雄性有交接突起,雌性无[7]),并记录交配个体、交配时间、产卵时间。对于未发生交配的亲螺,实验结束后解剖通过观察生殖系统判别雌雄(生殖腺位于身体背侧,成熟期精巢淡黄色,卵巢桔黄色,雄性在外套腔右侧有交接突起,雌性有受精囊开口,即产卵孔[7])。
2 结果
2.1 形态参数的相关性及线性相关方程
相关性分析结果显示体螺层高、壳口宽、厣宽、厣高与壳高之间均存在极强相关性(相关系数大于0.88),而螺旋部高仅与壳高有弱相关性(相关系数仅为0.35),与体螺层高、壳口宽、厣宽、厣高之间均无显著相关性(见表1)。对壳高和体螺层高、壳口宽、厣宽、厣高做线性回归分析,以壳高作为自变量,其余参数作为因变量,线性回归方程如下:
Y1=-8.006+0.925X,
Y2=-3.636+0.492X,
Y3=-4.418+0.531X,
Y4=-4.401+0.357X。
式中:X为壳高;Y1为体螺层高;Y2为壳口宽;Y3为厣宽;Y4为厣高。
从线性方程可以看出:体螺层高、壳口宽、厣宽、厣高4个参数均随壳高的增大而增大。

表1 脉红螺各形态参数的相关系数
注:**表示显著相关性。Note:**Represent significant correlation.
①Morphological parameters;②Shell height;③Body whorl height;④Spire height;⑤Aperture width;⑥Operculum width;⑦Operculum height
2.2 性别二态性
对脉红螺(均为5螺层)雌螺(44个)和雄螺(55个)的壳高、螺旋部高、体螺层高、壳口宽、厣宽和厣高6个形态参数进行t检验分析,结果发现脉红螺雌螺和雄螺的形态参数之间差异不显著,(见表2,P>0.05),表明雌螺和雄螺之间无性别二态性现象。
2.3 交配模式
2.3.1 交配过程及持续时间 亲螺入池后2~4d,雌螺和雄螺陆续出现交配现象。交配时雄螺与雌螺壳口呈45°角相对,雄螺交接突起伸入雌螺产卵孔内,将精子送入受精囊(见图2)。在5月15日—6月4日之间的观察发现,脉红螺每次交配持续时间不超过96 h,其中42.6%的交配对在24 h内完成一次交配,41.0%的交配对为24~48 h,14.8%的交配对为48~72 h,1.6%的交配对为72~96 h(见表3)。

表2 脉红螺各形态参数的t检验分析
注:雌性和雄性的6个形态参数均为平均值,单位:mm。Note: six morphological parameters of male and femaleare are average, unit: mm.
①Shell height;②Body whorl height;③Spire height;④Aperture width;⑤Operculum width;⑥Operculum height

图2 脉红螺亲本交配及所产的卵袋

交配持续时间/hMatingduration<2424~4848~7272~96交配对数Copulationpairs262591
2.3.2 交配次数 脉红螺雌螺和雄螺的交配次数均在0~5次之间。雄螺个体中,发生2次交配的比例最高,占37.0%;雌螺个体中发生1~5次交配的个体数所占比例大致相同,有1个个体未发生交配(见表4)。
2.3.3 交配间隔期 脉红螺个体的交配间隔期在2.67~8.80d之间,其中雌螺个体交配的间隔期在2.67~7.20d之间,雄螺个体交配间隔在3.00~8.80d之间。对每2次交配的间隔期进行统计,发生第1次和第2次交配的平均间隔期为5.41d,第2次和第3次的间隔期为4.18d,第3次和第4次交配的平均间隔期为4.31d,第4次和第5次的平均间隔期为3.84d(见表4)。
2.3.4 交配-产卵间隔期 脉红螺交尾之后,雌螺在池壁产出黄色菊花瓣状卵簇,较透明,随着孵化天数增加,卵袋颜色逐渐变为浅灰色,最后变为灰色(见图2)。实验期间观察记录6个雌螺交配直至产卵期间的情况,产卵前的交配次数在1~4次之间,最后交配时间到产卵间隔为3.00~7.00d。统计发现6个雌螺产卵前平均交配2.33次,首次交配至产卵的平均间隔期为11.25d,末次交配至产卵的平均间隔期为5.00d(见表5)。
2.4 交配前性选择标准及交配主动方
2.4.1 交配与否的外部特征选择 对发生交配行为的雄螺(24个)和未发生交配行为的雄螺(3个)进行壳高、体螺层高、螺旋部高、壳口宽、厣宽和厣高6个形态参数比较,未发现显著性差异(P>0.05)。22个雌螺中仅有1个未发生交配行为。结果显示,无论雄螺还是雌螺,都未发现对异性的外部特征进行选择(P>0.05)。

表4 脉红螺所有个体的交配次数及交配间隔
注:以上的间隔天数均为平均数。Note: The above days of copulation interval are average.
①1~2 times interval;②2~3 times interval;③3~4 times interval;④4~5 times interval
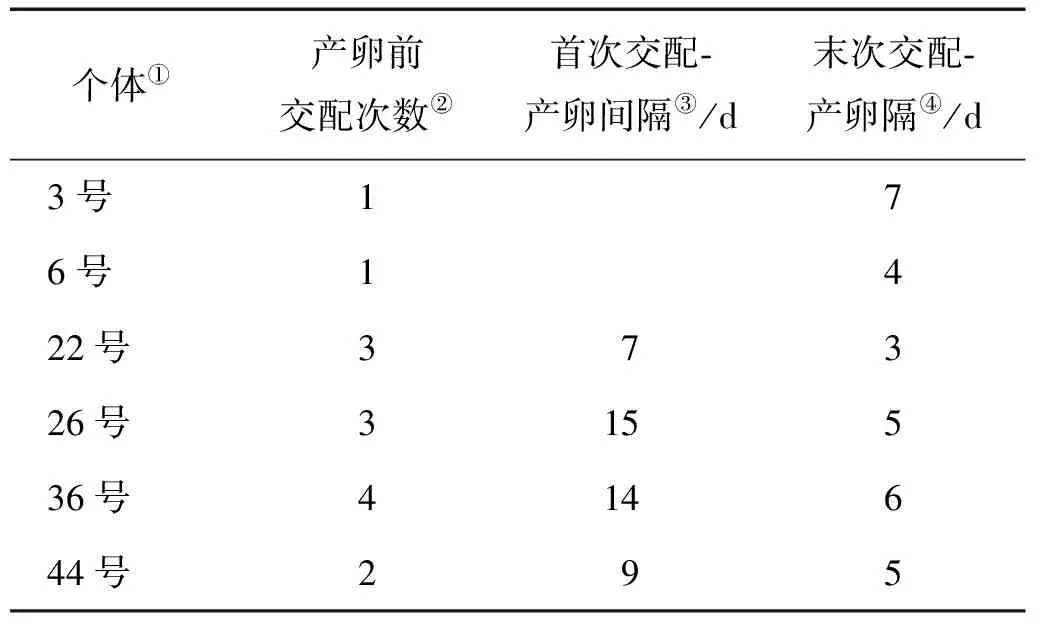
表5 交配次数及产卵间隔
Note: ①Individual;②Copulation times before oviposition;③Premiere copulation-oviferous interval;④Last copulation-oviferous interval
2.4.2 多重交配的外部特征选择 分别比较未发生多重交配(0~1次)和发生多重交配行为(2~5次)的雌螺和雄螺,结果显示未发现雄螺对雌螺在外部形态特征上有选择(P>0.05),也未发现雌螺对雄螺在外部形态特征上有选择(P>0.05)。
3 讨论
本研究通过分析脉红螺的6个形态参数发现,脉红螺的壳高与体螺层高、壳口宽、厣宽、厣高4个参数存在强线性关系,并能做相关线性回归方程,但与螺旋部高的相关性不高;形态参数之间存在显著相关性现象在其他贝类中也有报道,如陆雅凤等[10]在东极厚壳贻贝中研究发现其壳高、壳长、壳宽等10个形态性状之间均达到显著相关,因此可以使用壳高和螺旋部高这2个参数作为检测脉红螺个体大小的标准。
性别二态性是指一些生物体的雌、雄性具有明显不同的性别特征的现象。本研究中分析比较脉红螺雌雄之间的6个形态参数,结果发现雌螺和雄螺的形态参数之间差异不显著,表明脉红螺雌螺和雄螺之间并无性别二态性现象。但在滨螺(Littorinasubrotundata)中,Zahradnik等[5]研究发现雌螺壳高显著高于雄螺壳高,雌雄个体间存在显著的性别二态性现象。
对脉红螺雌雄间交配次数的观察发现,脉红螺雌螺和雄螺个体交配的次数均在0~5次之间,证实脉红螺为多雌多雄的混交模式,其中37.0%的脉红螺雄螺个体发生2次交配。多重交配有利于增加后代数量,还可以增加雌螺繁殖能力,在腹足类中多重交配现象较为普遍,如由蜗(Solenosteiramacrospira)[11]、海水履螺(Crepidulacoquimbensis)[12]、北黄玉黍螺(Littorinaobtusata)[13]、香螺(Neptuneaarthritica)[14]等。有研究表明,每种动物都有自己最适宜的最佳交配次数,并受到能量消耗、被捕食风险等的影响,交配次数太少不利于繁殖成功而次数太多则会减少自身寿命[15-18]。本研究发现脉红螺雄螺大多选择交配2次、雌螺交配1~5次不等的多重交配模式。
本研究中,脉红螺每2次交配的间隔在2.67~8.80d,并且前2次交配的间隔时间最久。在蜻蛉(Calopteryxhaemorrhoidalisasturica)中发现交配时雄螺的刺激能诱导雌螺排出体内储存的其他雄螺的精子[19],因此本研究中脉红螺前2次交配间隔最久可能是雌螺为了防止受到其他交配对象诱导而排出初次交配对象的精子。
脉红螺雌雄个体在交配前未发现对交配对象有形态特征的选择,这与其他腹足类(如瓶螺科的福寿螺(Pomaceacanaliculata)[20]、玉黍螺科的玉黍螺(Littorinalittorea)[4])雄螺以雌螺个体大小作为选择标准不同。
本文通过外部形态测量及交配行为观察,初步探究了脉红螺的交配模式及交配前性选择机制,结果表明,脉红螺交配模式为多重交配的混交模式,交配前雄螺和雌螺均未发现以对方的外部形态作为选择标准,其具体交配机制还有待于继续深入研究。
[1] Darwin C R. The descendent of man, and selection in relation to sex [M]. London: John Murray, 1871.
[2] Rolán-Alvarez E, Caballero A. Estimating sexual selection and sexual isolation effects from mating frequencies [J]. Evolution, 2000, 54: 30-36.
[3] Saur M. Mate discrimination inLittorinalittorea(L.) andL.saxatilis(Olivi) (Mollusca: Prosobranchia) [J]. Hydrobiologia, 1990, 193: 261-270.
[4] Erlandsson J, Johannesson K. Sexual selection on female size in a marine snail,Littorinalittorea(L.) [J]. J Exp Mar Biol Ecol, 1994, 181: 145-157.
[5] Zahradnik T D, Lemay M A, Boulding E G. Choosy males in a Littorinid gastropod: maleLittorinasubrotundataprefer lager and virgin female [J]. J Mollus Stud, 2008, 74: 245-251.
[6] 齐钟彦. 中国经济软体动物 [M]. 北京: 中国农业出版社, 1988: 260-261.
[7] 魏利平, 邱盛尧, 王宝钢, 等. 脉红螺繁殖生物学的研究 [J]. 水产学报, 1999, 23: 150-155.
[8] 潘洋, 邱天龙, 张涛, 等. 脉红螺早期发育的形态观察 [J]. 水产学报, 2013, 10: 1503-1512.
[9] Xue D X, Zhang T, Liu J X. Microsatellite evidence for high frequency of multiple paternity in the marine gastropodRapanavenosa[J]. Plos One, 2014, 9: e86508.
[10] 陆雅凤, 赵晟, 徐梅英, 等. 东极厚壳贻贝养殖群体表型性状的相关与通径分析 [J]. 安徽农业科学, 2015, 43: 147-150.
[11] Kamel S J, Grosberg R K. Exclusive male care despite extreme female promiscuity and low paternity in a marine snail [J]. Ecol Lett, 2012, 15: 1167-1173.
[12] Brante A, Fernández M, Viard F. Microsatellite evidence for sperm storage and multiple paternity in the marine gastropodCrepidulacoquimbensis[J]. J Exp Mar Biol Ecol, 2011, 396: 83-88.
[13] Paterson I G, Partridge V, Buckland-nick J. Multiple paternity inLittorinaobtusata(Gastropoda, Littorinidae) revealed by microsatellite analyses [J]. Biol Bull, 2001, 6: 261-267.
[14] Lombardo R C, Takeshita F, Abe S, et al. Mate choice by males and paternity distribution in offspring of triple-mated females inNeptuneaarthritica(Gastropoda: Buccinidae) [J]. J Molluscan Stud, 2012, 78: 283-289.
[15] Arnovist G, Nilsson T. The evolution of polyandry: multiple mating and female fitness in insects [J]. Animl Behav, 2000, 60: 145-164.
[16] Partridge L, Farquhar M. Sexual activity reduces life span of male fruitflies [J]. Nature, 1981, 294: 580-582.
[17] Fowler K, Partridge L. A cost of mating in female fruitflies [J]. Nature, 1989, 338: 760-761.
[18] Chapman T, Miyatake T, Smith H K, et al. Interactions of mating, egg production and death rates in females of the mediterranean fruit fly,Ceratitiscapitata[J]. Proc R Soc Lond B, 1998, 265: 1879-1894.
[19] Aguilar A C. Male copulatory sensory stimulation induces female ejection of rival sperm in a damselfly [J]. Proc R Soc Lond B, 1999, 266: 779-784.
[20] 董朝莉. 福寿螺配偶个体大小选择性初步观察 [J]. 广西植保, 2006, 19: 4-6.
责任编辑 朱宝象
A Preliminary Study on the Mating Mode and Sexual Choice Before Copulation ofRapanavenosa
SUN Xiao-Qi, YU Hong, YU Rui-Hai, LI Qi
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
In order to explore the mating pattern and the mechanism of sexual selection before copulation inRapanavenosa, six morphological parameters of 99 adultR.venosawere firstly measured and the correlation of six morphological parameters were investigated. The results showed that aperture width, body whorl height, operculum width and operculum height were significantly and positively correlated with shell height, but not spire height. Spire height showed a weak correlation with shell height. Moreover,R.venosashowed no sexual dimorphism in the six morphological parameters.R.venosabegan to mate in two to four days after being put into the rearing pond and the copulation beha-vior was recorded. The duration each mating was within 96 hours and 83.6% of the mating couples finished copulation within 48 hours. The times of mating ofR.venosaranged from zero to five and ma-ting intervals ranged from 2.67 to 8.80 days. All in all,R.venosadisplayed a promiscuous mating behavior.
Rapanavenosa; mating pattern; sexual selection; sexual dimorphism; morphological parameters
国家自然科学基金项目(31201998);国家科技支撑计划项目(2011BAD13B01);国家海洋公益性行业科研专项(201305005)资助
2014-07-10;
2014-12-24
孙晓琪(1987-),女, 硕士生, 从事水产动物遗传育种学研究。 E-mail: 89717770@qq.com
❋❋ 通讯作者: E-mail:hongyu@ouc.edu.cn
S917.4
A
1672-5174(2015)08-026-06
10.16441/j.cnki.hdxb.20140234

