猪带绦虫重组双歧杆菌疫苗不同保存条件下的稳定性研究
周必英,刘美辰,杨凤娇
猪带绦虫重组双歧杆菌疫苗不同保存条件下的稳定性研究
周必英,刘美辰,杨凤娇
目的 研究猪带绦虫TSO45W-4B基因、TSOL18基因和TSO45W-4B-TSOL18融合基因的重组双歧杆菌(Bb)疫苗在不同保存条件下的稳定性。方法 分别将猪带绦虫重组质粒pGEX-TSO45W-4B、pGEX-TSOL18和pGEX-TSO45W-4B-TSOL18电转入长双歧杆菌(B.longum),获得阳性菌株pGEX-TSO45W-4B/B.longum、pGEX-TSOL18/B.longum和pGEX-TSO45W-4B-TSOL18/B.longum,分别置于不同条件下保存,取出菌液,抽提质粒,电泳检测,进行稳定性分析。结果 阳性菌株pGEX-TSO45W-4B/B.longum、pGEX-TSOL18/B.longum和pGEX-TSO45W-4B-TSOL18/B.longum分别在常温下、4 ℃、-20 ℃、-80 ℃、-196 ℃(液氮中)分别保存48 h、1周、1月、2月,抽提质粒,电泳发现阳性菌株pGEX-TSO45W-4B/B.longum、pGEX-TSOL18/B.longum和pGEX-TSO45W-4B-TSOL18/B.longum在液氮中、-80 ℃、-20 ℃中比较稳定,而在普通的室温环境下,很快发生质粒丢失现象。结论 猪带绦虫TSO45W-4B基因、TSOL18基因和TSO45W-4B-TSOL18融合基因的重组Bb疫苗低温保存最稳定,常温最差,这为猪带绦虫重组Bb疫苗的进一步研究奠定了基础。
猪带绦虫;重组双歧杆菌疫苗;保存;稳定性
Supported by the National Natural Science Foundation of China (No. 81160206), the Grant program of Education Department of Guizhou Province (No. 2010040), and the Dr. Start-up Fund of Zunyi Medical College (No. ZMKD2013-016)
猪囊尾蚴病是由猪带绦虫(Taeniasolium) 的中绦期幼虫猪囊尾蚴寄生于人或猪等引起的一种严重危害人类健康和畜牧业生产的人兽共患寄生虫病。我国是高发国家之一,猪囊尾蚴可寄生于人体皮下、肌肉、脑、眼等不同部位,其中脑囊虫病致残率、致死率均较高。该病防治存在化学药物的残留和抗药性问题,随着分子生物学技术的发展,研制疫苗防治该病已成为当前研究的热点[1-4]。TSO45W-4B和TSOL18是猪带绦虫六钩蚴阶段特异性表达抗原,具有良好的免疫原性和免疫保护性,是理想的猪带绦虫疫苗候选抗原[5-7]。重组活载体疫苗是指将编码外源性抗原的基因引入特定的疫苗载体,构建成能表达相应抗原而且传递至宿主免疫系统引起相应免疫应答的疫苗。双歧杆菌(Bifidobacterium,Bb)是人和哺乳动物肠道重要的益生菌,具有抗菌、抑瘤、免疫调节和营养等多种生理作用。近年来,随着基因工程技术的发展,选择具有益生功能的Bb作为载体传递系统,已在细菌、病毒、寄生虫、肿瘤等领域构建了一系列重组双歧杆菌[8]。而在猪带绦虫重组双歧杆菌疫苗稳定性研究方面,尚未见相关报道,因此,本研究拟分别使用猪带绦虫重组质粒pGEX-TSO45W-4B、pGEX-TSOL18和pGEX-TSO45W-4B-TSOL18电穿孔转化长双歧杆菌Bifidobacterialongum(B.longum),将获得的阳性菌株分别放置不同温度不同时间后,取出保存的菌液,抽提质粒,电泳鉴定,检测菌株质粒是否丢失,从而判断其稳定性。
1 材料与方法
1.1 质粒和菌种 猪带绦虫重组质粒pGEX-TSO45W-4B、pGEX-TSOL18和pGEX-TSO45W-4B-TSOL18由本课题组构建保存[9-11];长双歧杆菌(B.longum)购自美国菌种典藏中心。
1.2 主要试剂和仪器 质粒小量抽提试剂盒购自美国Axygen公司;MRS培养基购自美国Difico公司;其余试剂均为国产分析纯。核酸电泳装置购自北京六一仪器厂;PCR 仪购自美国 MJ-Research公司;厌氧发生器购自法国梅里埃公司。
1.3 重组质粒电转化B.longum分别将重组质粒pGEX-TSO45W-4B、pGEX-TSOL18和pGEX-TSO45W-4B-TSOL181μg与B.longum感受态细菌100 μL混匀,冰浴10~15 min后转移至1 mm的电击杯中,电击参数设置为:电压1.25 kV、场强12.5 kV/cm、电容25 μF、电阻200 Ω、转化时间5 ms;电击完毕后立即将混合液转入到900 μL MRS液体培养基的EP管中,37 ℃厌氧培养2 h;将菌液涂布于含100 μg/mL氨苄青霉素的MRS琼脂平板上,37 ℃厌氧培养24~72 h。
1.4 阳性菌株的PCR鉴定 挑取上述平板中单个菌落至1 mL含100 μg/mL氨苄青霉素的MRS液体培养基的EP管中,37 ℃厌氧培养24~72 h;将菌液4 ℃ 10 000 r/min离心5 min,弃上清,沉淀中加入250 μL 25%蔗糖溶液重溶菌体沉淀,37 ℃温浴30 min,期间每隔5 min振荡1次,使其充分反应;抽提质粒为模板,进行PCR鉴定。依据插入基因两端载体上的序列设计引物如下:上游引物为P1(5′-TGGCGACCATCCTCCAAAATC-3′),下游引物为P2(5′-TTCACCGTCATCACCGAAACG-3′);PCR反应体系:上、下游引物各 1 μL,抽提的质粒为模板 5 μL,10×PCR Buffer 5 μL,dNTP Mixture 4μL,MgCl24 μL,TaqDNA Polymerase 0.5 μL,ddH2O 29.5 μL;PCR反应条件:94 ℃预变性1 min,94 ℃变性30 s,50 ℃退火35 s,72 ℃延伸40 s,循环扩增30次,最后72 ℃延伸5 min。PCR产物用1%琼脂糖凝胶电泳鉴定。
1.5 阳性菌株不同保存条件下的稳定性 将上述鉴定的阳性菌株分别置于常温下、4 ℃、-20 ℃、-80 ℃、-196 ℃(液氮中)保存,分别在48 h、1周、1月、2月后取出保存的菌液,抽提质粒,电泳鉴定。
2 结 果
2.1 阳性菌株的PCR鉴定 分别以从具有氨苄青霉素抗性的B.longum中抽提的重组质粒pGEX-TSO45W-4B、pGEX-TSOL18和pGEX-TSO45W-4B-TSOL18为模板,P1、P2为引物进行PCR扩增可得到450 bp、492 bp和888 bp的基因片段,除去载体序列99 bp,TSO45W-4B基因、TSOL18基因和TSO45W-4B-TSOL18融合基因实际的长度分别为351 bp、393 bp和789 bp,与预期结果相符,图1(A~C)。
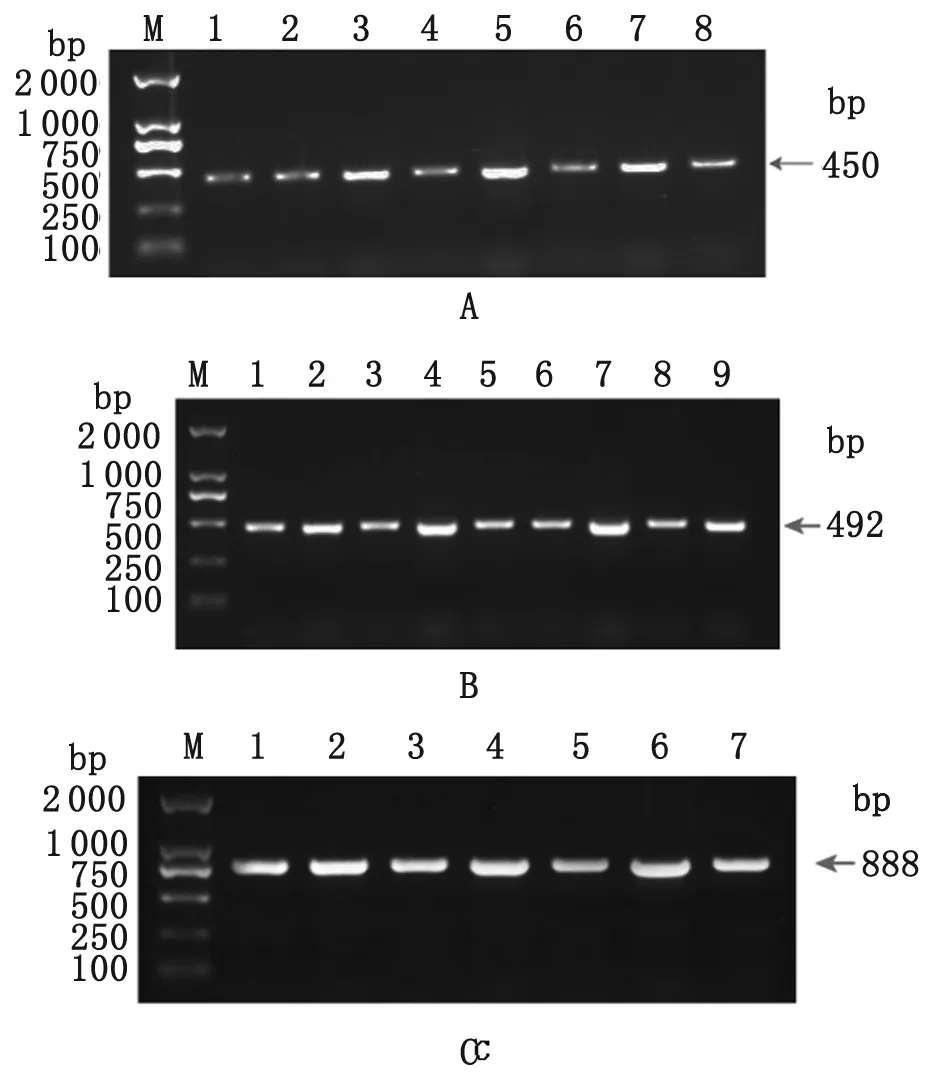
M: Marker; A1-8: PCR product of the recombinant plasmid pGEX-TSO45W-4B inB.longum; B1-9: PCR product of the recombinant plasmid pGEX-TSOL18 inB.longum; C1-7: PCR product of the recombinant plasmid pGEX-TSO45W-4B-TSOL18 inB.longum.
图1 猪带绦虫重组双歧杆菌疫苗(A-C)的PCR鉴定
Fig.1 Identification of PCR of the recombinantBifidobacteriumvaccine ofTaeniasolium(A-C)
2.2 阳性菌株不同保存条件下的稳定性 取出不同保存条件下的菌液,抽提质粒,电泳发现菌株在液氮中、-80 ℃、-20 ℃中比较稳定,保存2个月也未发现质粒丢失,而在普通的室温环境下,在保存1个月后就开始出现质粒丢失现象,图2(A~E)。

(A) M:Marker;1~8:The plasmid pGEX-TSO45W-4B inB.longum;9~17:The plasmid pGEX-TSOL18 inB.longum;18~24:The plasmid pGEX-TSO45W-4B-TSOL18 inB.longum. (B~E) M:Marker;1~5:The plasmid pGEX-TSO45W-4B inB.longumat RT,4 ℃,-20 ℃,-80 ℃,-196 ℃;6~10:The plasmid pGEX-TSOL18 inB.longumat RT,4 ℃,-20 ℃,-80 ℃,-196 ℃;11~15:The plasmid pGEX-TSO45W-4B-TSOL18 inB.longumat RT,4 ℃,-20 ℃,-80 ℃,-196 ℃.
图2 猪带绦虫重组双歧杆菌疫苗不同保存条件下的稳定性(A~E)
Fig.2 Stability of recombinantBifidobacteriumvaccineofTaeniasoliumunder different preservation conditions(A~E)
3 讨 论
重组Bb疫苗是一种新型疫苗,具有许多优点:所表达的靶抗原不需纯化,可直接用于免疫接种,免去了蛋白质后处理的复杂工序;单次接种即可诱导机体产生针对靶抗原的免疫反应;运用分子生物学手段,通过对不同靶抗原的剪切和拼接,可使新型疫苗理想化;可定殖肠道,发挥益生菌和外源基因双重功能,达到一剂多用的目的;可作为食品添加剂,制作出风味可口的酸奶品牌,极具开发价值;对抗生素非常敏感,小剂量即可杀灭该菌。因此,构建猪带绦虫的重组Bb疫苗,可能是预防和控制猪囊尾蚴病较为安全、有效的一种新型疫苗, 具有广泛的应用前景。然而,疫苗的稳定性是考核疫苗质量的关键,直接关系到疫苗的质量及生产成本。疫苗稳定性研究的目的是为证明疫苗产品在某种保存条件下,保存某一段时间后仍然具备可接受的质量、有效性和安全性提供科学依据[12-13]。为此,有必要对重组Bb疫苗进行稳定性观察。
本研究分别将猪带绦虫重组质粒pGEX-TSO45W-4B、pGEX-TSOL18和pGEX-TSO45W-4B-TSOL18电穿孔转化B.longum,将获得的阳性菌株pGEX-TSO45W-4B/B.longum、pGEX-TSOL18/B.longum和pGEX-TSO45W-4B-TSOL18/B.longum分别放置不同温度不同时间后,取出保存的菌液,抽提质粒,电泳鉴定,对菌株的稳定性进行了试验研究。结果表明,阳性菌株pGEX-TSO45W-4B/B.longum、pGEX-TSOL18/B.longum和pGEX-TSO45W-4B-TSOL18/B.longum在常温下、4 ℃、-20 ℃、-80 ℃、-196℃(液氮中)保存48 h、1周、1月、2月,菌株稳定性不一致,在液氮中、-80 ℃、-20 ℃中比较稳定,保存2个月也未发现质粒丢失,而在普通的室温环境下,在保存1个月后就开始出现质粒丢失现象,表明本研究构建的猪带绦虫重组Bb疫苗低温保存能较好保留其遗传稳定性。就不同保存条件下对猪带绦虫重组Bb疫苗的基因表达及免疫效力有无影响还有待进一步研究。
[1]Ito A, Urbani C,Jiamin Q, et al. Control of echinococcosis and cysticercosis: a public health challenge to international cooperation in China[J]. Acta Tropica, 2003, 86(1): 3-17.
[2]Xu AJ, Gu JC. The current situation and the prevalent trend of cysticercosis in China[J]. Chin Trop Med, 2010, 10(2): 239-240. (in Chinese) 徐安健,谷俊朝.中国囊虫病现状分析及流行趋势[J].中国热带医学,2010,10(2):239-240.
[3]Yang YJ, Zhen TM, Kong QA. Advanced on the study of medication for cysticercosis[J]. Chin J Pathogen Biol, 2008, 3(9): 704-707. (in Chinese) 杨艳君,甄天民,孔庆安.囊虫病的药物治疗研究进展[J].中国病原生物学杂志,2008,3(9):704-707.
[4]Liu MC, He LF, Zhou BY. Research progress on genetic engineering vaccines ofTaeniasolium[J].Chin J Endemiol, 2014, 33(2): 233-236. (in Chinese) 刘美辰,贺莉芳,周必英.猪带绦虫基因工程疫苗研究进展[J].中华地方病学杂志,2014,33(2):233-236.
[5]Luo XN, Zheng YD, Hou JL, et al. Protection against AsiaticTaeniasoliuminduced by a recombinant 45W-4B protein[J]. Clin Vaccine Immunol, 2009, 16(2): 230-232.
[6]Ding J, Zheng Y, Wang Y, et al. Immune responses to a recombinant attenuatedSalmonellatyphimuriumstrain expressing aTaeniasoliumoncosphere antigen TSOL18[J]. Comp Immunol Microbiol Infect Dis, 2013, 36(1): 17-23.
[7]Zhou BY. Research progress on recombinant antigens ofTaeniasolium[J]. Chin J Zoonoses, 2014, 30(4): 418-422. (in Chinese) 周必英.猪带绦虫重组抗原研究进展[J].中国人兽共患病学报,2014,30(4):418-422.
[8]Liu MC, He LF, Zhou BY, et al. Advances in the study of recombinantBifidobacterium[J].Chin J Pathogen Biol, 2014, 9(5): 470-472. (in Chinese) 刘美辰,贺莉芳,周必英.重组双歧杆菌研究进展[J].中国病原生物学杂志,2014,9(5):470-472.
[9]Zhou BY, Zhou L, Liu MC, et al. Expression, purification and preparation of rabbit antiserum of the gene TSOL18 ofTaeniasolium[J]. Chin J Zoonoses, 2013, 29(10): 977-980, 985. (in Chinese) 周必英,周泠,刘美辰,等.猪带绦虫TSOL18基因的表达、纯化和兔抗血清的制备[J].中国人兽共患病学报,2013,29(10):977-980,985.
[10]Zhou BY, Zhou L, Liu MC, et al. Expression and purification of a fusion gene TSO45W-4B-TSOL18 ofTaeniasoliuminEscherichiacoliArctic Express(DE3)and preparation of rabbit antiserum[J]. Chin J Endemiol, 2013, 32(6): 619-624. (in Chinese) 周必英,周泠,刘美辰,等.猪带绦虫TSO45W-4B-TSOL18融合基因在大肠埃希菌ArcticExpress(DE3)中的表达、纯化和兔抗血清的制备[J].中华地方病学杂志,2013,32(6):619-624.
[11]Zhou BY, Zhou L, Liu MC, et al. Cloning, expression of TSO45W-4B gene fromTaeniasoliumand preparation of its polyclonal antibody[J]. Chin J Parasitol Parasit Dis, 2013, 31(5): 372-375. (in Chinese) 周必英,周泠,刘美辰,等.猪带绦虫TSO45W-4B基因的克隆、表达和抗体制备[J].中国寄生虫学与寄生虫病杂志,2013,31(5):372-275.
[12]Zhang C, Jiang DC, Huang ZL, et al. Some thoughts on main technical issues arising from vaccine stability study in China[J]. Chin Pharmaceutical Affairs, 2009, 23(4): 349-351. (in Chinese) 张弛,姜典才,黄志禄,等.对我国疫苗稳定性研究主要技术问题的思考[J].中国药事,2009,23(4):349-351.
[13]Tang YD, Gu ZX, Liu Y, et al. Observation on the stability of the genetic engineering bacteria used to production of the vaccine against swine cysticercosis[J]. Chin J Zoonoses, 2000, 16(3): 66-67. (in Chinese) 唐雨德,顾志香,刘玉,等.猪囊虫病疫苗生产用工程菌菌种的稳定性观察[J].中国人兽共患病杂志,2000,16(3):66-67.
Stability of recombinantBifidobacteriumvaccine ofTaeniasoliumunder different preservation conditions
ZHOU Bi-ying,LIU Mei-chen,YANG Feng-jiao
(DepartmentofParasitology,ZunyiMedicalCollege,Zunyi563003,China)
We studied the stability of the recombinantBifidobacterium(Bb) vaccine ofTaeniasoliumTSO45W-4B gene, TSOL18 gene or TSO45W-4B-TSOL18 fusion gene under different preservation conditions. The recombinant plasmid pGEX-TSO45W-4B, pGEX-TSOL18 or pGEX-TSO45W-4B-TSOL18 ofTaeniasoliumwas transformed intoBifidobacteriumlongum(B.longum) to obtain positive strains pGEX-TSO45W-4B/B.longum, pGEX-TSOL18/B.longumor pGEX-TSO45W-4B-TSOL18/B.longum. At different preservation conditions, the stability of the positive strains was confirmed by electrophoresis of the extracted recombinant plasmid. The positive strains were preserved and the stability of the positive strains was confirmed. With the condition of preservation at room temperature (RT), 4 ℃, -20 ℃, -80 ℃, -196 ℃ (in liquid nitrogen) and for 48 hrs, one week, one month, two months, respectively, the plasmid electrophoresis demonstrated that the positive strains were more stable at -196 ℃, -80 ℃, and -20 ℃ while the plasmid disappeared at RT. It’s indicated that the recombinant Bb vaccine ofTaeniasoliumTSO45W-4B gene, TSOL18 gene or TSO45W-4B-TSOL18 fusion gene were more stable at lower preserved temperature, which laid the foundation for the further study of the recombinant Bb vaccine ofTaeniasolium.
Taeniasolium; recombinantBifidobacteriumvaccine; preservation; stability
国家自然科学基金(81160206);贵州省教育厅资助项目(黔教科2010040);遵义医学院博士启动基金(ZMKD2013-016)
遵义医学院寄生虫学教研室, 遵义 563003; Email:zbyzl01@126.com
10.3969/cjz.j.issn.1002-2694.2015.07.011
R383.3
A
1002-2694(2015)07-0645-04
2014-07-18;
2015-03-25

