中国弓形虫分离株基因型及致病性的研究进展
付晓莹,冯永杰,梁宏德,杨玉荣
中国弓形虫分离株基因型及致病性的研究进展
付晓莹,冯永杰,梁宏德,杨玉荣
弓形虫(Toxoplasmagondii)是一种广泛寄生于人和恒温动物体内的原虫,有着复杂的生活史和致病机制。近年来关于弓形虫种群结构的研究表明其具有遗传多样性和地域差异性。目前,已从全球分离到1 457个弓形虫虫株,确定了189个基因型(http://ToxoDB.org),其中南美的基因型具有高度的遗传多样性,关于我国流行的弓形虫虫株基因型及致病性的研究尚十分有限。本文总结了我国弓形虫分离虫株的基因型及特点,以期为深入研究中国弓形虫种群结构、流行病学及致病机制提供有力依据。
弓形虫;基因型;致病性;PCR-限制性片段长度多态性
刚地弓形虫(Toxoplasmagondii)是一种呈世界性分布的细胞内寄生原虫,可感染包括人类在内的几乎所有恒温动物,引起弓形虫病[1]。据估计,全世界约有1/3的人感染弓形虫,其中北美的感染率约为16%~40%,而在欧洲和南美感染率高达50%~80%,中国人群弓形虫血清抗体平均阳性率为7.9%[2]。健康人群感染弓形虫后主要表现为无症状的隐性感染,但对免疫功能低下及免疫缺陷者(如恶性肿瘤、AIDS及器官移植患者),则可引起死亡[3]。孕妇、怀孕母畜(山羊、绵羊)感染弓形虫,可引起出生缺陷、死胎或流产。
弓形虫属顶复门,球虫纲,球虫目,肉孢子虫科,弓形虫属,弓形虫种,但弓形虫与其它肉孢子虫不同,肉孢子虫大多具有严格的宿主选择性,而弓形虫宿主范围广泛。弓形虫生活史发育过程需要两个宿主,猫科动物为终末宿主,弓形虫对中间宿主的选择极不严格,无论哺乳类、鸟类、人和猫科动物都可作为中间宿主。弓形虫对组织器官的选择也不严格,除成熟的红细胞之外,任何有核细胞都可侵犯。中间宿主可以通过三种途径感染弓形虫:摄入含有包囊的生的或未煮熟的肉类、食入被卵囊污染的食物或饮水、母婴垂直传播[4]。
1 世界弓形虫基因型特点
刚地弓形虫的基因型有着高度的地域差异性和遗传多态性[5]。目前,关于如何确定弓形虫基因型,尚无确定标准。传统的弓形虫基因分类有:I、II、III型以及非典型基因型。I型虫株对远交小鼠和免疫抑制患者有很强的致病性,而II、III型的致病性较弱[6]。目前,广泛接受的是用ToxoDB PCR限制性片段长度多态性分析(PCR-RFLP)方法确定弓形虫基因型。弓形虫非典型基因型包括12型、BrI、BrII、BrIII、Africa 1、中国1型等。Africa 1和Africa 3是出现在非洲的主要基因型[7-8]。而南美洲虽以III型和ToxoDB#7型多见,但其基因型显示出高度的遗传多态性,而且这些虫株的基因序列很独特,是由不同系构成且在种群之间显示出很强的差异性[9],造成免疫抑制病人严重弓形虫病的虫株大都是来自南美的非典型基因型。这些不同的基因序列表明了刚地弓形虫在北美和欧洲大都通过无性繁殖来传播,而在南美则多为有性结合。Su[10]在2012年对全球956株弓形虫基因型进行了鉴定及分析,通过PCR-RFLP、微卫星分型及多重酶切电泳分析(MLEE)这三种方法鉴定出138种基因型,从而表明世界弓形虫的种群结构包括了丰富的种系以及不同虫株的杂交系。目前,已从1 457个弓形虫分离株,确定189个基因型(http://ToxoDB.org)。
2 我国弓形虫虫株基因分型结果
中国地处于亚欧大陆东部,太平洋西岸,南北跨纬度约50°。由于大部分地区处于温带,气候潮湿,因此生物多样性较为丰富。中国居住着56个民族,部分人群有吃生肉的生活习惯,增加了弓形虫感染的几率[11]。我国动物源性弓形虫遗传特点的报道结果显示,ToxoDB#9为中国大陆的优势基因型[12-13],这种基因型的虫株在越南、斯里兰卡、巴西、哥伦比亚等国家亦有发现[14-17],且这种基因型不同于北美和欧洲弓形虫虫株。不过,有关来自中国动物的弓形虫基因型及致病性研究报道仍很少,尤其是野生动物。从人体分离到7株弓形虫。本文归纳了从18个省、直辖市、自治区分离的154株弓形虫,共揭示了14个基因型,流行我国的弓形虫虫株具有有限的遗传多态性(表1)。
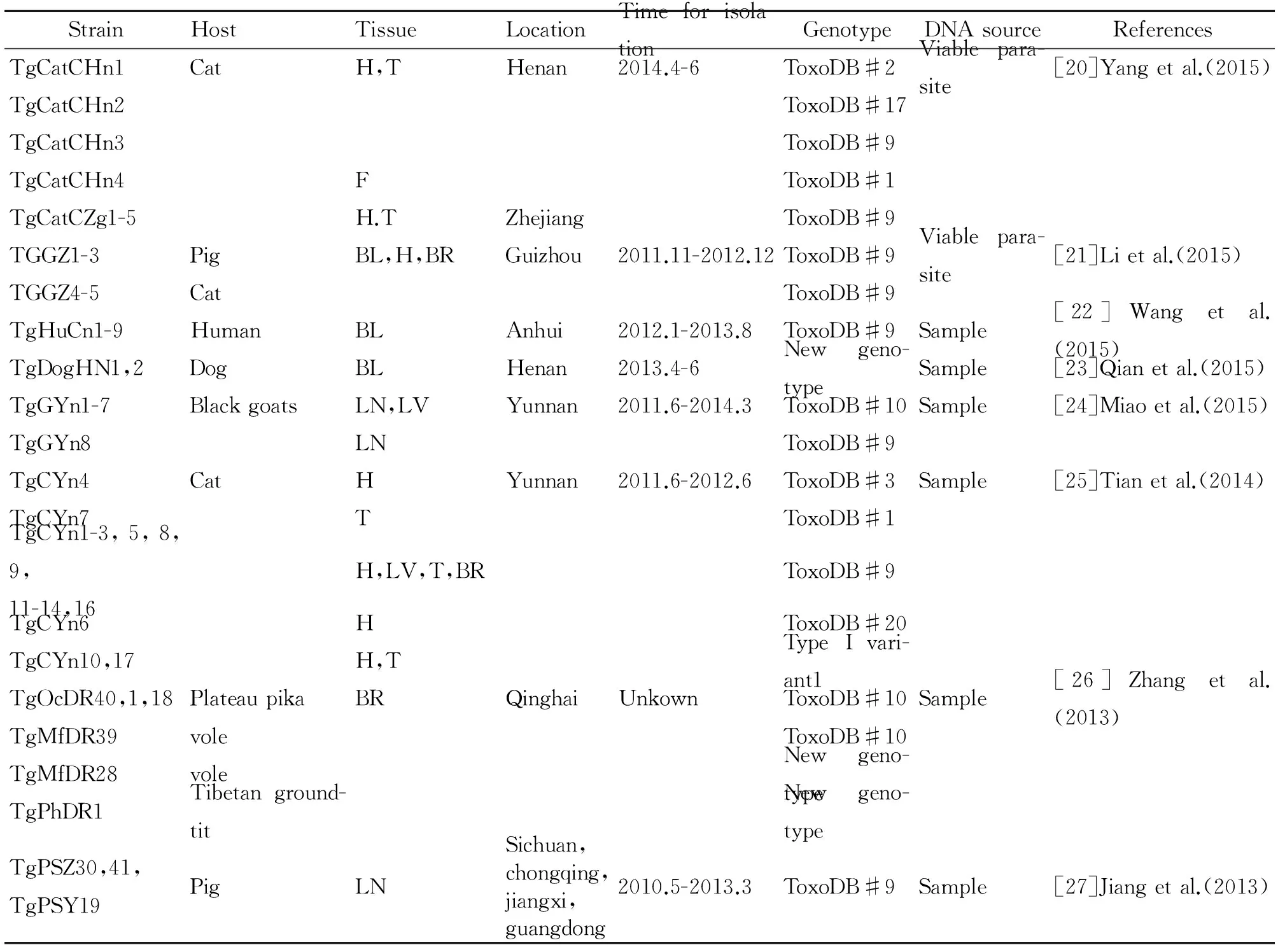
表1 流行我国的弓形虫虫株基因分型结果

表1(续)
Note: H: Heart; T: Tongue; BR: Brain; F: Feces; BL: Blood; LN: Lymph nodes; LU: Lung; LV: Liver; M: Muscle.
3 中国弓形虫虫株基因型特点及致病性研究
3.1 中国弓形虫虫株基因型特点 归纳的154株虫株中有93株是分离的活虫虫株鉴定出来的(表2)。在这93株分离到的人及动物源性弓形虫中,62株(66.67%)属于ToxoDB#9型谱系,基因型ToxoDB#9在SAG2,GRA6,L358,PK1,c22-8 位点为 II 型图谱,在c29-2,SAG3 和BTUB位点显示为 III 型图谱,而在Apico 位点则为 I 型图谱。且ToxoDB#9型大都分布在中国中部和南部地区,并且在猫、猪和弓形虫病人中均有过报道[12-13,18],除了人、猫、猪以外,这型虫株还分离于野鼠中。目前国内有关野生动物感染弓形虫的报道甚少,啮齿类和某些小动物是弓形虫重要的中间宿主,因为它们可能是食肉动物感染弓形虫潜在的来源。总之,关于野生动物感染弓形虫的研究非常重要,野生动物传播弓形虫的机制还不十分清楚。可以说明ToxoDB#9型是广泛流行于中国大陆的优势基因型。在剩下的31株弓形虫中,12株(12.90%)属于ToxoDB#3,这型虫株也是从人、猫、猪中分离的,除此以外,ToxoDB #3也在青海绵羊、新疆维吾尔自治区的鸟类[19]、甘肃兰州麻雀中鉴定得到,这说明了ToxoDB #3也是中国大陆流行的主要虫株之一。ToxoDB #3还在哥伦比亚、斯里兰卡、越南和美国这些国家鉴定得到,这也说明了它在亚洲、北美和南美也普遍流行。
在我国分离的弓形虫虫株中,强致病性的虫株(ToxoDB#10)有2株,占2.15%,分离于人和猫。其余的91株弓形虫都为弱毒株,猫和猪、人感染居多,且呈隐性感染。
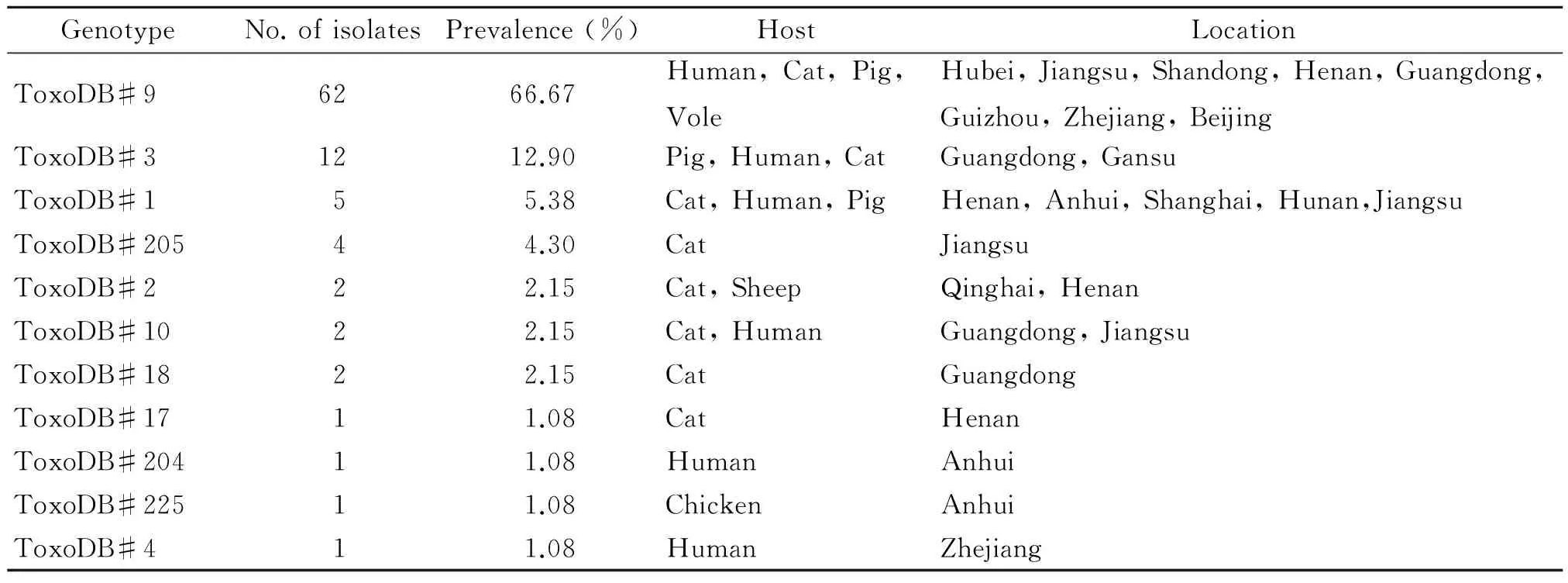
表2 我国分离到的93株弓形虫特点
在整合的这11个中国分离的弓形虫基因型中,有3个基因型是首次报道,但在弓形虫基因型数据库上(http://ToxoDB.org)未有记录,ToxoDB#204,ToxoDB#205,ToxoDB#225。ToxoDB#204在SAG1位点显示为独一无二的谱系μ-2,余下9个位点和Type II型酶切图谱相同;ToxoDB#205在SAG3和L358位点显示为I型图谱,其余8个位点为II型图谱,它可能来源于中国家养动物中I型和II型的有性结合;ToxoDB#225在SAG3位点显示III图谱,其余位点显示I型图谱。这3个基因型提示流行我国的弓形虫虫株之间存在着有性重组,有性重组会产生一种新的基因型而且可能改变它原有的生物学特点,如增强了对小鼠甚至人的致病性等[33]。ToxoDB#17(也被称为Type BrIV)之前在南美报道过,但是首次从中国猫体内分离出来[22]。
3.2 中国弓形虫株的致病性 按照传统的弓形虫基因型分类:Type I 型虫株为强毒株(LD100=1 parasite),Type II型和Type III型虫株为弱毒株(LD100>=1000 parasites)。目前,对于来源于国内的弓形虫株其遗传特点和毒力之间的关系还知之甚少。王林[34]采用来自于4个省市15株ToxoDB#9型弓形虫速殖子(1×103)腹腔感染昆明鼠,死亡率从10%-100%不等,弓形虫TgCtwh6、TgCtsd2、TgCtsd3速殖子(1×103)感染小鼠后只出现一过性反应,这说明ToxoDB#9型不同虫株对小鼠的致病性不同。另外,王林还观察了TgCtwh6在小鼠体内的动态分布,结果表明血液中虫体能持续至第35天,在此期间虫体可传播至体内其他组织器官以及通过胎盘传播给发育中的胎儿,造成严重的弓形虫病。不同基因型弓形虫在小鼠体内散播的规律以及对小鼠的致病性将会为弓形虫致病机制及毒力的研究奠定基础,但目前关于我国弓形虫分离株研究甚少,因此需要我们做更多的努力。
4 讨 论
近年来,世界各地人和动物体内分离的弓形虫基因型越来越多,具有丰富的遗传多态性。已知I和II型在全球广泛分布,为欧洲和北美、非洲的优势基因型;而南美洲分离虫株基因型显示出高度的遗传多态性。然而对于我国流行的弓形虫虫株基因型方面的研究尚十分欠缺,不足以查明流行我国的弓形虫的传播、进化规律、生物学特征及其致病特点。本文整合了我国人及动物源性弓形虫分离虫株的基因型鉴定结果及代表性虫株对小鼠的毒力研究进展,以期为我国弓形虫虫株的种群进化、致病机制、疫苗研发及弓形虫病的诊断提供依据。
[1]Dubey JP. Toxoplasmosis of animals and humans[M]. 2nded. Boca Raton: CRC Press, 2010: 313.
[2]Zhou P, Chen N, Zhang RL, et al. Food-borne parasitic zoonoses in China: perspective for control[J]. Trends in Parasitol, 2008, 24: 190-196. DOI: 10.1016/j.pt.2008.01.001
[3]Dubey JP, Jones JL.Toxoplasmagondiiinfection in humans and animals in the United States[J]. Int J Parasitol, 2008, 38: 1257-1278. DOI: 10.1016/j.ijpara.2008.03.007
[4]Montoya JG, Liesenfeld O. Toxoplasmosis[J]. Lancet, 2004, 363: 1965-1976. DOI: 10.1016/S0140-6736(04)16412-X
[5]Lehmann T, Marcet PL, Graham DH, et al. Globalization and the population structure ofToxoplasmagondii[J]. Proc Natl Acad Sci U S A, 2006, 103: 11423-11428. DOI: 10.1073/pnas.0601438103
[6]Howe DK, Sibley LD.Toxoplasmagondiicomprises three clonal lineages: correlation of parasite genotype with human disease[J]. J Infect Dis, 1995, 172: 1561-1566. DOI: 10.1093/infdis/172.6.1561
[7]Velmurugan GV, Dubey JP, Su C. Genotyping studies ofToxoplasmagondiiisolates from Africa revealed that the archetypal clonal lineages predominate as in North America and Europe[J]. Vet Parasitol, 2008, 155: 314-318. DOI:10.1016/j.vetpar.2008.04.021
[8]Mercier A, Devillard S, Ngoubangoye B, et al. Additional haplogroups ofToxoplasmagondiiout of Africa: population structure and mouse-virulence of strains from Gabon[J]. PLoS Negl Trop Dis, 2010, 4: e876. DOI: 10.1371/journal.pntd.0000876
[9]Rajendran C, Su C, Dubey JP. Molecular genotyping ofToxoplasmagondiifrom Central and South America revealed high diversity within and between populations[J]. Infect Genet Evol, 2012, 12: 359-368. DOI: 10.1016/j.meegid.2011.12.010
[10]Su C, Khan A, Zhou P, et al. Globally diverseToxoplasmagondiiisolates comprise six major clades originating from a small number of distinct ancestral lineages[J]. Proc Natl Acad Sci U S A, 2012, 109: 5844-5849. DOI: 10.1073/pnas.1203190109
[11]Gao XJ, Zhao ZJ, He ZH, et al.Toxoplasmagondiiinfection in pregnant women in China[J]. Parasitol, 2011, 139(2): 139-147.DOI: 10.1017/S0031182011001880
[12]Zhou P, Sun XT, Yin CC, et al. Genetic characterization ofToxoplasmagondiiisolates from pigs in southwestern China[J]. J Parasitol, 2011, 97: 1193-1195. DOI: 10.1645/GE-2851.1
[13]Zhou P, Nie H, Zhang LX, et al. Genetic characterization ofToxoplasmagondiiisolates from pigs in China[J]. J Parasitol, 2010, 96: 1027-1029. DOI: 10.1645/GE-2465.1
[14]Dubey JP, Rajapakse RP, Wijesundera RR, et al. Prevalence ofToxoplasmagondiiin dogs from Sri Lanka and genetic characterization of the parasite isolates[J]. Vet Parasitol, 2007, 146: 341-346. DOI: 10.1016/j.vetpar.2007.03.009
[15]Dubey JP, Cortes-Vecino JA, Vargas-Duarte JJ, et al. Prevalence ofToxoplasmagondiiin dogs from Colombia, South America and genetic characterization ofT.gondiiisolates[J]. Vet Parasitol, 2007, 145: 45-50. DOI:10.1016/j.vetpar.2006.12.001
[16]Dubey JP, Huong LT, Sundar N, et al. Genetic characterization ofToxoplasmagondiiisolates in dogs from Vietnam suggests their South American origin[J]. Vet Parasitol, 2007, 146: 347-351. DOI: 10.1016/j.vetpar.2007.03.008
[17]Dubey JP, Sundar N, Hill D, et al. High prevalence and abundant atypical genotypes ofToxoplasmagondiiisolated from lambs destined for human consumption in the USA[J]. Int J Parasitol, 2008, 38: 999-1006. DOI: 10.1016/j.ijpara.2007.11.012
[18]Chen ZW, Gao JM, Huo XX, et al. Genotyping ofToxoplasmagondiiisolates from cats in different geographic regions of China[J]. Vet Parasitol, 2011, 183(1-2): 166-170. DOI: 10.1016/j.vetpar.2011.06.013
[19]Huang SY, Cong W, Zhou P, et al. First report of genotyping ofToxoplasmagondiiisolates from wild birds in China[J]. J Parasitol, 2012, 98: 681-682. DOI: 10.1645/GE-3038.1
[20]Yang YR,Ying YQ,Verma SK, et al. Isolation and genetic characterization of viableToxoplasmagondiifrom tissues and feces of cats from the central region of China[J]. Vet Parasitol, 2015, 05: 006. DOI: 10.1016/j.vetpar
[21]Li YN, Nie XW, Peng QY, et al. Seroprevalence and genotype ofToxoplasmagondiiin pigs, dogs and cats from Guizhou province, Southwest China[J]. Parasites Vectors, 2015, 8: 214. DOI: 10.1186/s13071-015-0809-2
[22]Wang L, He LY, Meng DD, et al. Seroprevalence and genetic characterization ofToxoplasmagondiiin cancer patients in Anhui Province, Eastern China[J]. Parasites Vectors, 2015, 8: 162. DOI: 10.1186/s13071-015-0778-5
[23]Qian WF, Yan WC, Wang TQ, et al. Prevalence and genetic characterization ofToxoplasmagondiiin pet dogs in central China[J]. Korean J Parasitol, 2015, 53(1): 125-128. DOI: 10.3347/kjp.2015.53.1.125
[24]Miao Q, Huang SY, Qin SY, et al. Genetic characterization ofToxoplasmagondiiinYunnan black goats (Caprahircus) in southwest China by PCR-RFLP[J]. Parasites Vectors, 2015, 8: 57. DOI: 10.1186/s13071-015-0673-0
[25]Tian YM, Huang SY, Miao Q, et al. Genetic characterization ofToxoplasmagondiifrom cats in Yunnan Provinces, Southwestern China[J]. Parasites Vectors, 2014, 7: 178. DOI: 10.1186/1756-3305-7-178
[26]Zhang XX, Lou ZZ, Huang SY, et al. Genetic characterization ofToxoplasmagondiifrom Qinghai vole, Plateau pika and Tibetan ground-tit on the Qinghai-Tibet Plateau, China[J]. Parasit Vectors, 2013, 6: 291. DOI: 10.1186/1756-3305-6-291
[27]Jiang HH, Huang SY, Zhou DH, et al. Genetic characterization ofToxoplasmagondiifrom pigs from different localities in China byPCR-RFLP[J]. Parasites Vectors, 2013, 6: 227. DOI: 10.1186/1756-3305-6-227
[28]Wang L, Chen H, Liu D, et al. Genotypes and mouse virulence ofToxoplasmagondiiisolates from animals and humans in China[J]. PLoS One, 2013, 8(1): e53483. DOI: 10.1371/journal.pone.0053483
[29]Wang L, Cheng HW, Huang KQ, et al.Toxoplasmagondiiprevalence in food animals and rodents in different regions of China: isolation, genotyping and mouse pathogenicity[J]. Parasit Vectors, 2013, 6: 273. DOI: 10.1186/1756-3305-6-273
[30]Qian WF, Wang H, Su CL, et al. Isolation and characterization ofToxoplasmagondiistrains from stray cats revealed a single genotype in Beijing, China[J]. Vet Parasitol, 2012, 187: 408-413. DOI: 10.1016/j.vetpar.2012.01.026
[31]Zhou P, Zhang H, Lin RQ, et al. Genetic characterization ofToxoplasmagondiiisolates from China[J]. Parasitol Int, 2009, 58(2): 193-195. DOI: 10.1016/j.parint.2009.01.006
[32]Dubey JP, Zhu QX, Sundar N, et al. Genetic and biologic characterization ofToxoplasmagondiiisolates of cats from China[J]. Vet Parasitol, 2007, 145: 352-356. DOI: 10.1016/j.vetpar.2006.12
[33]Taylor S, Barragan A, Su C, et al. A secreted serine-threonine kinase determines virulence in the eukaryotic pathogenToxoplasmagondii[J]. Science, 2006, 314(5806): 1776-1780. DOI: 10.1126/science.1133643
[34]Wang L. Genotypes and mouse virulence ofToxoplasmagondiiisolates from animals and humans in China[D]. Hefei: Anhui Medical University, 2012. (in Chinese) 王林. 流行我国的弓形虫分离株基因分型及其毒力研究[D].安徽医科大学,2012.
Genotypes and pathogenesis ofToxoplasmagondiiisolates in China
FU Xiao-ying,FENG Yong-jie,LIANG Hong-de,YANG Yu-rong
(EngineeringCollegeofAnimalHusbandryandVeterinaryScience,HenanAgriculturalUniversity,Zhengzhou450002,China)
Toxoplasmagondii(T.gondii) is a protozoon which infects almost all warm-blooded animals, including humans, and it has a complex life cycle and pathogenesis. The studies aboutT.gondiipopulation structure have shown that it has a genetic diversity and regional differences, recently. Now, 189 genotypes have been identified from 1 457 isolates collected from all around the world (http://ToxoDB.org). In contrast, the isolates from humans and animals from South America are genetically diverse. There was less information about genotypes and virulence ofT.gondiiisolations from China. The present study reviewed the genotypes and their biological characteristics ofT.gondiifrom animals and humans in China and provided basis for the research aboutT.gondiipopulation structure, epidemiology and pathogenic mechanism in the further.
Toxoplasmagondii; genotype; pathogenicity; PCR-restriction fragment length polymorphism (RFLP)
Yang Yu-rong, Email: yangyu7712@sina.com
国家自然科学基金(No. 30800812)
杨玉荣,Email:yangyu7712@sina.com
河南农业大学牧医工程学院,郑州 450002
10.3969/cjz.j.issn.1002-2694.2015.07.016
R382.5
A
1002-2694(2015)07-0669-05
2015-01-12;
2015-05-25

Supported by the National Nature Science Foundation of China (No.30800812)

