四翼无刺线虫形态和分子鉴定
高正琴,岳秉飞
四翼无刺线虫形态和分子鉴定
高正琴,岳秉飞
目的 四翼无刺线虫是一种重要的人兽共患寄生虫病的病原,其对实验动物的感染危害严重。然而,缺乏有效检测鉴定四翼无刺线虫的技术。本研究目的是建立四翼无刺线虫诊断方法,为国家标准的修订提供科学依据。方法 应用直接镜检法对肠道中的四翼无刺线虫进行筛查。应用多重PCR和测序技术鉴定四翼无刺线虫特定基因nd1、nd5、cox1、cytb、ITS2和28S rRNA。结果 采用直接镜检实时动态显微视频技术在肠道中检出数量众多的四翼无刺线虫虫卵、幼虫和成虫。根据四翼无刺线虫的卵细胞、幼虫、雌雄成虫的大小和形态来鉴定虫种。应用多重PCR和测序技术从分离获得的四翼无刺线虫中鉴定出特定基因nd1、nd5、cox1、cytb、ITS2和28S rRNA,与其他不同种寄生虫无交叉反应。SPF和清洁级实验动物四翼无刺线虫感染率分别为41.5%和40.8%。结论 直接镜检法和多重PCR结合测序技术能够快速准确检测鉴定出四翼无刺线虫。实验动物在四翼无刺线虫的传播中可能起着重要的储存作用。因此,需要考虑该寄生虫的潜在健康危害,以防传染人类。
四翼无刺线虫;直接镜检;多重PCR;测序
四翼无刺线虫(Aspiculuristetraptera)隶属于线虫纲(Class Nematoda)、尖尾目(Order Oxyurida)、尖尾科(Family Oxyuroidea)、无刺属(Genus Aspiculuris),又称蛲虫(Pinworm),可引起蛲虫病(enterobiasis),呈世界性分布,寄生于肠道,生活史属直接型,轻度感染时无明显症状,严重时引起粪便嵌塞、直肠脱垂、肠套叠和肠炎等疾病,粪检发现虫卵或尸检发现虫体即可确诊[1-3]。
近年来,SPF(Specific Pathogen-Free,无特定病原体)和清洁级实验动物已广泛应用于食品药品生物制品医疗器械的检定和研究。中华人民共和国国家标准(GB/T 14922.1-2001)规定:蠕虫是SPF和清洁级实验动物均应排除的寄生虫项目之一,但国家标准中未见四翼无刺线虫的检测方法[4-5]。因此,快速准确检测四翼无刺线虫是一个重要问题。目前,尚未见不同方法检测鉴定SPF和清洁级实验动物四翼无刺线虫的报道和有效数据。本研究应用直接镜检和多重PCR(multiple-PCR)结合多基因测序技术,对SPF和清洁级实验动物四翼无刺线虫感染进行检测鉴定和调查研究,为国家标准的修订提供技术支撑和参考依据。
1 材料与方法
1.1 仪器设备 生物安全柜(Thermo Fisher Scientific,美国);LEICA DM2500生物显微镜(Leica Microsystems,德国);倒置显微镜及成像系统(Nikon,日本);二氧化碳培养箱(北京五洲东方科技发展有限公司);基因扩增仪(Applied Biosystyem,美国);凝胶成像分析系统(东乐自然基因生命科学公司)。
1.2 样品来源 293只SPF和清洁级实验动物来自18个生产厂家。安乐死后采肠样本待检。
1.3 直接镜检 取待测样本,放入洁净离心管中,加入生理盐水,轻轻吹打混匀,室温孵育30 min;弃上清,沉淀以生理盐水重新悬浮,室温孵育20 min;弃上清,沉淀以生理盐水重新悬浮,室温孵育15 min;弃上清,沉淀以生理盐水充分混匀,吸取混合液滴片,直接镜检,采用实时动态显微视频摄录结果。根据蠕虫的虫卵、幼虫、成虫的形态和大小来进行虫种的鉴定。
1.4 虫体和虫卵离体生存能力试验 取待测样本,放入洁净离心管中,加入磷酸盐缓冲液,轻轻吹打混匀,室温静置5 min,1 000 r/min离心5 min,弃上清,沉淀重新以磷酸盐缓冲液吹打悬浮,小心收集数条鲜活虫体和数只虫卵,放置于新鲜配制的含10%胎牛血清和1%青/链霉素的DMEM培养液中,37 ℃ 5% CO2实验条件下放置,倒置显微镜下观察虫体和虫卵存活状态,实时拍摄记录结果。
1.5 多重PCR和测序 针对四翼无刺线虫的特定基因nd1(烟酰胺腺嘌呤二核苷酸脱氢酶亚基1,NADH dehydrogenase subunit 1)、nd5(烟酰胺腺嘌呤二核苷酸脱氢酶亚基5,NADH dehydrogenase subunit 5)、cox1(细胞色素C过氧化物酶亚基1,cytochrome c oxidase subunit 1)、cytb(细胞色素b,cytochrome b)、ITS2(内转录间隔区2,internal transcribed spacer 2)和28S rRNA(28S核糖体核糖核酸,28S ribosomal RNA)设计六对引物。多重PCR引物名称、序列和产物大小见表1。同上收集待测样本中数条鲜活虫体,放置于洁净离心管中,用德国Qiagen公司的QIAamp DNA Mini Kit试剂盒,按说明书操作提取样品基因组DNA。以抽提的待测虫体样本DNA为模板,同时用隐匿管状线虫(Syphaciaobvelata)、鼠管状线虫(Syphaciamuris)DNA作为多重PCR阴性对照。PCR总反应体系为50 μL,包括10 × Buffer (Mg2+Plus) 5.0 μL、dNTP Mixture 4.0 μL、正反向引物(1.0 μmol/μL)各0.5 μL、EX Taq(5 U/μL)0. 25 μL、模板DNA 5.0 μL、nuclease-free water 34.75 μL。循环参数:94 ℃ 1 min 1 cycle;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,40 cycles;72 ℃ 10 min 1 cycle。琼脂糖凝胶电泳检测多重PCR扩增产物。阳性样本作测序鉴定。
2 结 果
2.1 直接镜检结果 吸取SPF和清洁级实验动物肠样本中鲜活虫体,快速滴片,实时动态显微视频摄录记载虫体形态特征及运动方式:镜下观察,可见数量众多的外观略呈无色透明的鲜活蠕虫虫体游走蠕动,处于不同分化时期的虫卵和幼虫数量较多。雌虫长2.86~3.97 mm,口孔在虫体头部顶端,有3个唇瓣环绕,口孔两旁有明显的半椭圆形的头泡。头部有宽的颈翼,颈翼膜起自头泡、终于食道基部。食道前部呈棒状,后为一卵圆形食道球(图1)。卵巢2条,起始于食道基部。阴门开口于虫体中部,子宫壁粗厚,子宫内有成熟卵(图2)。尾部呈圆锥状(图3)。雄虫长2.13~3.64 mm,有宽尾翼,无交合刺和引器(图4)。虫卵无色透明,呈对称的椭圆形,大小为(86~97)μm×(37~49)μm,内含物为桑椹期胚细胞,胚细胞与卵壳间有空隙,卵壳薄(图5)。依据蠕虫虫体的形态、大小、构造和虫卵的形状、大小、颜色、卵壳特征,鉴定为四翼无刺线虫。
2.2虫体和虫卵离体生存能力试验结果 将从待测样本中收集到的四翼无刺线虫虫体和虫卵,37 ℃ 5% CO2实验条件下放置,结果发现:在37 ℃四翼无刺线虫离体至少能够存活两周。第8 d时,四翼无刺线虫虫卵具胚胎(图6)。第10 d时,四翼无刺线虫雌虫显得倦怠行动迟缓(图7),雄虫活力减弱尚可运动(图8)。第14 d后,四翼无刺线虫虫体已无自主运动能力,出现死亡。

表1 多重PCR引物
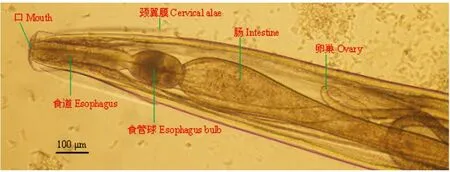
图1 四翼无刺线虫雌性成虫前部
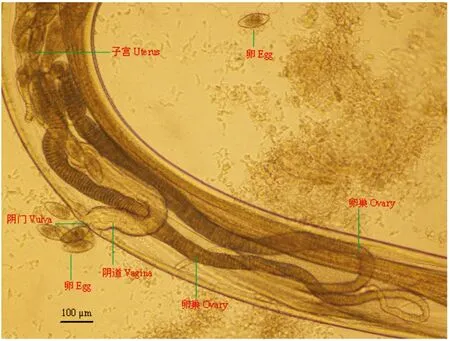
图2 四翼无刺线虫雌性成虫腹部
2.3 多重PCR结果 在上述收集到的实验动物数条鲜活虫体样品中均检测出四翼无刺线虫特定基因nd1、nd5、cox1、cytb、ITS2和28S rRNA基因特异性DNA片段(大小分别为405 bp、435 bp、561 bp、282 bp、397 bp和600 bp),而作为阴性对照的隐匿管状线虫、鼠管状线虫样本却未观察到目的基因片段扩增。图9显示的是实验动物四翼无刺线虫多重PCR扩增产物琼脂糖凝胶电泳结果。实验动物四翼无刺线虫多重PCR扩增获得了清晰特异的nd1、nd5、cox1、cytb、ITS2和28S rRNA基因目的条带。实验动物四翼无刺线虫nd1、nd5、cox1、cytb、ITS2和28S rRNA基因序列测定分析结果与国际上已公布的四翼无刺线虫基因序列同源性为100%(GenBank登录号为KF444331.1,KF444351.1,KF444311.1,KF444291.1,KJ143618.1和KF771644.1)。分子鉴定结果证明实验动物自然感染的确实是四翼无刺线虫。
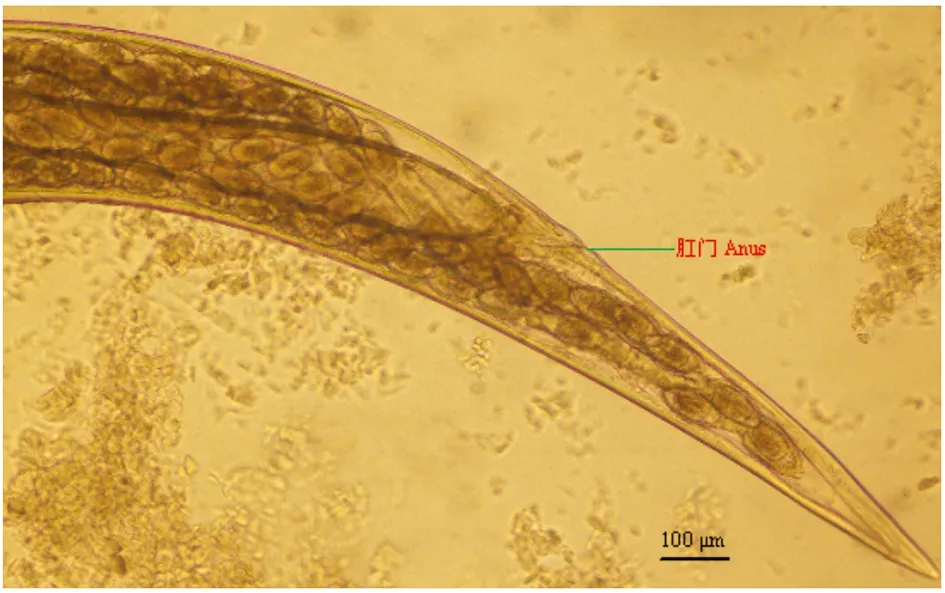
图3 四翼无刺线虫雌性成虫尾部
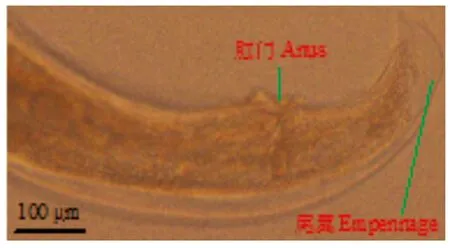
图4 四翼无刺线虫雄性成虫尾部

图5 四翼无刺线虫虫卵
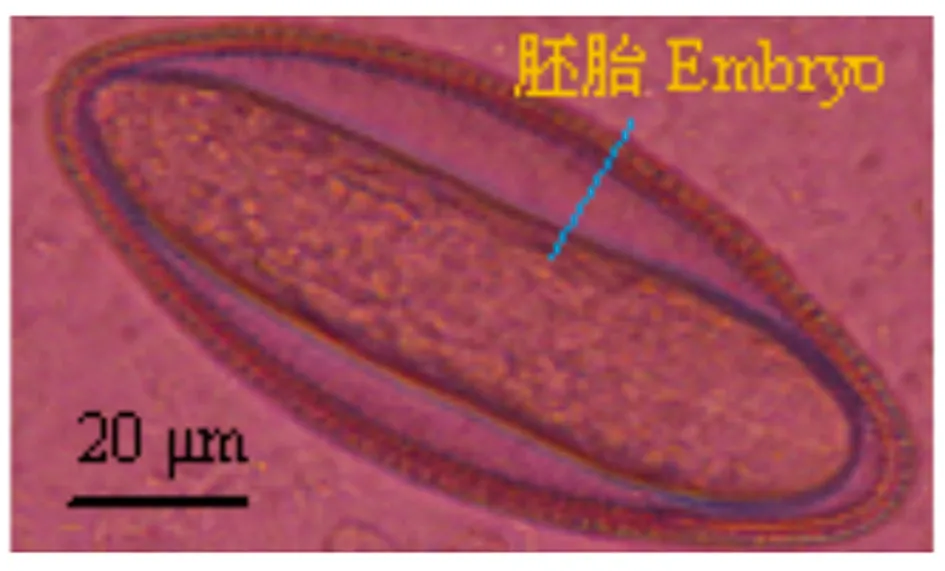
图6 实验动物四翼无刺线虫虫卵在37℃ 5% CO2第8 d镜检形态
Fig.6 Microscopy morphology ofAspiculuristetrapteraegg isolated from laboratory animal under 37℃ for 5% CO2on day 8
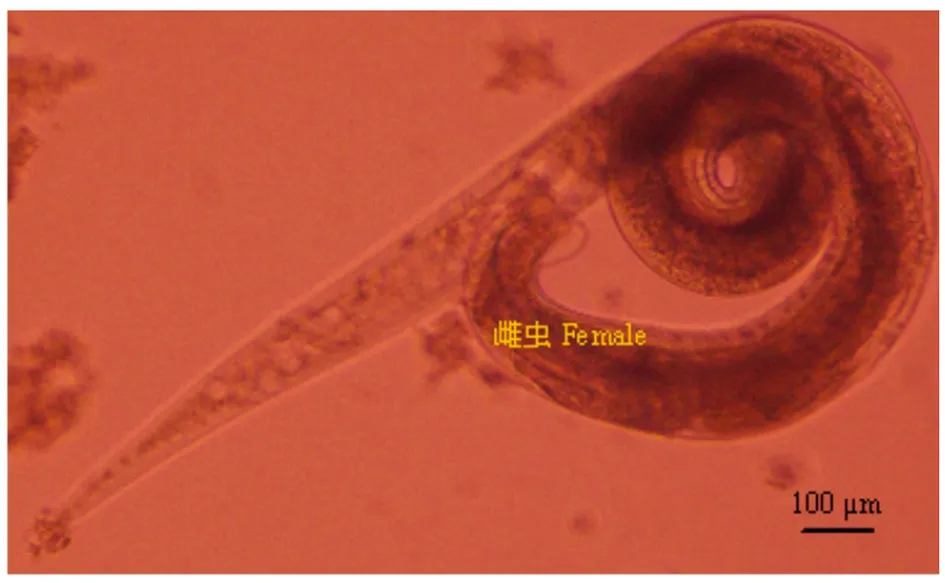
图7 实验动物四翼无刺线虫雌性成虫在37℃ 5% CO2第10 d镜检形态
Fig.7 Microscopy morphology ofAspiculuristetrapterafemale adult isolated from laboratory animal under 37℃ for 5% CO2on day 10
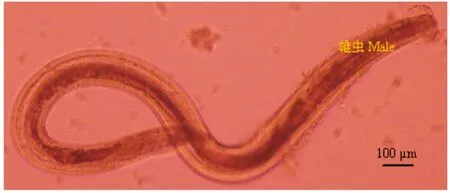
图8 实验动物四翼无刺线虫雄性成虫在37 ℃ 5% CO2第10 d镜检形态
Fig.8 Microscopy morphology ofAspiculuristetrapteramale adult isolated from laboratory animal under 37℃ for 5% CO2on day 10
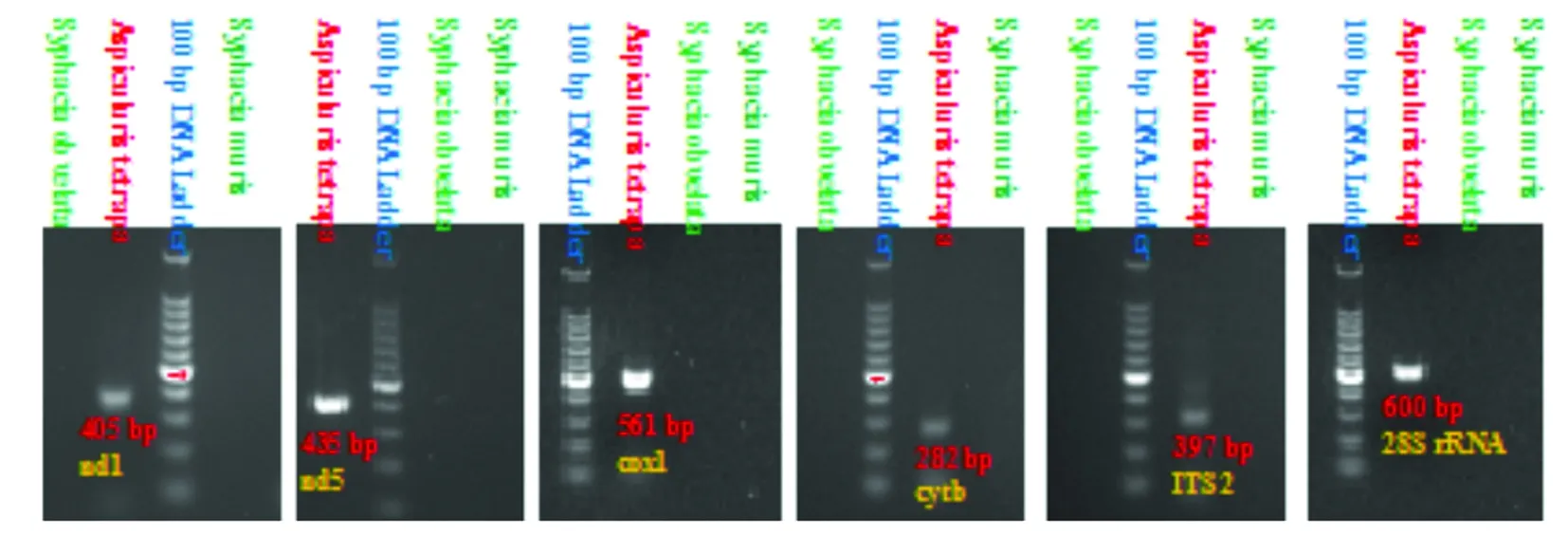
图9 多重PCR扩增实验动物四翼无刺线虫nd1(405 bp)、nd5(435 bp)、cox1(561 bp)、cytb(282 bp)、ITS2(397 bp)和28S rRNA(600 bp)基因特异性DNA片段琼脂糖凝胶电泳
Fig.9 Agarose gel electrophoresis of multiplex PCR products amplified by primers targeted nd1 (405 bp), nd5 (435 bp), cox1 (561 bp), cytb (282 bp), ITS2 (397 bp) and 28S rRNA (600 bp) genes specific DNA of genomic DNA extracted fromAspiculuristetrapteraisolated from laboratory animal
结果显示,直接镜检法和多重PCR结合测序技术均能检测出四翼无刺线虫。在SPF和清洁级实验动物中检出数量众多的四翼无刺线虫虫体和虫卵,鉴定出四翼无刺线虫特定基因nd1、nd5、cox1、cytb、ITS2和28S rRNA基因。13个生产厂家31批195只SPF实验动物四翼无刺线虫检出率41.5%(81/195)。5个生产厂家10批98只清洁级实验动物四翼无刺线虫检出率40.8%(40/98)。
3 讨 论
Behnke[6]报道英国野鼠四翼无刺线虫感染发病率达56%。Kia[7]报道伊朗野鼠四翼无刺线虫感染率达11.8%。Pritchett[8]报道北美普通级实验小鼠四翼无刺线虫感染率为0.19%。Bazzano[9]报道巴西普通级实验动物四翼无刺线虫感染率达8.5%。Dole[10]报道美国SPF级实验小鼠四翼无刺线虫感染率达9.2%。我们的研究调查结果显示我国SPF和清洁级动物四翼无刺线虫感染率分别为41.5%和40.8%。实验动物寄生虫感染可为人体感染寄生虫病起到一定的储存和传播病原的作用,在流行病学上具有重要意义。人兽共患病名录中人兽共患寄生虫病69种,我国存在60种[11-13]。最近我国时有SPF实验动物因人兽共患寄生虫感染致死的报道[14-15]。由此可见,我国实验动物感染人兽共患寄生虫的现状不容乐观,实验动物携带的人兽共患寄生虫病原体,不仅污染环境、饮水、饲料、垫料、空气,同时也对人类健康造成危害,已污染的实验动物用于食品药品生物制品医疗器械检定后果不堪设想。因此,实验动物生产厂家和饲养繁育单位一定要重视人兽共患寄生虫病原体的生物安全性问题,一定要及时对已污染实验动物的粪便、垫料、笼器具等进行彻底的灭菌消毒并作无害化处理,避免污染公共水源和周边环境,强化公共卫生安全防控意识,保护人民身体健康,保障人民用药安全。
Hsieh[16]报道四翼无刺线虫虫卵能在水中具胚胎,这一特征可使其在宿主体外依然有生存力。Phillipson[17]报道四翼无刺线虫感染潜伏期为21~25 d,幼虫在结肠内孵化,成虫迁移到远端结肠前逗留3~5 d,一条成年雌性四翼无刺线虫平均每天产卵17个,5~8 d后成为感染性虫卵,雌性四翼无刺线虫寿命为45~50 d。本文作者在37℃ 5% CO2实验条件下研究发现,四翼无刺线虫虫卵在体外第8 d时具胚胎有感染性,雌性和雄性成虫离体能存活两周。本研究获得的寄生虫可作为模式生物,用于抗寄生虫药物筛选研究,也可作为人类寄生虫疾病动物模型制备材料,用于寄生虫致病机理的深入研究。
Parel[18]报道用核糖体rDNA基因作为鉴定四翼无刺线虫的靶基因,但在PCR扩增后还需要酶切电泳,操作繁琐易污染。而我们的研究则将经典的形态学检查鉴定方法和最新的分子生物学检测鉴定方法结合起来应用于实验动物四翼无刺线虫感染诊断调查,首先采用直接镜检实时动态显微视频技术监测实验动物肠道四翼无刺线虫,获得了雌雄成虫、幼虫和虫卵独特形态构造宝贵视频资料;同时应用多重PCR和测序技术对分离获得的四翼无刺线虫成虫、幼虫和虫卵进行多基因特征的确证,鉴定核实了四翼无刺线虫特定的nd1、nd5、cox1、cytb、ITS2和28S rRNA基因,可作为今后四翼无刺线虫检测鉴定的靶标,获得的多位点基因数据可用于四翼无刺线虫遗传多样性研究,为国家标准的修订提供了技术支撑和参考依据。
欧洲实验动物学会联合会[19]制定了统一的欧洲标准,规定实验小鼠、大鼠、地鼠、沙鼠、豚鼠、兔必检无刺线虫属。日本中央实验动物研究所实验动物质量控制标准规定必检四翼无刺线虫。随着我国经济发展和对外交流增加,实验动物在生物医药研究领域中作用也愈显重要,因此,适应全球经济一体化,研究国外标准,以我国实验动物寄生虫监测调研基础数据作为科学依据,修订完善国家标准显得非常必要,这需要更多确定的研究予以支持。
综上所述,直接镜检法和多重PCR结合测序技术能够快速准确检测鉴定出四翼无刺线虫。四翼无刺线虫是一种重要的人兽共患寄生虫病的病原,其对实验动物的感染危害严重。实验动物在四翼无刺线虫的传播中可能起着重要的贮存作用。因此,需要考虑该寄生虫的潜在健康危害,以防传染人类。
[1]Lykova NI, Timonov EV, Veretennikova NL. A luminescence microscopy method for studying organ function inAspiculuristetraptera(Schulz, 1924)[J]. Med Parazitol (Mosk), 1994, (2): 29.
[2]Wharton DA. The structure of the egg-shell ofAspiculuristetrapteraSchulz (Nematoda: Oxyuroidea)[J]. Parasitology, 1979, 78(2): 145.
[3]Behnke JM. The prevalence of infection in male and female mice[J]. J Helminthol, 1975, 49(2): 85.
[4]National Standard of the People s Republic of China[S]. GB∕T 18448.10-2001. 2001, 28.
[5]National Standard of the People′s Republic of China[S]. GB∕T 14922.1-2001. 2001, 2.
[6]Behnke JM. Age resistance and acquired immunity[J]. J Helminthol, 1976, 50(3): 197.
[7]Kia EB, Shahryary-Rad E, Mohebali M, et al. Endoparasites of rodents and their zoonotic importance in Germi, Dashte-Mogan, Ardabil province, Iran[J]. Iranian J Parasitol, 2010, 5(4): 15.
[8]Pritchett-Corning KR, Cosentino J, Clifford CB. Contemporary prevalence of infectious agents in laboratory mice and rats[J]. Lab Anim, 2009, 43(2): 165.
[9]Bazzano T, Restel TI, Pinto RM, et al. Patterns of infection with the nematodesSyphaciaobvelataandAspiculuristetrapterain conventionally maintained laboratory mice[J]. Mem Inst Oswaldo Cruz, 2002, 97(6): 847.
[10]Dole VS, Zaias J, Kyricopoulos-Cleasby DM, et al. Comparison of traditional and PCR methods during screening for and confirmation ofAspiculuristetrapterain a mouse facility[J]. J Am Assoc Lab Anim Sci, 2011, 50(6): 904.
[11]Taylor LH, Latham SM, Woolhouse ME. Risk factors for human disease emergence[J]. Philos Trans R Soc Lond B Biol Sci, 2001, 356(1411): 983.
[12]Woolhouse ME, Gowtage-Sequeria S. Host range and emerging and reemerging pathogens[J]. Emerg Infect Dis, 2005, 1(12): 1842.
[13]Yu ES, Huang F, Pan L, et al. Zoonotic pathogens species[J]. Chin J Zoonoses, 2006, 22(6): 485. 于恩庶,黄丰,潘亮,等.当今人兽共患病原体分类[J].中国人兽共患病学报,2006, 22(6): 485.
[14]Gao ZQ, He ZQ, Guan WH. Pathogenic and molecular diagnoses ofStrongyloidesstercoralisinfection in tumor transplanted nude mice[J]. Chin J Compa Med, 2014, 24(7): 51.
[15]Gao ZQ, He ZM, Yue BF. Diagnoses ofGiardialamblia[J]. Chin J Compa Med, 2015, 25(1): 76.
[16]Hsieh KY. The effect of the standard pinworm chemotherapeutic agents on the mouse pinwormAspiculuristetraptera[J]. Am J Hyg, 1952, 56(3): 287.
[17]Phillipson RF. Intermittent egg release byAspiculuristetrapterain mice[J]. Parasitology, 1974, 69(2): 207.
[18]Parel JD, Galula JU, Ooi HK. Characterization of rDNA sequences fromSyphaciaobvelata,Syphaciamuris, andAspiculuristetrapteraand development of a PCR-based method for identification[J]. Vet Parasitol, 2008, 153(3-4): 379.
[19]Rehbinder C, Baneux P, Forbes D, et al. FELASA-Recommendations for the health monitoring of mouse, rat, hamster, gerbil, guinea pig and rabbit experimental units[J]. Lab Anim Sci, 1996, 30(3): 193.
Morphological and molecular identification ofAspiculuristetraptera
GAO Zheng-qin,YUE Bing-fei
(NationalInstitutesforFoodandDrugControl,Beijing100050, China)
Aspiculuristetrapterais a pathogen of parasitic zoonoses, which is one of the most harmful parasites infecting laboratory animals. However, limited data are available on an effective technique for detection and identification ofAspiculuristetraptera. The aim of this study is to develop the method for diagnosis ofAspiculuristetraptera. It could provide a scientific basis for revision of national standard. Direct examination of intestines was performed to screen forAspiculuristetraptera. Moreover, multiplex-PCR and sequencing were applied to identify the parasite by constructing species-specific primers that were designed for unique regions of the nd1, nd5, cox1, cytb, ITS2 and 28S rRNA genes ofAspiculuristetraptera. Results showed that numerous ofAspiculuristetrapterawere detected in intestines by direct microscopy using real-time dynamic microscopic video.Aspiculuristetrapterawas speciated based on the morphology and size of ovum, larvae, female and male adult worm. Multiplex-PCR and sequencing were performed to identify nd1, nd5, cox1, cytb, ITS2 and 28S rRNA genes of DNA extracted from the parasite identifiedAspiculuristetraptera. This approach allowed their specific identification with no amplicon being amplified from heterogeneous DNA samples, and sequencing confirmed the identity of the sequences amplified. Direct microscopy, multiplex-PCR and sequencing can be used to detect and identifyAspiculuristetraptera. Of the SPF and cleaning laboratory animals studied,Aspiculuristetrapterawere presented overall frequencies of 41.5% and 40.8%, respectively. Direct microscopy, multiplex-PCR and sequencing are effective techniques with high specificity and sensitivity and could serve as useful tools for detection and identification ofAspiculuristetraptera. Laboratory animals may serve as an important reservoir for transmission ofAspiculuristetraptera. Therefore, the potential health hazard of the parasite needs to be considered to prevent infectivity of humans.
Aspiculuristetraptera, direct microscopy, multiplex-PCR, sequencing
Yue Bin-fei, Email: gaozhengqin@126.com
岳秉飞,Email: gaozhengqin@126.com
中国食品药品检定研究院,北京 100050
10.3969/cjz.j.issn.1002-2694.2015.07.009
R383
A
1002-2694(2015)07-0635-05
2015-01-15;
2015-05-20


