粉尘螨α-烯醇化酶基因的克隆表达、纯化及其N端B细胞表位的初步鉴定
罗文丽,邱聪龄,余炜嘉,刘志刚,2,吉坤美,2,蔡泽浪,2
粉尘螨α-烯醇化酶基因的克隆表达、纯化及其N端B细胞表位的初步鉴定
罗文丽1,邱聪龄1,余炜嘉1,刘志刚1,2,吉坤美1,2,蔡泽浪1,2
目的 克隆表达粉尘螨(Dermatophagoidesfarinae)α-烯醇化酶(alpha-enolase,ENOA)基因,初步研究其N端B细胞表位与自身免疫性疾病的关系。方法 ①设计特异性引物,从文库中克隆ENOA cDNA;②通过BamH I/EcoR I双酶切位点,将ENOA基因克隆至pET-His原核表达载体,表达纯化,获得了重组ENOA蛋白;③测定重组ENOA酶活性;④通过Swiss-Model软件模拟ENOA蛋白3D结构,并分析其潜在的N端B细胞表位;合成ENOA的N端表位肽,测定其与类风湿性关节炎患者血清IgG的反应性。结果 ①克隆了ENOA全长cDNA (GenBank 登录号KJ421213.1);②成功构建了pET-His-ENOA 表达载体,经纯化获得了重组ENOA蛋白。③重组蛋白具有烯醇化酶活性;④瓜氨酸修饰的合成表位肽与类风湿性关节患者血清IgG-ELISA呈阳性反应,与健康对照组血清均不呈反应(P<0.05 )。结论 本课题首次克隆表达的重组ENOA蛋白具有烯醇化酶活性;其N端B细胞表位与类风湿性关节炎相关。本研究为尘螨与自身免疫性疾病的相关性研究提供了新的思路。
粉尘螨;α-烯醇化酶;类风湿性关节;表位
Supported by the National Natural Science Foundation of China (Nos. 31328014 and 31400786), the Natural Science Foundation of Guangdong Province (No.2014A030313563), and the Science and Technology Foundation of Shenzhen City (No. JCYJ20120613113021045 and JCYJ20130326112225593) Corresponding author: Cai Ze-lang, Email:szuczlang@163.com
自身免疫性疾病如类风湿性关节等患者机体存在一类抗体,对自身抗原发生免疫反应而损害自身组织[1]。研究发现α-烯醇化酶(α-Enolase,ENOA)不仅是体内参与糖酵解途径的催化酶,而且作为一个多功能的分子参与人类自身免疫性疾病、过敏性疾病以及癌症等多种疾病的病理生理过程。Rattner等首次报道了系统性风湿疾病患者体内存在抗α-Enolase抗体[2]。抗α-Enolase的自身抗体通过识别膜结合形式的α-Enolase从而干扰其功能导致诱发局部的炎症反应[3]。Andrew Kinloch等[4]研究表明类风湿性关节炎(Rheumatoid Arthritis,RA)患者体内也存在抗α-Enolase抗体,α-Enolase可发生瓜氨酸化,从而刺激生物体产生自身抗原特异的抗体。此外,红斑狼疮患者血清与重组酵母α-Enolase具有交叉抗原抗体结合反应[5]。
尘螨是最主要的室内吸入性致敏原,可引起多种过敏性疾病,如过敏性哮喘、过敏性鼻炎等。致敏尘螨物种主要包括粉尘螨(Dermatophagoidesfarinae,Der f)和屋尘螨(Derpmaatophagoidespteronyssinus,Der p)[6-7]等,目前已经分离鉴定并正式命名了24组尘螨过敏原成份,它们与过敏性疾病的关系比较明确[8]。但尘螨与自身免疫性疾病是否相关尚待研究[9-10]。本课题在解析了粉尘螨转录组的基础上[8],通过同源比对寻找到粉尘螨α-烯醇化酶cDNA序列,进行了克隆和表达,并初步探讨它是否存在交叉抗原表位,从而与类风湿性关节炎ENOA自身抗体反应。
1 材料与方法
1.1 材料
1.1.1 主要试剂与材料 实验中使用的粉尘螨(Dermatophagoidesfarinae)cDNA文库和大肠埃希氏菌E.coliTOP10、表达载体pET-His vector由深圳大学过敏反应与免疫学研究所保存。质粒提取、琼脂糖凝胶DNA回收、DNA Marker、LA Taq DNA聚合酶、BamH I及EcoR I、T4 DNA ligase购自TaKaRa公司,蛋白分子量Marker购自Fermentas公司, Ni2+-Chelating Sepharose及层析柱购自GE公司。其余试剂均为国产或进口分析纯试剂。
1.1.2血清 64例RA患者血清及26例健康对照血清标本来源于深圳市第二人民医院,其中,RA血清标本:男34例,女30例,年龄26~72岁;健康对照血清标本:男15例,女11例,年龄22~60岁。
1.2实验方法
1.2.1粉尘螨ENOA的 cDNA克隆 根据同源比对分析结果,在粉尘螨基因组中找到编号(Locus tag)为DEFA_132640的ENOA对应的同源基因。以粉尘螨cDNA文库为模板,根据ENOA的序列设计特异性PCR引物,上游和下游引物的序列分别为:
5’-ATGTCCATTCAAAAGATTTATG-3’,5’-TTAAATTGGATGACGGAAATTT -3’。通过PCR得到产物,电泳检测并切胶回收,经转化克隆到pMD19-T载体上挑取单菌落,进行Sanger双向测序,分析测序结果。
1.2.2粉尘螨ENOA编码基因的人工合成 选用大肠杆菌偏爱密码子,优化设计粉尘螨ENOA编码基因序列,人工合成该基因,5’端含有BamH I酶切位点,3’端含有终止密码和EcoR I酶切位点,合成基因克隆pUC57载体上测序确认,该实验由南京金斯瑞公司完成。
1.2.3 pET-His-ENOA重组表达质粒的构建与原核表达 将pUC57-ENOA 双酶切BamH I/EcoR I后电泳回收目的基因,克隆至原核表达载体pET-His,构建表达质粒pET-His-ENOA,经测序鉴定正确后转化到大肠杆菌E.coliBL21(DE3)plysS感受态,挑选抗氨苄青霉素(Amp)阳性菌落,加入20 mL含100 μg/mL Amp的新鲜LB液体培养基中,37 ℃,200 r/min,过夜培养。次日转种到1L灭菌的新鲜LB液体培养基进行培养;待细菌生长处于对数生长期(A600nm=0.6左右)时,加入终浓度为1 mmol/L的IPTG诱导表达。3 h后4 ℃离心收集菌体,进行SDS-PAGE电泳来检测表达情况。
1.2.4 重组ENOA蛋白纯化 以10 mL/g湿菌体的比例加入适量50 mmol/L Tris+150 mmol/L NaCl(pH8.0)蛋白抽提溶液,混匀并加入溶菌酶,冰浴搅拌溶解30 min;冰浴超声波破碎细菌后4 ℃离心(10 000 r/min) 20 min,取上清液上样到Ni2+-Chelating Sepharose层析柱进行蛋白纯化,测定蛋白浓度和SDS-PAGE纯度。
1.2.5 重组ENOA催化活性的测定 参照Pancholi报道的方法[11]测定粉尘螨ENOA的酶催化活性,ENOA可将2-磷酸甘油酸(2-phosphoglyceric acid,2-PGA)转化成磷酸烯醇式丙酮酸phosphoenolpyruvic acid, PEP),此过程可通过240 nm吸光度的变化进行检测。配制酶活检测缓冲液后,加入2 mmol/L的2-PGA,充分混匀;加入终浓度为20 μg/mL的高纯度粉尘螨ENOA蛋白混匀,迅速检测240 nm波长处的紫外吸收值,以10 s为间隔,连续测定3 min;以BSA作为阴性对照蛋白,绘制在240 nm时的吸光度吸光度变化曲线。
1.2.6 ENOA 3D结构模拟及RA相关表位肽的合成 以人ENOA 3D结构(PDB:2psnA)作为参考模板,运用在线软件SWISS-MODEL对粉尘螨ENOA 3D结构进行同源建模,获得其3D模拟结构。J. D. Goules等[12]研究发现瓜氨酸(Citrulline,Cit)化的ENOA可刺激类风湿性关节炎患者产生对自身ENOA特异结合的IgG抗体。结合粉尘螨ENOA 3D结构分析其N端B细胞表位,并合成瓜氨酸化的粉尘螨ENOA和人ENOA的RA相关表位肽,序列如下(Cit为瓜氨酸):

表位肽位置氨基酸序列DustMite_ENOA(5-21aa)CKIYA(Cit)QIFDS(Cit)GNPTLEHuman_ENOA(5-21aa)CKIHA(Cit)EIFDS(Cit)GNPTVE
1.2.7 IgG-ELISA试验及其统计分析 用碳酸盐缓冲液(pH9.0)将粉尘螨ENOA和人ENOA表位肽稀释至4 μg/mL,取96孔酶标板,每孔加入100 μL, 置于4℃包被过夜;用含5% BSA的PBS溶液37 ℃封闭2 h;按照1∶5的比例稀释RA患者血清及阴性对照血清37 ℃孵育1 h; 1∶2 000稀释的辣根过氧化物酶标记的鼠抗人IgG 37 ℃孵育1 h;用TMB进行显色,室温避光静置10 min后,加入2 mol/L硫酸溶液终止反应;在450 nm波长处测定吸光度。应用SPSS13.0软件,对数据采用独立样本t检验,P<0.05即为差异具有统计学意义;采用Pearson方法对相关性进行分析。
2 结 果
2.1 粉尘螨ENOA cDNA克隆及其分析
2.1.1 粉尘螨ENOA的cDNA克隆和测序分析 以粉尘螨cDNA文库为模板,根据ENOA的序列设计特异性PCR引物,进行PCR合成得到ENOA的cDNA(图1)克隆后进行Sanger测序分析。结合粉尘螨基因组和转录组的数据分析[8],本研究克隆了ENOA cDNA全长序列,共1 302 bp,编码 433个氨基酸,已登录GenBank (Accession No.KJ421213.1)。
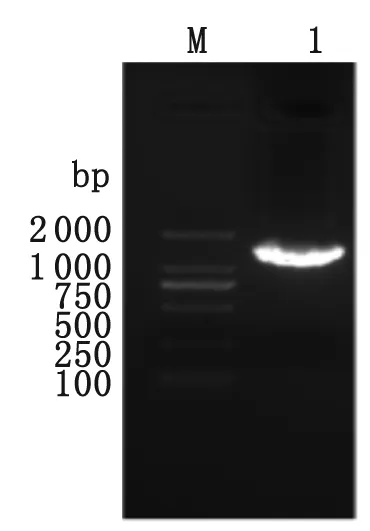
M:DNA分子量 DL2000;1:ENOA cDNA PCR产物
M: DL2000 DNA marker; Lane 1: Products of ENOA cDNA.
图1 PCR扩增ENOA cDNA电泳图谱
Fig.1 Electrophoresis analysis of PCR product of ENOA cDNA
2.1.2 粉尘螨ENOA蛋白序列同源检索 登录GenBank数据库,利用BLAST软件在线进行蛋白质同源检索,结果显示本研究克隆的ENOA属于类烯醇化酶超家族中的一员,氨基酸序列与人(Homosapiens)、小鼠(Musmusculus)和果蝇(Drosophilamelanogaster)的ENOA同源性分别为72%、71%和65%(图2)。

图2 粉尘螨ENOA氨基酸序列与其它物种间的比对
2.2 粉尘螨ENOA基因的人工合成、表达及其蛋白纯化
2.2.1 pET-ENOA重组表达质粒的构建与鉴定 依据粉尘螨ENOA蛋白的CDS编码的氨基酸序列,采用E.coli偏爱密码子人工合成粉尘螨ENOA基因,经DNA测序确正后申请GenBank,登录号为No. KJ421214.1。该基因 5’端和3’端分别含BamHI和EcoRI位点。将ENOA目的基因克隆至表达载体pET-HisBamHI和EcoRI之间,双酶切鉴定并经DNA序列确证(图3)。

M:DNA标志物 DL2000;1:pET-His-ENOABamHI/EcoRI双酶切产物
M: DL2000 DNA Marker; Lane 1: products of pET-His-ENOA double cut byBamHI/EcoRI.
图3 pET-His-ENOA重组质粒BamHI/EcoRI双酶切
Fig.3 Electrophoresis of products of pET-His-ENOA double cut byBamHI/EcoRI
2.2.2 原核系统表达ENOA重组蛋白 测序正确的pET-His-ENOA重组表达质粒,转化至E.coliBL21(DE23)plysS,诱导重组蛋白的表达,分别处理诱导前后菌体进行SDS-PAGE凝胶电泳,目的条带大小为47 kDa左右(如图4)。重组蛋白溶液经Ni2+Sepharose FF柱层析纯化,浓缩后上样Superdex200层析纯化, 经SDS-PAGE分析获得纯的重组ENOA蛋白,浓度为1.2 mg/mL(如图4)。
2.3 重组ENOA酶活性测定 ENOA酶可转化2-PGA为PEP;在240 nm波长下, PEP具有较高的吸光度, 而PGA的吸光度很低。2-PGA加入BSA后在240 nm时的吸光度无变化,BSA在此实验中没有表现出酶催化活性;而2-PGA加入重组ENOA蛋白后在240 nm时的吸光度不断增加,并在一定时间后趋于稳定,表现出酶催化活性(图5)。
2.4 ENOA蛋白3D结构与RA相关表位分析
2.4.1 粉尘螨ENOA蛋白 3D结构模拟 利用SWISS-MODEL在线软件,参考模板(template: 2psnA)对粉尘螨ENOA蛋白进行同源建模,模拟其3D分子结构(图6)。预测粉尘螨ENOA蛋白结构模型中,α螺旋含量为45%,β折叠片为45%。

M:预染蛋白质分子量标志物;1:诱导前;2: IPTG诱导;3:重组蛋白经Ni Sepharose亲和层析纯化;4:重组蛋白经Superdex 200凝胶过滤层析纯化M: Pre-stained Protein Ladder; Lane 1: Before introduction; Lane 2: After introduction by IPTG; Lane 3: rENOA protein purified by Ni2+chelating resin; Lane 4: rENOA protein purified by Superdex 200 gel filtration.
图4 pET-His-ENOA重组质粒的诱导表达纯化
Fig.4 SDS-PAGE analysis of recombinant ENOA
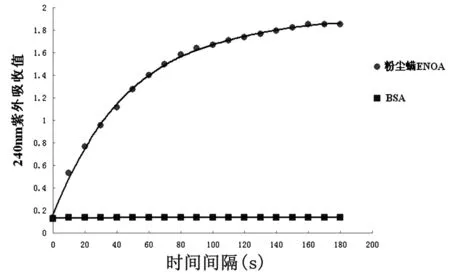
图5 重组ENOA酶催化活性测定
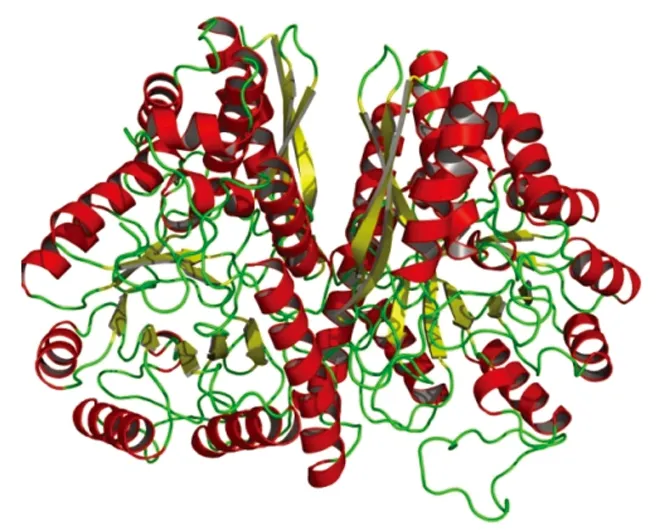
图6 粉尘螨ENOA蛋白 3D结构模拟
2.4.2 人工合成与RA相关的表位肽 粉尘螨ENOA表位肽:CKIYA(Cit)QIFDS(Cit)GNPTLE,分子量为2113.44,HPLC分析合成肽纯度>98%,其中N端Cys含有SH,便于偶联到BSA上。人ENOA表位肽:CKIHA(Cit)EIFDS(Cit)GNPTVE,分子量2074.36,HPLC分析合成肽纯度>98%,其中N端Cys含有SH,便于偶联到BSA上。
2.4.3 IgG-ELISA测定表位肽与RA患者血清结合反应 取64份RA患者血清及26份健康对照血清作为检测对象。实验结果显示,粉尘螨ENOA表位肽与RA患者血清IgG的结合率为17.2%(11/64),与健康人血清无结合活性(cut off值为0.353),见图7(P<0.05)。人ENOA表位肽与RA患者血清IgG的结合活率为10.9% (7/64),与1例健康人血清有结合活性(cut off值为0.3478),见图8(P<0.05),结合率低于J. D. Goules等[17]的报道(37.59%),可能与不同人群有关。粉尘螨ENOA表位肽与人ENOA表位肽两者结合RA患者IgG抗体具有较高的相关性(R2=0.9522,P<0.05),见图9。
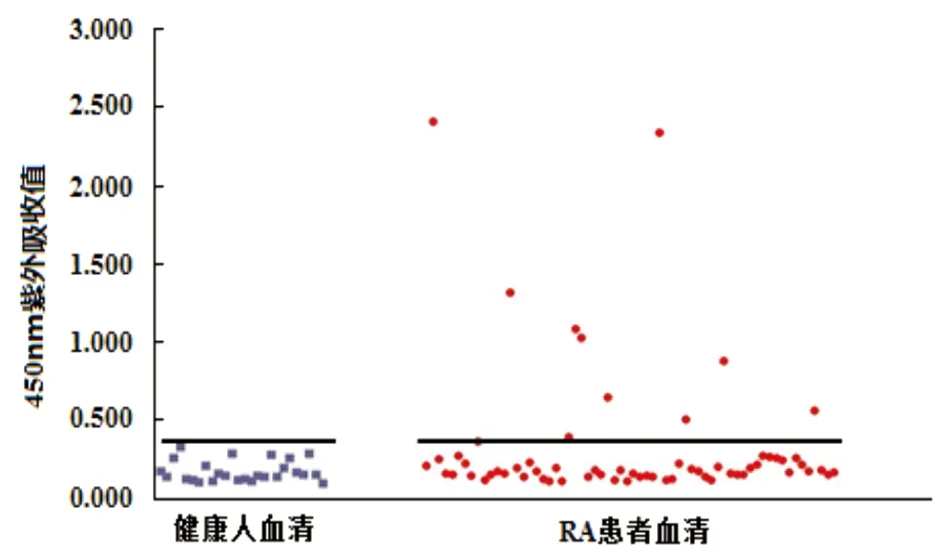
图7 粉尘螨ENOA表位肽与RA患者及健康对照血清IgG结合反应
Fig.7 IgG binding reactivity by Der f α-enolase epitope peptide against IgG antibodies from RA serum and healthy controls respectively
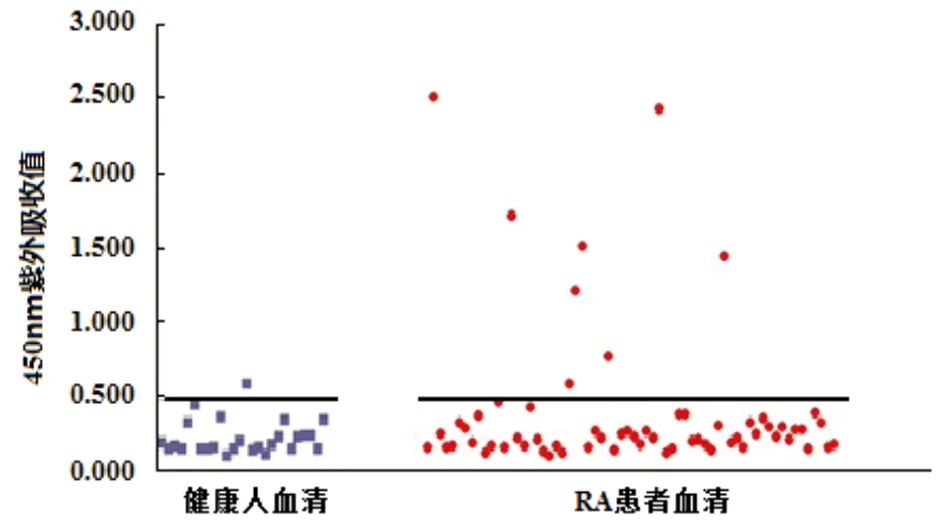
图8 人ENOA表位肽与RA患者及健康对照血清IgG结合反应
Fig.8 IgG binding reactivity by human α-enolase epitope peptide against IgG antibodies from RA serum and healthy controls respectively
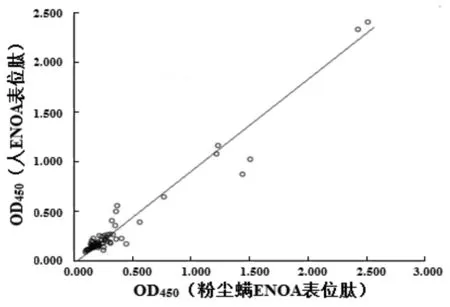
图9 粉尘螨ENOA表位肽和人ENOA表位肽与RA血清IgG结合反应的相关性比较
Fig.9 Correlation between IgG binding activity of Der f α-enolase and human α-enolase epitope peptides against IgG antibodies from RA patient’s serum
3 讨 论
3.1 粉尘螨α-烯醇化酶的克隆表达及酶活性测序 本课题组基于高通量测序解析了粉尘螨基因组和转录组[8];这有利于克隆粉尘螨未知基因开展新的研究。本研究克隆的粉尘螨ENOA cDNA序列1 302 bp,编码433个氨基酸,其结构基因由5个外显子和4个内含子组成;克隆测序结果与高通量测序后拼接的转录组序列一致。此外序列比对后发现,ENOA在不同物种之间的序列同源性较高,这说明ENOA基因在不同物种生物体内是高度保守的。本研究获得了可溶性表达具有酶活性的重组粉尘螨ENOA,为进一步研究提供了生物原材料。
研究表明,真菌中 α-Enolase是一类高度保守的过敏原[13];在部分霉类和乳胶过敏患者体内表现过敏原性;α-Enolase在链格孢霉(Alternariaalternata)和多主枝孢菌(Cladosporiumherbarum)过敏患者中具有较高的IgE结合活性[14];天然乳胶中的主要过敏原Hev b 9就是α-Enolase,它与霉菌α-Enolase有交叉反应性[15]。研究报道链格孢霉(A.alternata)的α-Enolase——Alt a 5是该真菌的第二组主要过敏原,22%的链格孢霉过敏患者中均检测到抗α-Enolase IgE活性[16]。在多主枝菌(C.herbarum)α-Enolase相关的研究中发现,同样作为该真菌的第二主要过敏原的α-Enolase在22%的多主枝孢菌(C.herbarum)过敏患者中检测到IgE阳性[17-18]。此外,在人念珠菌(Candidaalbicans)、啤酒酵母(Saccharomycescerevisiae)、产朊假丝酵母(Candidautilis)的α-Enolase作为主要过敏原并具有交叉反应性[19]。粉尘螨是过敏性疾病最主要的过敏原来源之一,从这一物种中发现新的过敏原蛋白成分是研究过敏性疾病的基础[20]。本研究最初设想克隆粉尘螨α-Enolase研究其致敏原性,但实验结果显示重组粉尘螨α-Enolase与过敏患者及健康对照者血清IgE均有相当一部分反应,两组无显著差异;粉尘螨α-Enolase是否是过敏原尚待进一步研究。
3.2 粉尘螨ENOA与人ENOA自身免疫交叉反应 人体内有多种蛋白与细菌、病原体等外来抗原具有一定的氨基酸序列同源性,这些外来抗原有可能与人体自身蛋白产生交叉免疫反应[1]。粉尘螨ENOA作为外来抗原,与人体自身ENOA抗原氨基酸序列同源性高达72%,可能形成为共同交叉抗原;由交叉抗原刺激人体产生的抗粉尘螨ENOA的抗体,可与有关人体组织中人ENOA发生交叉免疫反应,有可能进一步引起免疫损伤。
在本研究中,我们模拟粉尘螨ENOA蛋白的3D结构,分析其潜在的B表位区段,结合与人ENOA表位区段的分析,设计合成了粉尘螨ENOA与人ENOA的表位肽(5-21aa),检测ENOA表位肽是否结合RA患者血清IgG。本实验发现粉尘螨ENOA表位肽与部分RA患者血清的IgG结合,与健康对照血清无结合活性;粉尘螨ENOA的表位肽和人ENOA表位肽结合RA患者血清IgG抗体水平具有较高的相关性(R2=0.9522)。这表明粉尘螨ENOA与人ENOA存在抗原交叉反应性。一直以来,尘螨是否与自身免疫性疾病相关缺少确切的实验证据;本研究发现提供了直接线索。但粉尘螨与自身免疫性疾病的确切关系需要进一步深入研究。
[1]Pancholi V. Multifunctional alpha-enolase:its role in diseases[J]. Cell Mol Life Sci, 2001, 58: 902-920.
[2]Johnstone SA, Waisman DM, Rattner JB. Enolase is present at the centrosome of HeLa cells[J]. Exp Cell Res, 1992, 202(2): 458-463.
[3]Zhu LA, Fang NY. Alpha-enolase: old protein with new faces[J]. J Int Path Clin Med, 2007, 27(4): 347-350.
[4]Kinloch A, Tatzer V, Wait R, et al. Identification of citrullinated α-enolase as a candidate autoantigen in rheumatoid arthritis[J]. Arthritis Res Ther, 2005, 7(6): 1421-1429.
[5]Gitlits VM, Sentry JW, Matthew ML, et al. Autoantibodies to evolutionarily conserved epitopes of enolase in a patient with discoid lupus erythematosus[J]. Immunology, 1997, 92: 362-368.
[6]Valenta R, Niederberger V. Recombinant allergens for immunotherapy[J]. J Allergy Clin Immunol, 2007, 119(4): 826-830.
[7]Chapman MD, Smith AM, Vailes LD, et al. Recombinant allergens for immunotherapy[J]. Allergy Asthma Proc, 2002, 23(1): 5-8.
[8]Chan TF, Ji KM, Yim KY, et al. The draft genome, transcriptome and microbiome ofDermatophagoidesfarinaereveal a broad spectrum of dust mite allergens[J]. J Allergy Clin Immunol, 2014. (in press)
[9]Honda A, Ametani A, Matsumoto T, et al. Suppression of collagen-induced arthritis in DBA/1J mice by preimmunization with house dust mite extract[J]. Biosci Biotechnol Biochem, 2001, 65(5): 1063-1070.
[10]Bozek A, Kozlowska R, Jarzab J. The safety of specific immunotherapy for patients allergic to house-dust mites and pollen in relation to the development of neoplasia and autoimmune disease: a long-term, observational case-control study[J]. Int Arch Allergy Immunol, 2014, 163(4): 307-312.
[11]Pancholi V, Fischetti VA. α-Enolase, a novel strong plasmin(ogen) binding protein of the surface of pathogenic streptococci[J]. J Biol Chem, 1998, 273: 14503-14515.
[12]Goules JD, Goules AV, Tzioufas AG. Fine specificity of anti-citrullinated peptide antibodies discloses a heterogeneous antibody population in rheumatoid arthritis[J]. British Soc Immunol Clin Exper Immunol, 2013, 174: 10-17.
[13]Breitenbach M, Simon B, Probst G, et al. Enolases are highly conversed fungal allergens[J]. Int Arch Allergy Immunol, 1997, 113: 114-117.
[14]Simon-Nobbe B, Probst G, Kajava AV, et al. IgE-binding epitopes of enolases, a class of highly conserved fungal allergens[J]. J Allergy Clin Immunol, 2000, 106: 887-895.
[15]Wagner S, Breiteneder H, Simon-Nobbe B, et al. Hev b 9, an enolase and a new cross-reactive allergen from hevea latex and molds. Purification, characterization, cloning and expression[J]. Eur J Biochem, 2000, 267(24): 7006-7014.
[16]Achatz G, Oberkofler H, Lechenauer E, et al. Molecular characterization ofAlternariaalternataandCladosporiumherbarumallergens[J]. Adv Exp Med Biol, 1996, 409: 157-161.
[17]Ito K, Ishiguro A, Kanbe T, et al. Detection of IgE antibody againstCandidaalbicansenolase and its cross-reactivity toSaccharomycescerevisiaeenolase[J]. Clin Exp Allergy, 1995, 25: 522-528.
[18]Baldo BA, Baker RS. Inhalant allergies to fungi: reactions to bakers’ yeast (Saccharomycescerevisiae) and identification of bakers’ yeast enolase as an important allergen[J]. Int Arch Allergy Appl Immunol, 1988, 86: 201-208.
[19]Barki M, Koltin Y, Van Wetfiter M, et al. ACandidaalbicanssurface antigen mediating adhesion and autoaggregation inSaccharomycescerevisiae[J]. Infect Immun, 1994, 62(10): 4107-4111.
[20]Pawankar R, Canonica GW, Holgate ST, et al. World allergy organization (WAO) white book on allergy: Update 2013[M]. Geneva: WAO, 2013.
Cloning and expression of alpha-enolase gene fromDermatophagoidesfarinaeand identification of its N-terminal B-cell epitope
LUO Wen-li1,QIU Cong-ling1,YU Wei-jia1,LIU Zhi-gang1,2,JI Kun-mei1,2,CAI Ze-lang1,2
(1.InstituteofAllergyandImmunology,SchoolofMedicine,ShenzhenUniversity,Shenzhen518060,China;2.ShenzhenKeyLaboratoryofAllergyandImmunology,Shenzhen518060,China)
We aimed to clone and express cDNA of alpha-enolase from the dust miteDermatophagoidesfarina(Der f), and study the relationship between its N-terminal B-cell epitope and autoimmune disease. The cDNA of α-enolase was amplified from Der f cDNA library and sub-cloned into a pET-His vector to express inE.coliBL21(DE3)plysS. Recombinant α-enolase was purified and its enzyme activity was determined. The 3D structure was constructed by Swiss-Model. The N-terminal epitope peptide was synthesized and subjected to IgG-ELISA with the patients’ serum of rheumatoid arthritis vs healthy controls. Results showed that the gene encoding α-enolase was cloned from Der f (GenBank accession No. KJ421213.1). The pET-ENOA expression vector was constructed. High pure recombinant α-enolase was obtained with enzyme activity. ELISA demonstrated IgG binding to the citrullinated peptide from 11 of 64 rheumatoid arthritis (RA) patients’ serum samples, but was not bound by IgG antibodies from 26 healthy controls (P<0.05). The present study cloned and expressed α-enolase cDNA from the dust mite. The findings have revealed the dust mite α-enolase might be associated with human rheumatoid arthritis.
Dermatophagoidesfarina; alpha-enolase; rheumatoid arthritis;epitope
国家自然科学基金(No.31328014,No.31400786)、广东省自然科学基金(No.2014A030313563)、深圳市科技计划(No. JCYJ20120613113021045, JCYJ20130326112225593)
蔡泽浪, Email:szuczlang@163.com
1.深圳大学医学院过敏反应与免疫学研究所,深圳 518060; 2.深圳市过敏反应与免疫学重点实验室,深圳 518060
10.3969/cjz.j.issn.1002-2694.2015.07.012
R384.4;R593.22
A
1002-2694(2015)07-0649-06
2014-11-26;
2015-06-03

